Rab27B, un marqueur biologique pour les tumeurs mammaires à

GUNAIKEIA ■ VOL 16 N°7 ■ 2011
221
G1449F_2011
Rab27B, un marqueur biologique
pour les tumeurs mammaires à
récepteurs d’estrogènes positifs avec
un mauvais pronostic?
An Hendrix, Marc Bracke, Olivier De Wever
Laboratoire de Cancérologie expérimentale, département de Radiothérapie et Cancérologie expérimentale, UZ Gent, UG
Keywords: cell-to-cell communication – exocytosis – exosome – heat shocK protein – rab Gtpase – tumor ecosystem
Communiquer via les vésicules
Le transport vésiculaire est important pour la communi-
cation entre les différents compartiments subcellulaires
ainsi qu’entre les cellules et leur environnement extracel-
lulaire. Cette communication est en partie rendue possible
par deux systèmes de transport vésiculaire: l’endocytose
et l’exocytose. Lors de l’endocytose, la cellule absorbe des
composants extracellulaires, tandis que lors de l’exocytose,
la cellule libère des composants à travers la membrane
cellulaire ou la matrice extracellulaire.
Ces deux processus jouent un rôle central dans la physiolo-
gie normale d’une cellule. Premièrement, ils interviennent
dans la biosynthèse de la cellule. Lors de l’endocytose, des
éléments tels que le cholestérol peuvent être absorbés,
tandis que l’incorporation de protéines et de lipides dans
la membrane se fait lors de l’exocytose. Deuxièmement,
ces processus assurent une signalisation cellulaire: les
récepteurs présents à la surface de la cellule peuvent être
intériorisés en réaction à un stimulus externe, l’exocytose
peut libérer des molécules de signalisation comme des
hormones et des facteurs de croissance (1).
Le bon fonctionnement du transport vésiculaire est assuré
par les Rab, de petites protéines qui lient le GTP (guano-
sine triphosphate). Plus de 60 Rab différents ont déjà été
identifiés. Les Rab GTPases se situent du côté cytosolique
des membranes vésiculaires. Les Rab GTPases actives inter-
agissent avec toute une série de protéines Rab effectrices
spécifiques pour vérifier chaque étape du transport vési-
culaire: la formation de la vésicule, le transport à travers
les éléments du cytosquelette et l’ancrage de la vésicule à
la membrane cible suivi par une fusion et une libération
du contenu (2).
Problème de transport vésiculaire dans
une cellule cancéreuse
Le cancer résulte d’une accumulation progressive de mo-
difications génétiques cellulaires qui «libèrent» les cellules
cancéreuses des limites homéostatiques contrôlant la pro-
lifération cellulaire normale (3). A la suite de ces modifi-
cations génétiques, les cellules cancéreuses développent
en effet de nouvelles caractéristiques: elles peuvent pro-
liférer presque indéfiniment, elles favorisent la formation
de vaisseaux sanguins (angiogenèse) pour pouvoir s’ali-
menter en composants nécessaires à leur métabolisme et
elles évitent une mort cellulaire programmée (apoptose).
Elles envahissent leur environnement, métastasent dans
d’autres organes et deviennent indépendantes des signaux
moléculaires externes régulant leur comportement (4).
La croissance invasive se déroule dans un écosystème tumoral. Les cellules cancéreuses y communiquent avec les
cellules hôtes voisines en amenant des protéines à la surface de la cellule, en sécrétant des facteurs solubles (facteurs
de croissance et cytokines) et des exosomes (minuscules vésicules de seulement 100nm portant un message sous
forme de protéines ou de petites molécules d’ARN). Cette communication passe par l’exocytose vésiculaire, un processus
strictement régulé par les GTPases Rab (ras in the brain). Notre groupe de chercheurs a découvert un rôle unique de Rab27B
dans la sécrétion de régulateurs de croissance pro-invasifs nécessaires à la réalisation de la croissance invasive des cellules
cancéreuses du sein à récepteurs d’estrogènes positifs (ER-positifs). La présence de Rab27B est étroitement corrélée avec un
envahissement ganglionnaire et une morphologie peu différenciée de tumeurs mammaires ER-positives. Autrement dit, le
Rab27B serait un éventuel marqueur pour la stadification, le pronostic et le traitement de tumeurs mammaires ER-positives.

GUNAIKEIA ■ VOL 16 N°7 ■ 2011 222
Il est important de noter que tout se déroule dans un éco-
système au sein duquel les cellules cancéreuses commu-
niquent en permanence avec un vaste réseau de cellules
stromales voisines. L’amalgame de facteurs libérés par les
cellules cancéreuses et stromales lance le programme de
croissance invasive et de dissémination métastasique (5).
Indépendamment de ces mécanismes entrepris au fil des
ans, de nouveaux concepts apparaissent et sont de plus
en plus importants dans le domaine de la recherche. Celui
de la «niche prémétastasique» est remarquable: il s’agit
d’une plate-forme permettant aux cellules cancéreuses
de se retrouver directement dans un écosystème permis-
sif. D’après ce modèle, les cellules cancéreuses sécrètent
des facteurs solubles et des chémokines qui recrutent des
BMDC (bone-marrow derived cells) aux endroits où l’on
observera par la suite une angiogenèse tumorale et une
formation de métastases. Récemment, outre les facteurs
solubles, de petites vésicules (exosomes) ont également
été décelées. Elles contiennent l’ARN messager (ARNm),
des micro-ARN (miARN) et des polypeptides. Ce type
d’exosomes dirige les BMDC en vue de préparer la niche
métastasique (6).
Plusieurs études ont démontré que l’endocytose favorisait
différents aspects de la croissance invasive. Une intério-
risation déséquilibrée des complexes d’adhésion liés aux
cadhérines se traduit par une perte de polarité des cellules
épithéliales (7, 8). L’inhibition de l’endocytose par l’inter-
médiaire de l’inactivation des récepteurs de facteurs de
croissance favorise une croissance non contrôlée (9). Enfin,
l’endocytose joue un rôle important dans la relocalisation
dans les protrusions invasives des complexes d’adhésion
dépendants des intégrines. Ces derniers se chargent des
interactions entre la cellule et la matrice (10, 11).
Les cellules cancéreuses sécrètent des facteurs importants
non seulement dans les processus de croissance et d’inva-
sion de la tumeur primaire, mais aussi dans la préparation
d’un environnement permissif pour les métastases. Durant
plusieurs années, notre laboratoire de recherches a acquis
une expérience dans l’analyse de facteurs solubles favori-
sant la communication dans l’écosystème tumoral. L’im-
portance de l’exocytose dans le développement du cancer
a été notée pour la première fois en 2002 par le groupe de
chercheurs de Palmer et al (12). D’autres études s’intéres-
sant au rôle de l’exocytose et des Rab GTPases régulant
la croissance invasive se font toutefois attendre. Nous
avons dès lors examiné l’hypothèse suivante: les protéines
Rab régulant l’exocytose (Rab sécrétoires) jouent un rôle
essentiel dans la libération de régulateurs de croissance
pro-invasifs dans la matrice extracellulaire (13, 14).
Exocytose dépendante de Rab27B dans
la croissance invasive et la dissémination
métastasique
Une analyse ARNm de Rab sécrétoires dans 20 tumeurs
mammaires primaires a montré une présence beaucoup
plus élevée de Rab27B dans un tissu tumoral que dans
un tissu normal. La présence accrue de Rab27B est en
corrélation étroite avec une positivité-ER, des ganglions
lymphatiques gonflés et une morphologie peu différen-
ciée. Aucune différence significative n’a été relevée dans
la quantité d’ARNm d’autres Rab sécrétoires comme le
Rab27A et le Rab3D. Ces résultats ont été confirmés par
une analyse immunohistochimique de 59 tumeurs mam-
maires primaires. Trois groupes ont été distingués en
fonction de la présence de Rab27B: signal Rab27B absent,
modéré ou fort. Le Rab27B n’a pas été décelé dans les tu-
meurs ER-négatives. Les tumeurs positives pour les récep-
teurs d’estrogènes présentaient un signal Rab27B fort. Ce
dernier groupe était en corrélation étroite avec un enva-
hissement ganglionnaire lymphatique et une morphologie
peu différenciée (13).
La régularisation de Rab27B dans les tumeurs primaires a
renforcé notre hypothèse selon laquelle les cellules can-
céreuses se servent du processus d’exocytose pour libérer
des régulateurs de croissance pro-invasifs. Pour approfon-
dir les recherches, un modèle de culture cellulaire a été mis
sur pied. Il se composait de lignées cellulaires de cancer du
sein non invasives et ER-positives, comme le MCF7, dans
lesquelles une protéine de fusion de green fluorescent pro-
tein (GFP) au Rab27B s’est exprimée dans la même mesure
que dans les tumeurs mammaires invasives et ER-posi-
tives. Le Rab27B impliquait une morphologie allongée des
cellules avec plusieurs dendrites cellulaires. Ces modifica-
tions morphologiques se sont traduites par une invasion
significative de Matrigel™ et substrats de type I collagène
qui reproduisent respectivement la membrane basale et
la matrice extracellulaire. De plus, le Rab27B stimulait la
croissance des cellules cancéreuses du sein en augmen-
tant la transition du cycle cellulaire. Les effets fonction-
nels de Rab27B ont également été analysés en injectant
des cellules cancéreuses de sein dans la crête mammaire
de souris nues. Le Rab27B stimule la croissance invasive
caractérisée par une hausse du volume et du poids de la
tumeur, une forte expression nucléaire du marqueur de
prolifération Ki67 et une infiltration de la tumeur primaire
à travers le muscle abdominal et la paroi péritonéale. Cela
se traduit par une ascite hémorragique chez 37,5% des
souris et mène à leur mort (13).
Quel est le mécanisme moléculaire de la croissance inva-
sive induite par le Rab27B? Nous partions du principe
que le Rab27B transporte les vésicules vers la membrane
plasmique et qu’après la fusion, les vésicules libèrent des
régulateurs de croissance pro-invasifs dans la matrice
extracellulaire. Une technique unique a dès lors été mise
au point afin de nettoyer les vésicules Rab27B marquées
au GFP dans les cellules cancéreuses du sein. Une spec-
trométrie de masse des vésicules Rab27B nettoyées a
montré qu’elles contenaient le régulateur de croissance
pro-invasif heat shock protein 90 alpha (HSP90 alpha). La
protéine extracellulaire HSP90 alpha joue un rôle essentiel
dans l’activation des métalloprotéases matricielles (MMP),

GUNAIKEIA ■ VOL 16 N°7 ■ 2011
223
ces enzymes qui détruisent la matrice entre les cellules du
tissu conjonctif et favorisent ainsi l’invasion (15). L’analyse
du milieu de culture des cellules cancéreuses a confirmé
une libération de HSP90 alpha dépendant de Rab27B.
L’administration d’anticorps neutralisant le HSP90 alpha
dans le milieu de culture a inhibé l’invasion induite par
le Rab27B dans le substrat de type I collagène. Confor-
mément à ces résultats, la protéine HSP90 alpha recom-
binante a favorisé l’invasion des cellules cancéreuses au
sein. La zymographie sur gélatine du milieu de culture des
cellules cancéreuses du sein est une technique permettant
de déterminer l’activité protéolytique. Elle a démontré que
le Rab27B activait les MMP2 via le HSP90 alpha (13).
Au niveau de la tumeur primaire, nous pouvons donc ré-
sumer ceci: les cellules cancéreuses se servent de Rab27B
pour transporter les vésicules vers la membrane plasmique
contenant le HSP90 alpha. Lors de la fusion des vésicules
avec cette membrane, un régulateur de croissance pro-
invasif est libéré dans l’écosystème tumoral. Cela active
les protéases qui détruisent la matrice extracellulaire et
favorisent par conséquent la croissance invasive (Figure).
Une question importante se pose: ce mécanisme in-
fluence-t-il aussi la préparation de la niche prémétasta-
sique (14)? D’après la littérature, un groupe de chercheurs
(Ostrowski et al) a démontré que le Rab27B intervient
dans la libération des exosomes (16). Un autre élément de
réponse est apporté par l’observation suivante: les cellules
cancéreuses invasives sécrètent des exosomes contenant
le HSP90 alpha (17).
Rab27B en clinique
En Occident, le cancer du sein est le cancer le plus fré-
quent chez les femmes. La maladie comporte différentes
sous-catégories qui requièrent une approche individuali-
sée du traitement. Les tumeurs à récepteurs d’estrogènes
positifs affichent un meilleur pronostic que les tumeurs
à ER-négatifs. Pourtant, un pourcentage non négligeable
de patientes touchées par une tumeur ER-positive décè-
dent des suites de la maladie (18). Les caractéristiques de
la tumeur comme sa taille et l’envahissement lymphatique
sont des données indispensables pour évaluer le pro-
nostic et déterminer la thérapie, mais sont moins utiles
pour décider si un traitement adjuvant serait bénéfique
à des patientes atteintes d’une petite tumeur mammaire
diagnostiquée précocement. Des marqueurs additionnels
sont nécessaires pour établir une sous-classification pré-
cise des cancers du sein afin de mieux évaluer le pronostic
et de proposer une thérapie sur mesure, comme le sous-
groupe des tumeurs mammaires ER-positives (19).
De nouveaux marqueurs peuvent être identifiés par une
étude en biologie moléculaire de l’invasion et la dissé-
mination métastasique des cellules cancéreuses (20).
Notre analyse de Rab27B dans des tissus d’une tumeur
mammaire primaire a révélé une corrélation étroite avec
les tumeurs ER-positives caractérisées par une morpho-
logie peu différenciée et un état lymphatique positif. Vu
la démonstration selon laquelle le Rab27B détermine la
croissance invasive, notre hypothèse est la suivante: le
groupe important de tumeurs mammaires ER-positives
diagnostiquées précocement peut être scindé en deux sur
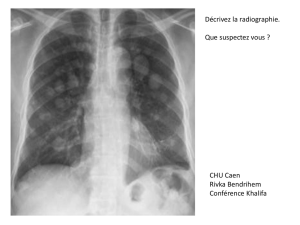
Figure: Aperçu schématique de croissance invasive dépendante de Rab27B. Le Rab27B transporte des vésicules contenant
le régulateur de croissance pro-invasif HSP90 alpha vers la membrane plasmique. Lors de la fusion de la vésicule avec cette
membrane, le HSP90 alpha est libéré dans l’écosystème tumoral. Le HSP90 alpha aide le membrane bound type 1 (MT1)-MMP lors
de l’activation focale de MMP2. Cette activation entraîne: 1) la destruction de la matrice extracellulaire (cercle gris) permettant
à la cellule cancéreuse de procéder à l’invasion et 2) la libération de facteurs de croissance (cercle vert) accumulés dans la
matrice. La fixation des facteurs de croissance à leur récepteur respectif est également facilitée par le HSP90 alpha et se traduit
par une stimulation du cycle cellulaire (adapté de 14).
Nucleus
Cycline A
Cycline E
Golgi
HSP90α
Dentrite
invasive
Cycle
céllulaire
Inactif
actif

GUNAIKEIA ■ VOL 16 N°7 ■ 2011 224
la base d’une analyse immunohistochimique de Rab27B. Le
premier groupe rassemble les cas où l’expression de Rab27B
est faible et le pronostic est bon, tandis que le deuxième
groupe réunit les cas où l’expression de Rab27B est élevée et
le pronostic mauvais. Une (chimio)thérapie additionnelle est
bénéfique à ce dernier groupe. Nous cherchons des cibles
spécifiques pour un traitement personnalisé. Deux exemples
bien connus sont le traitement antihormonal basé sur la po-
sitivité-ER et le traitement par trastuzumab basé sur la posi-
tivité-HER2. Une approche semblable est possible pour le
Rab27B grâce à l’utilisation d’antagonistes effecteurs spé-
cifiques. Outre les marqueurs individuels comme le Rab27B,
nous cherchons aussi des signatures génétiques pour une
sous-classification des tumeurs ER-positives. Le groupe de
chercheurs Goldstein et al a constitué une signature de 21
gènes (Oncotype DX®) permettant de prévoir plus précisé-
ment le risque de rechute en cas de tumeurs mammaires
ER-positives qu’avec les paramètres clinico-pathologiques
individuels standard comme l’ER, le récepteur de la proges-
térone (PR), HER2, la taille de la tumeur, etc. (21)
Conclusion
Les cellules cancéreuses utilisent l’exocytose pour libérer
des informations cruciales dans l’écosystème tumoral, qui
contribue à la croissance, à la migration et à la destruction
de la matrice. Le Rab27B régule la croissance invasive et
la dissémination métastasique dans les lignées cellulaires
de cancer du sein ER-positives et une présence accrue
de Rab27B est en corrélation étroite avec un mauvais
pronostic dans les tumeurs mammaires ER-positives.
Par conséquent, le Rab27B est un éventuel marqueur
pour établir une sous-classification, un pronostic et un
traitement de tumeurs mammaires ER-positives.
Références
1. Burgoyne RD, Morgan A. Secretory granule exocytosis. Physiol Rev 2003;83:581-632.
2. Stenmark H. Rab GTPases as coordinators of vesicle traffic. Nat Rev Mol Cell Biol
2009;10:513-25.
3. Hahn WC, Weinberg RA. Modelling the molecular circuitry of cancer. Nat Rev Cancer
2002;2:331-41.
4. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000;100:57-70.
5. De Wever O, Mareel M. Role of tissue stroma in cancer cell invasion. J Pathol
2003;200:429-47.
6. Peinado H, Lavotshkin S, Lyden D. The secreted factors responsible for pre-metastatic
niche formation: Old sayings and new thoughts. Semin Cancer Biol 2011;21:139-46.
7. Fujita Y, Krause G, Scheffner M, et al. Hakai, a c-Cbl-like protein, ubiquitinates and induces
endocytosis of the E-cadherin complex. Nat Cell Biol 2002;4:222-31.
8. Lu Z, Ghosh S, Wang Z, Hunter T. Downregulation of caveolin-1 function by EGF leads to
the loss of E-cadherin, increased transcriptional activity of beta-catenin, and enhanced
tumor cell invasion. Cancer Cell 2003;4:499-515.
9. Hommelgaard AM, Lerdrup M, van Deurs B. Association with membrane protrusions
makes ErbB2 an internalization-resistant receptor. Mol Biol Cell 2004;15:1557-67.
10. Caswell PT, Spence HJ, Parsons M, et al. Rab25 associates with alpha5beta1 integrin to
promote invasive migration in 3D microenvironments. Dev Cell 2007;13:496-510.
11. Caswell PT, Chan M, Lindsay AJ, McCaffrey MW, Boettiger D, Norman JC. Rab-coupling
protein coordinates recycling of alpha5beta1 integrin and EGFR1 to promote cell
migration in 3D microenvironments. J Cell Biol 2008;183:143-55.
12. Palmer RE, Lee SB, Wong JC, et al. Induction of BAIAP3 by the EWS-WT1 chimeric fusion
implicates regulated exocytosis in tumorigenesis. Cancer Cell 2002;2:497-505.
13. Hendrix A, Maynard D, Pauwels P, et al. Effect of the secretory small GTPase Rab27B on
breast cancer growth, invasion, and metastasis. J Natl Cancer Inst 2010;102:866-80.
14. Hendrix A, Westbroek W, Bracke M, De Wever O. An ex(o)citing machinery for invasive
tumor growth. Cancer Res 2010;70:9533-7.
15. Eustace BK, Sakurai T, Stewart JK, et al. Functional proteomic screens reveal an essential
extracellular role for hsp90 alpha in cancer cell invasiveness. Nat Cell Biol 2004;6:507-14.
16. Ostrowski M, Carmo NB, Krumeich S, et al. Rab27a and Rab27b control different steps of
the exosome secretion pathway. Nat Cell Biol 2010;12:19-30.
17. McCready J, Sims JD, Chan D, Jay DG. Secretion of extracellular hsp90alpha via exosomes
increases cancer cell motility: a role for plasminogen activation. BMC Cancer 2010;10:294.
18. Pagani O, Price KN, Gelber RD, et al. Patterns of recurrence of early breast cancer
according to estrogen receptor status: a therapeutic target for a quarter of a century.
Breast Cancer Res Treat 2009;117:319-24.
19. Webster LR, Lee SF, Ringland C, et al. Poor-prognosis estrogen receptor-positive breast
cancer identified by histopathologic subclassification. Clin Cancer Res 2008;14:6625-33.
20. Hendrix A, Braems G, Bracke M, et al. The secretory small GTPase Rab27B as marker for
breast cancer progression. Oncotarget 2010;1:304-8.
21. Goldstein LJ, Gray R, Badve S, et al. Prognostic utility of the 21-gene assay in hormone
receptor-positive operable breast cancer compared with classical clinicopathologic
features. J Clin Oncol 2008;26:4063-71.
G1455F_2011
Le contraceptif oral combiné
monophasique Zoely™
approuvé par l’Union
européenne
Teva et MSD ont annoncé que la Commission euro-
péenne a accordé une autorisation de mise sur le
marché à Zoely™, un nouveau contraceptif oral com-
biné (COC) en comprimé contenant une combinaison
monophasique unique de deux hormones: l’acétate
de nomégestrol, un progestatif dérivé de la proges-
térone hautement sélectif, et le 17 bêta-oestradiol,
un estrogène comparable à celui naturellement
présent dans le corps féminin. Cette nouvelle asso-
ciation sera mise à la disposition des femmes selon
un schéma posologique comprenant la prise de
pilules actives pendant vingt-quatre jours et la prise de
placébos pendant quatre jours.
L’efficacité et l’innocuité de Zoely™ ont été prouvées
dans le cadre de deux études comparatives, rando-
misées et ouvertes, sur plus de 3.200 femmes trai-
tées pendant une période allant jusqu’à 13 cycles
consécutifs. L’indice de Pearl a été calculé à 0,38.
L’autorisation de mise sur le marché de Zoely™
s’applique à l’ensemble des 27 Etats-membres de
l’Union européenne, ainsi qu’aux pays de l’AELE-EEE
(l’Islande, le Liechtenstein et la Norvège).
1
/
4
100%