III-2 : LA NEURORETINE : ASPECTS FONCTIONNELS Florence Rigaudière Jean-François Le Gargasson

Œil et Physiologie de la Vision – III-2
III-2 : LA NEURORETINE : ASPECTS FONCTIONNELS
Florence Rigaudière
Jean-François Le Gargasson
Pour citer ce document
Florence Rigaudière et Jean-François Le Gargasson, «III-2 : LA NEURORETINE : ASPECTS
FONCTIONNELS», Oeil et physiologie de la vision [En ligne], III-La physiologie rétinienne,
mis à jour le 18/06/2013, URL :
http://lodel.irevues.inist.fr/oeiletphysiologiedelavision/index.php?id=215,
doi:10.4267/oeiletphysiologiedelavision.215
Plan
La neurorétine à l’obscurité
La membrane externe des photorécepteurs
Canaux ioniques membranaires du bâtonnet
Dépolarisation du bâtonnet
Canaux ioniques membranaires des cônes
Dépolarisation du cône
Les photopigments des bâtonnets et des cônes
Localisation des photopigments
Structure et composition des photopigments
La neurorétine à la lumière
La transduction
Définition
Initiateurs de la transduction : les photopigments
Mécanismes de la transduction des bâtonnets
Mécanisme de la transduction des cônes
Anomalies dans les étapes de la transduction
Conséquences de la transduction
Stimulation brève d’intensité croissante délivrée en…
… ambiance scotopique
… ambiance photopique
Conséquences pour l’exploration clinique par ERG flash
Fonctionnement des cellules du 2ième étage
Cellules horizontales
Cellules bipolaires
Conséquences du fonctionnement des cellules du 2ième étage
Rôle des bipolaires ON & OFF pour le codage du contraste
Rôle des bipolaires ON & OFF pour l’onde-b de l’ERG flash
Cellules amacrines
De l’obscurité à la lumière
Rôle des cellules amacrines
Fonctionnement des cellules du 3ième étage
Agencement en trois voies P, M et K
Mode de fonctionnement des cellules ganglionnaires
Les cellules de Müller
1

Œil et Physiologie de la Vision – III-2
Rôle dans la structure rétinienne
Métabolisme
Courants potassiques
Conclusion
Petit glossaire…
Texte intégral
« … ou la rencontre entre photons et photorécepteurs… »
Le fonctionnement de la neurorétine est déclenché par l’absorption des photons lumineux
par les photopigments des photorécepteurs. Il s’en suit une cascade, comme un jeu de
domino qui modifie l’état de l’épithélium pigmentaire en amont et du deuxième et
troisième étage rétinien, en aval…
Le signal rétinien initial correspond, au niveau des deux premiers étages, à des
propagations de variations de différences de potentiels, pour devenir, au troisième étage,
un influx visuel formé de potentiels d’action qui se propagent le long des voies visuelles,
jusqu’aux nombreuses aires visuelles corticales.
Seules sont décrites les principales étapes fonctionnelles qui introduisent à la
compréhension de la genèse des signaux électrophysiologiques utilisés en exploration
clinique. Elles mettent en lumière les propriétés fonctionnelles différentielles des
systèmes scotopique et photopique en soulignant leur comportement spécifique vis-à-vis
des caractéristiques de la stimulation.
Ces propriétés sont mises à profit dans le cadre de l’exploration fonctionnelle clinique
pour isoler de façon indirecte la réponse et le mode de fonctionnement de chacun de ces
deux systèmes.
Le fonctionnement de l’épithélium pigmentaire est exposé au chapitre suivant. Il ne sera
cependant pas oublié ici que son niveau de potentiel se modifie au cours de différents
états d’adaptation de la neurorétine à la lumière ou à l’obscurité avec de possibles
retentissements sur l’état fonctionnel rétinien.
La neurorétine à l’obscurité
A l’obscurité, la neurorétine n’est pas stimulée ; elle est cependant dans un état
fonctionnel spécifique en comparaison des autres cellules neurologiques de l’organisme.
A la lumière, cet état se modifie pour déclencher les phénomènes qui aboutissent à la
vision.
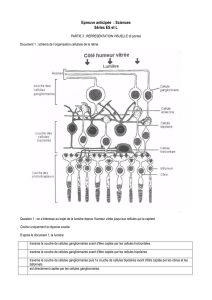
La membrane externe des photorécepteurs
Les photorécepteurs sont séparés de l’espace extracellulaire par une membrane externe.
Pour le cône, la membrane sépare le milieu extra et intracellulaire ; elle porte
directement les photopigments. Pour le bâtonnet, elle sépare le milieu extra et
intracellulaire qui contient les disques sur lesquels se trouvent les photopigments (figure
III-1-7).
2

Œil et Physiologie de la Vision – III-2
Les caractéristiques et les propriétés membranaires des bâtonnets résumées ci-dessous,
sont mieux connues que celles des cônes.
Canaux ioniques membranaires du bâtonnet
Situation
La membrane plasmatique du segment externe du bâtonnet est le siège de canaux
transmembranaires luminodépendants spécifiques des ions sodium et calcium (figure III-
2-1). Ces canaux sont situés uniquement sur la membrane externe et ne sont pas
retrouvés sur la membrane des disques. Ils représentent environ 7% des protéines
transmembranaires [Molday, 1998].
Les autres protéines transmembranaires de la membrane plasmique se composent d’environ 60% de molécules
de rhodopsine, 7% d’échangeur d’ions Na+/Ca2+-K+. 4% de transporteurs du glucose et les 22% restant étant
de natures diverses [Molday, 1998].
Composition
Ces canaux transmembranaires sodium et calcium de la membrane plasmique se
composent de deux sous unités différentes alpha et béta. La sous unité alpha peut être
ouverte par le GMPc (Guanosine monophosphate cyclique) tandis que la sous unité béta
permet la modulation du canal par la calmoduline via le taux de calcium intracellulaire
[Ebrey, Koutalos, 2001].
Etat à l’obscurité
A l’obscurité, ces canaux sodium et calcium sont maintenus ouverts grâce à trois
molécules de GMPc lorsque la concentration de GMPc est forte. Ces canaux ouverts
permettent l’entrée en permanence d’un flux d’ions sodium (80%) et calcium (20%)
[Korenbrot, Rebrik, 2002].
L’équilibre ionique de ces ions sodium et calcium entre le milieu intra et extracellulaire
est maintenu par deux mécanismes (figure III-2-1) :
1- un contre-transport insensible à la lumière, situé sur le segment externe et assuré par
un échangeur d’ions Na+/Ca2+-K+. Il permet la sortie d’un ion calcium et d’un ion
potassium, contre l’entrée de quatre ions sodium. Son effet permanent est cependant
limité à un flux sortant d’environ 500 ions calcium par seconde [Doly, 1997] ;
2- un mécanisme actif de pompes ATP-dépendantes, situées au niveau du segment
interne du bâtonnet. Elles permettent la sortie de trois ions sodium contre l’entrée de
deux ions potassium. Ce mécanisme actif ne joue pas de rôle direct sur les flux des ions
calcium.
Dépolarisation du bâtonnet
Cet équilibre ionique à l’obscurité correspond à un excès de sodium intracellulaire par
rapport à l’état d’équilibre observé pour toutes les autres cellules de l’organisme ; en
l’absence de stimulation, la cellule est dépolarisée.
Diminution de la barrière de potentiel : dépolarisation du bâtonnet
En l’absence de stimulation, la barrière de potentiel (ou différence de potentiel)
transmembranaire est de -40 mV ± 10 mV alors qu’elle est de -70 mV ± 10 mV pour
toutes les autres cellules de l’organisme. Cette valeur ne correspond pas à une différence
de potentiel spécifique en l’absence de stimulation, mais bien à une véritable diminution
de la barrière de potentiel par rapport à ce qui est normalement observé en l’absence de
stimulation. Cette valeur correspond à un état de dépolarisation du bâtonnet.
3

Œil et Physiologie de la Vision – III-2
En effet, au niveau de sa synapse avec les cellules horizontales et bipolaires sous-
jacentes, on observe une libération continue de son neurotransmetteur, le glutamate
[Barnes, 1995].
Abaissement de la barrière de potentiel transmembranaire (par rapport aux valeurs
habituellement observées en l’absence de stimulation) associé °à des ouvertures de
canaux sodium en nombre important et °à la libération du neurotransmetteur au niveau
des synapses avec les cellules sous-jacentes sont caractéristiques de l’état de
dépolarisation d’une cellule.
Courant d’obscurité
Cet état de dépolarisation permet l’ouverture de canaux sodium-calcium ; on observe
alors une circulation d’ions ou courant d’obscurité, constitué essentiellement d’un flux
d’ions sodium (80% d’ions sodium et 20% d’ions calcium)
°il est entrant au niveau du segment externe du bâtonnet, par les canaux sodium et
calcium maintenus ouverts par trois molécules de GMPc [Doly, 1997], [McIlwain, 1996],
puis
°il se dirige vers le segment interne de la cellule pour
°ressortir vers le milieu externe, grâce à des mécanismes actifs de pompes et de contre-
transports ioniques, fermant ainsi le circuit (figure III-2-1).
L’intensité de ce courant d’obscurité est maximale à l’obscurité.
Canaux ioniques membranaires des cônes
Situation
Pour les cônes, les canaux ioniques sodium-calcium sensibles à la lumière, sont situés
tout le long des replis de la membrane plasmique et contigus aux molécules de
photopigments.
Bien que la surface de membrane repliée soit supérieure à celle de la membrane externe
des bâtonnets, le nombre de canaux ioniques sodium-calcium situés sur les cônes est
semblable à celui des bâtonnets car leur densité par cône est inférieure à celle par
bâtonnet [Yau, 1994].
Composition
Ces canaux ioniques sodium-calcium ont des sites de fixations différents de ceux des
bâtonnets [Picones, Korenbrot, 1992] ; ils sont également codés par des gènes différents
[Bonigk et al., 1993].
Etat à l’obscurité
A l’obscurité, ces canaux sodium-calcium sont maintenus ouverts grâce une forte
concentration de molécules de GMPc. Ces canaux sodium-calcium ouverts permettent
l’entrée en permanence d’un flux d’ions sodium (65%) et calcium (35%) avec une
régulation par un échangeur d’ions calcium-sodium-potassium où la clairance des ions
calcium est beaucoup plus rapide que pour le bâtonnet [Korenbrot, Rebrik, 2002].
Dépolarisation du cône
En l’absence de stimulation, les cônes comme les bâtonnets sont dépolarisés. Il s’agit
bien d’une véritable dépolarisation. En effet, on observe une libération en continu de leur
neurotransmetteur, le glutamate, au niveau de leurs synapses avec leurs cellules sous-
jacentes : les cellules bipolaires de cônes.
4

Œil et Physiologie de la Vision – III-2
Les photopigments des bâtonnets et des cônes
Chez l’homme, il a été mis en évidence quatre types de photopigments : la rhodopsine
portée pour les bâtonnets et trois pigments, L, M et S portés chacun par un groupe de
cônes. Leurs compositions en acides aminés sont différentes et en grande partie
responsables de leurs propriétés qui les différencient.
Localisation des photopigments
Des bâtonnets
La rhodopsine constitue 85% des protéines transmembranaires des disques [Molday,
1998], [Menon et al., 2001] ; on la trouve également au niveau de la membrane
plasmique où elle constitue 60% des protéines transmembranaires [Molday, 1998]. Elle
est donc principalement mais non pas uniquement localisée sur les disques.
Des cônes
Les photopigments des cônes sont également des protéines transmembranaires situées
sur les replis de la membrane plasmique.
Structure et composition des photopigments
Structure tertiaire
Les quatre photopigments sont composés de façon similaire par °une opsine ou chaîne
protéique, associée à °un chromophore, le rétinal, sous sa forme 11-cis dans l’état
inactivé (figure III-2-2).
Figure III-2-2 : schéma de la structure spatiale d’une molécule de rhodopsine. Le chromophore est au centre de
la poche dans sa configuration 11-cis.
Ces protéines transmembranaires présentent :
°une partie membranaire, composée de sept hélices alpha dont l’inclinaison, les unes par
rapport aux autres, varie selon la profondeur dans la membrane [Hargrave, 2001]
°pour les cônes : une partie extracellulaire et une partie intracellulaire et
°pour les bâtonnets : une partie cytoplasmique et une partie intradiscale (figure III-2-
3).
Figure III-2-3. La partie extracellulaire pour les cônes et cytoplasmique pour les bâtonnets comporte quatre
boucles (polypeptides- B1 à B4). B4 est ancrée dans la membrane par des palmytoyle-cystéines (P) reliée à
l’extrémité C terminale où se trouvent les sites de phosphorylation (Ph) aussi bien pour les cônes [Lolley, Lee,
1990] que pour les bâtonnets [Gordon, Bazan, 1997].
Le rectangle rouge situé à la base de B2 est la zone de fixation de la protéine G.
Les sept hélices alpha sont transmembranaires [Gordon, Bazan, 1997]. Elles forment une poche [Das et al.,
1999] à l’intérieur de laquelle se situe le chromophore qui est accroché à deux hélices en des positions
différentes pour la rhodopsine et les photopigments L et M [Jacobs, 1998]. Le chromophore est parallèle à la
surface membranaire.
La partie intradiscale pour le bâtonnet et intracellulaire pour le cône, comprend trois boucles B5 à B7 et une
extrémité N terminale avec ses deux sites de glycosylation (G).
Si la structure tertiaire de la rhodopsine et celle des photopigments des cônes sont
similaires, les séquences et le nombre d’acides aminés sont différents. La partie
membranaire est la plus importante pour la sélectivité spectrale.
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
1
/
60
100%