P2-UE8-Masson-Mycoses_exotiques-04_04_17

UE8- De l’agent infectieux à l’hôte
Dr Masson
Date : 04/04/17 Plage horaire : 8h30-9h30
Promo: P2 2016-2017 Enseignant : Dr. Masson
Ronéistes : Boyet Louis
Dany Jonathan
Les mycoses exotiques
I. Introduction
1. Champignons filamenteux
2. Levures
3. Champignons dimorphiques
II. Mycoses exotiques
III. Mycoses liées aux champignons dimorphiques
1. Histoplasmose américaine
A. Exposition à une faible quantité de spores
B. Exposition à une grande quantité de spores
C. Forme disséminée chez les immunodéprimés
D. Diagnostic et anatomopathologie
2. Histoplasmose africaine
3. Coccidioïdomycose
4. Paracoccidioïdomycose
5. Blastomycose
6. Sporotrichose
7. Penicilliose
Nb : Pour les QCMs, le prof précise que tout est dans ces diapos, et que les choses les plus
importantes sont en couleur.

I. Introduction
Champignons « dimorphiques » car 2 formes :
-champignon filamenteux (dans l’environnement)
-levure (pathogène dans les tissus)
Ce chapitre sur les mycoses traite de pathologies peu rencontrées en pratique, il s’agit plus de curiosité de
la médecine. Les mycoses dites « exotiques » sont dues à des champignons dimorphiques. Nous allons voir
en introduction quelques variétés de champignons.
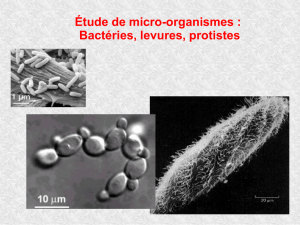
1.Champignons filamenteux
Ici, nous avons des champignons avec des filaments fins et septés, par exemple.
Les champignons peuvent avoir des septa, des spores (des microconidies ou des macroconidies).
En haut à droite, nous avons des champignons
noirs, qui sont sous forme d’hématie.
Les dermatophytes sont des champignons filamen-
teux sur lesquels se greffent ces spores.
En bas à gauche, il s’agit d’une photo des têtes
d’aspergillus niger, et en bas à droite, il s’agit
d’une vue en microscope.
Les champignons adoptent la forme filamenteux quand ils sont dans l’environnement car ils ont les condi-
tions favorables pour se développer, tel que l’humidité et la température.
2. Levures
Les 6 champignons (il n’y en a pas plus) présentés ont la capacité d’adopter une forme levure, comme la
Candida Albicans ( qui est une levure ).
Les levures sont des champignons de forme ronde (mais
il existe toutefois des formes un peu allongées).
Cette forme ronde est spécifique des levures.
Elles ont à peu près la taille d’une hématie et certaines
possèdent une capsule.
Les levures sont plus grosses que les bactéries. Elles sont
de l’ordre des hématies, notamment pour les Candida.
Elles ont un temps de croissance rapide (en 48h généra-
lement) et se multiplient en bourgeonnant.

La base de bourgeonnement peut être fine ou large, cela fait partie des clés diagnostic différentiels.
Certaines levures, comme candida albicans, peuvent faire des filaments dans certaines conditions. Ce ne
sont pas de vrais filaments mais des pseudo-filaments. Ces pseudo-filaments sont retrouvés seulement à
l’état pathogène dans les produits pathologiques. Notons que Candida est considérée comme une levure
stricte car elle ne donne pas des filaments mais des pseudo-filaments.
3. Champignons dimorphiques
Il existe seulement 6 champignons dimorphiques en pathologie humaine. Ce sont les agents des mycoses
exotiques. Ils existent sous deux formes : filamenteux et levure.
- Dans le milieu extérieur ils sont sous forme filamenteuse, c’est la forme végétative. La forme filamenteuse
est la forme infectante/contaminante, elle contient des conidies ou spores qui permettent aux champignons
dimorphiques de se répandre dans le milieu extérieur. Cette forme est obtenue en culture (ou conditions en-
vironnementales classiques) sur un milieu usuel, à température ambiante ou 30°C (voir 20-25°C). Très
contaminant notamment par voie respiratoire, par inhalation.
- Dans les lésions humaines ou animales (chez un hôte), ils sont sous forme levure. Il s’agit de la forme pa-
rasitaire. Cette forme est obtenue en culture sur des milieux spéciaux enrichis, à 37°C.
Chez les champignons dimorphiques, on ne retrouve jamais les deux formes (levure et filamenteux) en
même temps dans une lésion, contrairement aux levures comme Candida où on peut avoir la forme levure
avec des pseudo-filaments (signe de pathogénicité chez la levure). Chez les dimorphiques, lorsqu’on est en
diagnostic dans une lésion on ne retrouve que la forme parasitaire levure.
Le dimorphisme est une adaptation morphologique à l’environnement qui leur permet de croître dans des
milieux et d’assimiler des nutriments plus variés, de supporter d'autres températures pour étendre sa capa-
cité à vivre et survivre que des champignons non dimorphiques. Par contre le dimorphisme les rend pa-
thogènes.
a et b : pinceau du penicil-
lium avec des chaines de
spores.
c : champignon sous forme
de levure (arthrosporés)
Aspiration ganglionnaire
Forme levure
(Dans les tissus) Pathogène

Exemple : penicillium marneffei !
Le penicillium se retrouve dans la nature, à température ambiante. Chez des patients infectés par un type de
penicillium particulier (penicillium marneffei), sur gélose au sang, milieu riche à 37°C, on retrouve une
forme de levure. La forme levure se retrouve uniquement dans les tissus. Le penicillium marneffei chez les
patients VIH+ donne un taux de mortalité important.
Exemple : Histoplasmose (très bien transportée
par l’air, le vent)
Dans l’environnement (surtout dans le sol) ou
en culture sur milieu non riche à température am-
biante, on retrouve la forme filamenteuse (forme
contaminante) avec des macroconidies (forme
mycélienne).
Chez un hôte, l’histoplasma adopte une forme
de levure (forme pathogénique). Il n’y a plus de
macroconidies mais une petite capsule (pour se
protéger), capable de bourgeonnement.
II. Mycoses exotiques
Ou Mycoses d’importation. Elles sont absentes en France métropolitaine et d’Europe ( sauf pour la sporotri-
chose présente dans le sud de l’Europe) mais présentes de façon endémique en zones inter-tropicales.
Les mycoses exotiques sont aussi appelées mycoses endémiques.
Les mycoses vivent dans le sol et chez les végétaux, mais il y aussi du portage sain chez certains animaux
(les rat de bambous, les chiens).
• Niches écologiques :
- Sol, grotte : histoplasmose
- Végétaux : sporotrichose
• Niches écologiques fréquentées par les voyageurs :
- Sud des Etats-Unis/grottes : histoplasmose
- Nord Thaïlande/forêt : pénicilliose (immunodéprimés généralement par le VIH +++)
• Activités à risque :
- Ex : spéléologues, démolisseurs : histoplasmose
- Ex : sable, poussière : coccidioïdomycose
- Ex : travail en laboratoire
Les mycoses exotiques seront contractées par les voyageurs, les résidents à l’étranger, ou les migrants. Ce ne
sont pas que des agents de pathologies opportunistes, c’est-à-dire qu’ils ne surviennent pas que sur des ter-
rains spécifiques, sujets immunodéprimés ou VIH+ (plus sensibles aux infections), ils infectent aussi des
sujets sains. Ce sont de vrais agents pathogènes qui peuvent infecter des sujets sains comme des sujets

immunodéprimés.
Il existe différents types de contaminations, les principales sont : inhalation, inoculation directe et contami-
nation de laboratoire.
Il y a un classement des agents pathogènes :
•Classe 1 : génopathogène.
•Classe 2 : ça peut être pathogène mais il y a un traitement, et il y a aussi un risque faible pour les tra-
vailleurs de labo.
•Classe 3 : les agents des mycoses exotiques (sauf 1), c’est à dire qui ne se manipulent pas normalement
dans un laboratoire de type P2, mais plutôt dans un laboratoire de type P3 (très rare à la Reunion).
•Classe 4 : Ebola, extrêmement transmissible et extrêmement risqué, sans vraiment de traitement.
Les principaux agents sont telluriques (dans le sol).
•Contamination par inhalation
• Conidies facilement dispersées et inhalées.
• Primo-infection pulmonaire. A noter que la particularité des spores est d'être très légère donc très
présente dans l'air ambiant.
•Contamination par inoculation
• Traumatisme, piqûre végétale (sporothrix qui vivent dans des végétaux généralement morts, et qui
est le seul pathogène de classe 2 dans les champignons dimorphiques)
• Mycose cutanée/sous cutanée
•Contamination de laboratoire, transplantation d’organe (certains sont des pathogènes de classe 3,
exemple : histoplasma). Les pathogènes de classe 3 sont extrêmement contagieux ! Les forme de contami-
nation sont à connaitre car QCM +++.
•Pas ou très peu de transmission inter-humaine
III.Mycoses liées aux champignons dimorphiques.
Dans cette partie nous allons aborder 7 différentes mycoses (retenir les noms+maladies) :
•Histoplasmose américaine, « à petites formes » (petite taille, 3 à 5µ), due à Histoplasma capsulatum var.
Capsulatum, provoque des petites lésions type maladie de Darling.
•Histoplasmose africaine, « à grandes formes » (grande taille, 10 à 15µ), due à Histoplasma capsulatum
var. duboisii.
•Coccidioïdomycose, maladie de Posadas et Wernicke, due à Coccidioides immitis, le plus virulent de ces
champignons pathogènes.
•Paracoccidioïdomycose, blastomycose sud-américaine, maladie de Lutz-Splendore-Almeida, due à Pa-
racoccidioides brasiliensis.
•Blastomycose ou blastomycose nord-américaine, maladie de Gilchrist due à Blastomyces dermatitidis.
•Sporotrichose due à Sporothrix schenkii, surtout retrouvé en Europe. Maladie cutanée, pathologie d’ino-
culation due aux végétaux morts.
•Pénicilliose due à Penicillium marneffei. Pathologie très grave (surtout chez le sujet VIH +). Rencontrée
presque exclusivement en Thailande, où vit le rat de bambou.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%