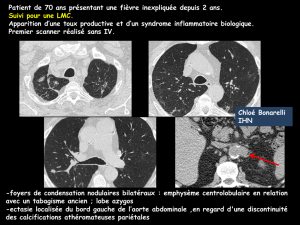
Faut-il dépister les localisations

Faut-il
dépister
les
localisations
athéromateuses
extracardiaques
chez
le
patient
coronarien
?
Should
the
patient
with
coronary
artery
disease
be
screened
for
extracardiac
atherosclerotic
involvement?
H.T.
Bui
D.
Metz Service
de
cardiologie
et
pathologies
vasculaires,
centre
hospitalier
universitaire
de
Reims,
hôpital
Robert-Debré,
rue
du
Général-Koenig,
51100
Reims,
France
Disponible
en
ligne
sur
ScienceDirect
le
28
mars
2017
L'athérosclérose
a
été
définie
par
l'Organi-
sation
mondiale
de
la
santé
(OMS)
en
1958
comme
«
une
association
variable
de
remaniements
de
l'intima
et
de
la
média
des
artères
de
gros
et
de
moyen
calibre.
Elle
constitue
une
accumulation
focale
de
lipides,
de
glucides
complexes,
de
sang
et
de
produits
sanguins,
de
tissus
fibreux
et
de
dépôts
cal-
caires.
Le
tout
est
accompagné
de
modifica-
tions
de
la
média
»
[1].
La
maladie
athérothrombotique
est
donc
dif-
férente
de
l'artériosclérose
qui
est
un
proces-
sus
de
sclérose
artérielle
intéressant
principalement
les
fibres
musculaires
de
la
média
et
qui
est
due
au
vieillissement.
La
première
étape
de
la
maladie
athérothrom-
botique
est
l'accumulation
de
LDL
cholestérol
(LDLc)
dans
l'intima
avec
des
modifications
oxydatives
des
LDLc.
La
dysfonction
endothé-
liale
est
responsable
du
recrutement
des
monocytes,
puis
de
leur
transformation
en
macrophages,
puis
en
cellules
spumeuses
(macrophages
gorgés
de
LDLc).
La
plaque
«
mature
»
se
forme
avec
un
centre
athéro-
mateux
et
une
chape
fibreuse
constituée
de
cellules
musculaires
lisses.
Cette
plaque
peut
rester
stable
ou
évoluer
vers
la
thrombose
ou
vers
un
accident
aigu
par
rupture
de
plaque.
La
prévalence
de
l'athérosclérose
augmente
progressivement
dans
les
pays
développés
en
raison
du
vieillissement
de
la
population
et
des
modifications
des
facteurs
de
risques.
En
1997,
l'étude
MONICA
(Multinational
moni-
toring
of
trends
and
determinants
in
cardio-
vascular
disease)
a
démontré
une
réduction
de
la
mortalité
cardiovasculaire
avec
un
gra-
dient
décroissant
de
la
mortalité
du
Nord
vers
le
Sud,
due
à
une
meilleure
prise
en
charge
des
facteurs
de
risque
cardiovasculaire
mais
aussi
à
l'évolution
des
traitements
donnés
à
la
phase
aiguë
de
la
maladie
[2].
Il
paraît
donc
essentiel
de
dépister
les
multiples
localisa-
tions
athéromateuses
afin
d'optimiser
leur
prise
en
charge.
Les
trois
localisations
préférentielles
de
la
maladie
athérothrombotique
sont
les
locations
coronariennes,
carotidiennes
et
les
atteintes
de
l'aorte
et
des
artères
des
membres
inférieures.
Comme
le
montre
le
registre
REACH
(Reduc-
tion
of
Atherothrombosis
for
Continued
Health)
[3],
l'athérome
est
une
maladie
géné-
ralisée
qui
peut
toucher
simultanément
plu-
sieurs
lits
vasculaires.
REACH
est
le
plus
grand
registre
international
portant
sur
la
maladie
athérothrombotique.
Il
s'agissait
d'une
étude
prospective
observationnelle
por-
tant
sur
une
cohorte
de
patients
de
plus
de
45
ans
ayant
soit
une
maladie
athérothrom-
botique
établie
(pathologie
coronaire,
cérébro-
vasculaire
ou
artériopathie
oblitérante
des
membres
inférieurs,
soit
au
moins
trois
fac-
teurs
de
risque
cardiovasculaire).
Près
de
68
000
patients
ambulatoires
ont
été
recrutés
par
5587
médecins
investigateurs
dans
44
pays.
Parmi
les
3514
patients
français
porteurs
d'une
maladie
athérothrombotique
avérée,
2373
(68
%)
avaient
une
maladie
coronarienne,
778
(22
%)
avaient
un
accident
vasculaire
cérébral
ischémique
et
923
(26
%)
avaient
une
artériopathie
oblitérante
des
membres
inférieurs.
Près
d'un
quart
des
patients
coronariens,
près
d'un
tiers
des
patients
atteints
de
maladies
cardiovasculai-
res
et
près
de
la
moitié
des
patients
atteints
d'artériopathie
oblitérante
des
membres
infé-
rieurs
avaient
au
moins
une
autre
localisation
de
la
maladie
athérothrombotique
[4].
Auteur
correspondant
:
H.
Bui,
service
de
cardiologie
et
pathologies
vasculaires,
centre
hospitalier
universitaire
de
Reims,
hôpital
Robert-Debré,
rue
du
Général-Koenig,
51100,
Reims,
France.
Adresse
e-mail
:
H.T.
Bui
Arch
Mal
Coeur
Vaiss
Prat
2017;2017:3–10 Dossier
/
Mise
au
point
http://dx.doi.org/10.1016/j.amcp.2017.03.002
©
2017
Elsevier
Masson
SAS.
Tous
droits
réservés.
3

COMMENT
DÉPISTER
LES
LOCALISATIONS
EXTRACORONARIENNES
DE
LA
MALADIE
ATHÉROTHROMBOTIQUE
?
Chez
le
patient
coronarien,
le
dépistage
des
localisations
athéromateuses
extracoronariennes
peut
se
faire
par
des
examens
simples.
Pour
le
dépistage
des
sténoses
carotidiennes
asymptomati-
ques,
une
sonde
linéaire
à
haute
fréquence
d'environ
7
MHz
est
utilisée.
Le
patient
est
en
position
allongée
en
décubitus
dorsal.
La
sonde
est
placée
à
travers
le
muscle
sterno-cléi-
domastoïdien
à
l'union
du
tiers
moyen
et
du
tiers
inférieur
du
cou
(Fig.
1).
L'étude
comporte
une
étude
en
mode
deux
dimensions
(2D)
en
coupe
transversale,
de
haut
en
bas
jus-
qu'à
la
base
du
cou,
puis
en
coupe
longitudinale
pour
explorer
la
carotide
commune,
le
bulbe,
puis
la
bifurcation
carotidienne
(Fig.
2).
On
réalise
ensuite,
selon
les
mêmes
incidences
une
étude
en
doppler
couleur
et
en
doppler
pulsé
pour
prendre
les
mesures
des
vitesses
systoliques
(PSV)
et
diastoliques
(EDV)
au
niveau
des
carotides
communes,
internes
et
externes
(Fig.
3a
et
b).
Les
plaques
sont
définies
comme
un
décrochage
dans
la
lumière
artérielle
d'une
échostructure
avec
une
épaisseur
supérieure
à
0,5
mm
ou
supérieure
à
50
%
de
l'épaisseur
intima/média
(EIM)
adjacent
ou
une
EIM
supérieure
à
1,5
mm.
La
description
de
la
plaque
doit
mentionner
sa
localisation,
son
étendue
et
son
épaisseur.
Puis
nous
devons
détailler
sa
structure
(homogène
ou
hétérogène),
son
écho-
génicité
(hypoéchogène,
hyperéchogène
ou
isoéchogène)
et
enfin
sa
surface
(régulière,
irrégulière,
ulcération
:
cratère
supérieur
à
2
mm)
(Fig.
4a–c).
L'évaluation
du
degré
de
sténose
se
fait
généralement
sur
des
critères
vélocimétriques
(Tableau
I)
[5].
Une
sténose
supéri-
eure
à
70
%
en
NASCET
au
niveau
de
la
carotide
interne
est
définie
comme
une
vélocité
systolique
au
niveau
de
la
sténose
à
plus
de
230
cm/s,
une
vélocité
diastolique
au
niveau
de
la
sténose
à
plus
de
100
cm/s
et
un
rapport
de
vélocités
systo-
liques
(PSV)
au
niveau
de
la
sténose
sur
PSV
au
niveau
de
la
carotide
commune
supérieur
à
4
(Fig.
5).
En
ce
qui
concerne
le
dépistage
de
l'anévrysme
de
l'aorte
abdominale,
l'échographie
de
l'aorte
abdominale
est
un
exa-
men
simple
et
peu
chronophage.
Il
peut
être
réalisé
la
plupart
du
temps
avec
la
même
sonde
convexe
utilisée
pour
l'écho-
graphie
cardiaque,
avec
une
faisabilité
de
plus
de
99
%
même
dans
un
service
de
soins
intensif
de
cardiologie
[6].
La
sonde
est
placée
au
niveau
de
l'ombilic
(Fig.
6).
L'aorte
abdominale
est
étudiée
en
mode
2D
depuis
la
région
cœliaque
jusqu'à
la
bifurcation
aortique.
En
effectuant
une
rotation
de
908,
l'aorte
est
alors
étudiée
en
longitudinal.
Pour
chaque
acquisition,
transverse
et
longitudinale,
le
diamètre
maximal
antéroposté-
rieur
adventice–adventice
est
mesuré
(Fig.
7a
et
b).
Un
ané-
vrysme
de
l'aorte
abdominale
est
défini
comme
dans
la
plupart
des
grandes
études
épidémiologiques
comme
un
diamètre
antéropostérieur
supérieur
à
30
mm
(Fig.
8)
[7].
Il
faudra
pré-
ciser
en
cas
de
découverte
d'un
anévrysme
de
l'aorte
abdo-
minale,
sa
morphologie
(sacciforme
ou
fusiforme)
et
la
présence
éventuelle
d'un
thrombus
pariétal.
Pour
le
dépistage
de
l'artériopathie
oblitérante
des
membres
inférieurs,
après
un
examen
clinique
minutieux
avec
recherche
et
palpation
des
pouls,
il
est
recommandé
d'utiliser
une
sonde
doppler
de
8
à
10
MHz.
L'index
de
pression
systolique
à
la
cheville
est
défini
pour
chaque
membre
inférieur
comme
le
rapport
de
la
pression
artérielle
systolique
à
la
cheville
(PASc)
(au
niveau
de
l'artère
pédieuse
ou
au
niveau
de
l'artère
tibiale
postérieure)
sur
la
pression
artérielle
systolique
brachiale.
Pour
mesurer
la
PASc,
le
stylo
doppler
doit
idéalement
réaliser
un
angle
de
458
par
rapport
au
trajet
de
l'artère
(Fig.
9).
Le
brassard
à
tension
est
alors
gonflé
jusqu'à
la
perte
du
signal
doppler.
Puis
il
est
dégonflé
jusqu'à
la
réapparition
du
signal
de
flux
doppler
correspondant
à
la
pression
systolique
de
l'artère
de
la
cheville.
Une
artériopathie
oblitérante
des
membres
inférieurs
est
définie
par
un
IPS
inférieur
à
0,9
selon
l'HAS
[8].
D'après
les
recommandations
de
l'American
Heart
Asso-
ciation
(AHA)
[9],
pour
la
mesure
des
IPS,
il
est
recommandé
d'utiliser
le
rapport
entre
la
plus
haute
des
PASc
aux
deux
chevilles
et
la
plus
haute
des
pressions
systoliques
brachiales
aux
deux
bras.
Cet
examen
a
une
sensibilité
de
95
%
et
une
spécificité
voisine
de
100
%
pour
le
diagnostic
de
l'artériopathie
oblitérante
des
membres
inférieurs.
Figure
1.
Positionnement
de
la
sonde
plate
de
7
MHz
à
travers
du
muscle
sternocléidomastoïdien.
Figure
2.
Étude
longitudinale
de
l'axe
carotidien.
Un
quart
à
un
tiers
des
malades
ayant
une
atteinte
athérothrombotique
ont
une
autre
localisation
de
la
maladie.
H.T.
Bui,
D.
Metz
Dossier
/
Mise
au
point
4

Figure
3.
a
:
étude
transversale
de
la
bifurcation
carotidienne
gauche.
La
carotide
interne
gauche
est
à
son
origine
plus
externe
que
la
carotide
externe.
La
carotide
externe
donne
des
collatérales
;
b
:
étude
longitudinale
de
la
carotide
commune
droite
avec
mesure
des
vitesses
systolique
et
diastolique
en
doppler
pulsé.
À
noter
qu'il
faut
toujours
en
vasculaire
respecter
un
angle
de
tir
inférieur
à
60
degré.
Figure
4.
a.
Plaque
régulière
et
plutot
homogène
à
tendance
hypoéchogène
;
b
:
plaque
régulière,
hétérogène
et
partiellement
calcifiée
avec
cône
d'ombre
;
c
:
plaque
ulcérée
avec
perte
de
substance
de
plus
de
2
mm.
Figure
5.
a
:
sténose
serrée
au
niveau
de
la
carotide
interne
gauche,
suspectée
par
un
aspect
d'aliasing
par
accélération
de
flux
;
b
:
confirmation
d'une
sténose
serrée
hémodynamique
en
NASCET
avec
une
PSV
estimée
à
340
cm/s,
une
EDV
estimée
à
153
cm/s.
La
PSV
au
niveau
de
la
carotide
commune
était
estimée
à
70
cm/s,
le
rapport
des
PSV
était
donc
de
4,8.
Tableau
I.
Critères
vélocimétriques
des
sténoses
selon
GRANT.
Sténose
(%)
Vélocimétrie
(cm/s)
Mode
B
(%
Nascet)
PSV
EDV
Ratio
PSV
Plaque
Normal <
125
<
40
<
2
Aucune
<
50 <
125
<
40
<
2
<
50
50–69
125–230
40–100
2–4
50
70 >
230
>
100
>
4
50
Pré-occlusion
Variable
Visible
Occlusion Indétectable
Pas
de
lumière
détectable
Faut-il
dépister
les
localisations
athéromateuses
extracardiaques
chez
le
patient
coronarien
?Dossier
/
Mise
au
point
5

AMÉLIORE-T-ON
LE
PRONOSTIC
DU
PATIENT
CORONARIEN
EN
DÉPISTANT
D'AUTRES
LOCALISATIONS
ATHÉROMATEUSES
ASYMPTOMATIQUES
?
Les
patients
coronariens
sont
en
théorie
des
patients
traités
de
manière
optimale
en
ce
qui
concerne
le
traitement
médica-
menteux
comme
l'atteste
l'étude
Euroaspire
IV
[10].
Près
de
94
%
des
patients
étaient
traités
par
antiagrégant
plaquettaire,
près
de
83
%
par
bêtabloquant,
75
%
par
inhibiteur
de
l'enzyme
de
conversion
ou
antagoniste
de
l'angiotensine
II
et
près
de
86
%
par
statine.
Un
peu
plus
de
la
moitié
de
ces
patients
avaient
été
inclus
dans
un
cycle
de
rééducation
cardiaque.
Dans
la
mesure
où
le
traitement
médicamenteux
du
patient
coronarien
recoupe
le
traitement
médicamenteux
de
la
maladie
athérothrombotique
(antiagrégant
plaquettaire,
inhibi-
teur
de
l'enzyme
de
conversion
et
statine),
nous
pouvons
légitimement
nous
poser
la
question
de
l'amélioration
du
pro-
nostic
du
patient
coronarien
en
dépistant
chez
un
patient
asymptomatique
d'autres
localisations
de
la
maladie
athéro-
thrombotique.
Ce
débat
a
été
relancé
avec
l'étude
AMERICA
Figure
9.
Mesure
de
la
PASc
au
niveau
de
la
tibiale
postérieure
droite.
Figure
7.
a
:
mesure
du
diamètre
antéropostérieur
de
l'aorte
sous-rénale
en
coupe
transversale
;
b
:
mesure
du
diamètre
antéropostérieur
de
l'aorte
sous-rénale
en
coupe
longitudinale.
Figure
6.
Avec
un
simple
déplacement
de
la
sonde
convexe
utilisée
pour
l'échographie
cardiaque
vers
l'ombilic,
nous
pouvons
étudier
facilement
l'aorte
abdominale
sous-rénale.
Figure
8.
Volumineux
anévrysme
de
l'aorte
abdominale
en
coupe
transverse,
partiellement
thrombosé.
H.T.
Bui,
D.
Metz
Dossier
/
Mise
au
point
6

(Aggressive
detection
and
Management
of
standard
of
Care
for
coronary
Atherosclerosis)
présentée
lors
de
l'ESC
2016.
Dans
cette
étude,
521
patients
considérés
comme
à
haut
risque
(âge
supérieur
à
75
ans,
atteinte
coronarienne
tritron-
culaire
ou
antécédents
de
syndrome
coronarien
aigu)
ont
été
randomisés
soit
vers
un
bras
prise
en
charge
classique
sans
recherche
de
localisation
athéromateuse
extracoronarienne
(n
=
258),
soit
vers
un
bras
avec
dépistage
et
prise
en
charge
de
localisation
extracoronarienne
(n
=
263)
en
plus
d'un
trai-
tement
optimal
(prescription
systématique
d'un
inhibiteur
de
l'enzyme
de
conversion,
d'un
bétabloquant,
d'une
statine
à
forte
dose
et
d'une
double
anti-agrégation
plaquettaire).
Après
deux
ans
du
suivi,
il
n'existait
pas
de
différence
signi-
ficative
dans
le
taux
de
survenue
du
critère
d'évaluation
prin-
cipal
(décès
ou
survenue
d'évènements
ischémiques
entraînant
une
hospitalisation
avec
défaillances
viscérales).
Il
était
de
47,4
%
dans
le
groupe
prise
en
charge
classique
contre
46,9
%
dans
le
groupe
dépistage
et
prise
en
charge
des
localisations
extracoronariennes.
Ce
résultat
doit
cependant
être
nuancé.
D'une
part,
cette
étude
ne
concerne
qu'un
sous-groupe
de
patients
âgés
de
plus
de
75
ans
avec
un
traitement
idéal
et
optimisé.
Dans
la
réalité,
la
prise
en
charge
des
patients
coronariens
et
en
particulier
ceux
qui
sont
polyvasculaires
peut
être
moins
idyllique.
En
effet,
toujours
grâce
aux
bras
des
patients
français
du
registre
REACH
[11],
nous
nous
apercevons
que
le
pourcentage
des
patients
contrôlés
pour
tous
les
facteurs
de
risque
varie
selon
les
caractéristiques
du
patient
:
20,9
%
des
patients
étaient
contrôlés
s'il
n'existait
qu'une
seule
localisation
athéro-
thrombotique,
et
seulement
de
15,2
%
s'il
existait
deux
ou
trois
localisations
athérothrombotiques.
Le
pourcentage
de
patients
traités
de
manière
optimale
varie
également
en
fonction
du
nombre
de
lits
artériels
touchés
:
62,9
%
des
patients
étaient
traités
par
aspirine
s'il
existait
une
seule
localisation
athéro-
mateuse
contre
à
peine
46,2
%
des
patients
traités
par
aspirine
en
cas
localisations
multiples.
Le
constat
est
le
même
pour
la
prescription
des
bétabloquants
:
51,4
%
des
patients
étaient
traités
par
un
bétabloquant
s'il
existait
une
seule
localisation
athéromateuse
contre
à
peine
44,6
%
des
patients
traités
par
bêtabloquants
en
cas
de
localisations
multiples.
Les
patients
ayant
des
localisations
athéromateuses
multiples
sont
donc
moins
bien
traités
médicalement
et
moins
bien
contrôlés
au
niveau
des
facteurs
de
risque
cardiovasculaire.
Le
suivi
de
deux
ans
de
l'étude
AMERICA
peut
être
également
paraître
un
peu
court
pour
démasquer
une
différence
signifi-
cative.
Le
suivi
des
patients
du
registre
REACH
a
montré
une
différence
nettement
significative
entre
les
patients
ayant
une
seule
localisation
de
la
maladie
athérothrombotique
et
ceux
ayant
une
localisation
multiple.
Ce
constat
s'aggravait
avec
le
temps
puisque
les
chiffres
étaient
plus
péjoratifs
à
trois
ans
de
suivi
[12]
qu'à
un
an
de
suivi.
L'incidence
du
paramètre
princi-
pal
mixte
(infarctus
du
myocarde,
accident
vasculaire
cérébral
et/ou
mortalité
d'origine
cardiovasculaire),
qui
était
de
4,7
%
à
un
an,
avait
augmenté
à
12,0
%
après
trois
ans
de
suivi.
Le
risque
d'événement
était
significativement
plus
élevé
dans
le
sous-groupe
avec
atteintes
de
maladie
athérothrombotique
multiple
que
chez
les
patients
avec
une
seule
atteinte
indivi-
dualisée.
Ainsi,
l'incidence
du
paramètre
principal
mixte
à
trois
ans
était
de
10,5
%
chez
les
patients
avec
atteinte
vasculaire
localisée
contre
17,9
%
chez
les
patients
à
atteintes
vascu-
laires
multiples.
Un
suivi
sur
le
long
terme
largement
supérieur
à
deux
ans
est
également
intéressant
pour
le
dépistage
de
l'anévrysme
de
l'aorte
abdominale
chez
le
patient
coronarien.
La
prévalence
de
l'anévrysme
de
l'aorte
abdominale
méconnu
chez
le
patient
venant
de
présenter
un
syndrome
coronarien
aigu
est
de
6,6
%
et
même
de
7,7
%
chez
le
patient
âgé
de
plus
de
50
ans
[6].
Celles-ci
sont
supérieures
à
la
prévalence
relevée
dans
la
population
générale
de
plus
de
65
ans
:
5,5
%
[7].
Même
si
aucun
de
ces
anévrysmes
de
l'aorte
abdominale
n'était
au
stade
chirurgical,
à
deux
ans,
le
pronostic
des
patients
porte-
urs
d'un
anévrysme
de
l'aorte
abdominale
était
plus
péjoratif
que
ceux
n'ayant
pas
d'anévrysme
de
l'aorte
abdominale.
La
présence
d'un
anévrysme
de
l'aorte
abdominale
était
un
fac-
teur
de
risque
indépendant
de
mortalité
cardiovasculaire
et
de
survenue
d'évènement
cardiovasculaire
non
fatal
avec
un
odd
ratio
de
3,2
[13].
La
découverte
d'un
anévrysme
de
l'aorte
abdominale
chez
le
patient
coronarien
est
importante
puisqu'elle
conditionne
le
pronostic
à
très
long
terme.
La
découverte
d'un
anévrysme
de
l'aorte
abdominale
impose
une
surveillance
échographique
régulière
afin
d'intervenir
avant
la
rupture.
La
mortalité
d'un
anévrysme
de
l'aorte
abdominale
lorsqu'il
est
découvert
au
stade
de
rupture
est
de
43
%
[14]
en
périopératoire
et
jusqu'à
77–90
%
si
on
inclut
la
mortalité
extrahospitalière
[15,16].
En
chirurgie
programmée,
la
mortalité
est
de
moins
de
4
%
[14].
L'enjeu
est
donc
de
dépister
un
anévrysme
de
l'aorte
abdo-
minale
pour
le
suivre
régulièrement
en
échographie
et
de
pouvoir
opérer
avant
la
rupture.
En
ce
qui
concerne
le
dépistage
des
sténoses
carotidiennes
asymptomatiques,
les
études
ACAS
(Asymptomatic
Carotid
Atherosclerosis
Study)
[17]
et
ACST
(Asymptomatic
Carotid-
Surgery
Trial)
[18]
ont
montré
un
bénéfice
à
la
revascularisa-
tion
chez
des
patients
porteurs
d'une
sténose
carotidienne
asymptomatique
d'au
moins
60
%
en
bon
état
général,
si
le
risque
opératoire
est
inférieur
à
3
%
et
sous
couvert
d'une
prise
en
charge
rigoureuse
des
facteurs
de
risque
cardiovasculaire.
Ce
bénéfice
reste
modeste
puisque
le
taux
d'accident
vascu-
laire
cérébral
ipsilatéral
passe
de
2,3
%
par
an
sous
traitement
médical
à
1,3
%
avec
le
traitement
chirurgical.
L'individualisa-
tion
de
sous-groupes
à
haut
risque
d'accident
cérébral
sous
traitement
médical
est
donc
un
enjeu
majeur.
Plusieurs
études
ont
essayé
de
définir
des
sous-groupes
de
patients
porteurs
de
sténoses
carotidiennes
asymptomatiques
mais
à
haut
risque
d'accidents
vasculaires
cérébraux
ipsilatéraux.
La
pré-
sence
au
scanner
cérébral
de
zones
d'ischémie
silencieuse
chez
ces
patients
[19]
ainsi
que
l'étude
de
l'échogénicité
de
la
plaque
d'athérome
[20]
semblent
être
des
éléments
intéres-
sants
à
prendre
en
compte
pour
identifier
ces
sous-groupes
de
patients
à
très
haut
risque
d'accident
vasculaire
cérébral.
La
problématique
est
plus
complexe
en
ce
qui
concerne
le
dépistage
de
l'artériopathie
oblitérante
des
membres
inférieurs
asymptomatique.
En
effet,
il
a
été
clairement
démontré
que
le
pronostic
de
l'artériopathie
oblitérante
des
membres
inférieurs
asymptomatique
est
le
même
que
celui
des
patients
sympto-
matiques.
En
effet,
le
terme
«
asymptomatique
»
est
fausse-
ment
rassurant
puisque
ces
patients
n'ont
pas
un
périmètre
de
marche
illimité
mais
souvent
ce
sont
des
patients
tellement
délabrés
qu'ils
sont
limités
par
d'autres
symptômes
et
s'arrê-
tent
avant
d'atteindre
leur
périmètre
de
marche.
Le
pronostic
n'est
pas
local
mais
général
puisqu'à
cinq
ans,
30
%
des
patients
vont
décéder
(50,3
%
de
cause
cardiaque
et
13
%
de
cause
neurologique).
Au
niveau
local,
à
cinq
ans,
seule-
ment
5
%
des
patients
auront
une
intervention
de
revascula-
risation
et
seulement
2
%
des
patients
vont
être
amputés
[21].
Cependant,
le
fait
de
dépister
une
artériopathie
oblitérante
des
Faut-il
dépister
les
localisations
athéromateuses
extracardiaques
chez
le
patient
coronarien
?Dossier
/
Mise
au
point
7
 6
6
 7
7
 8
8
1
/
8
100%