En savoir plus

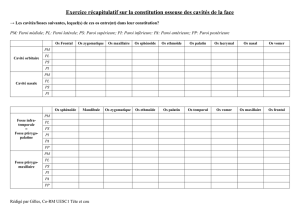
Comment se génère l’effet thermique qui aboutit à la sclérose de la veine ?
Il est la résultante de trois étapes successives
Conversion de la lumière
Caractéristiques optiques Conversion thermique
1. Réflexion
2. Absorption
3. Diffusion
Paramètres thermiques Transfert de chaleur
1. Diffusivité
2. Conductivité
Coefficients de dénaturation Processus de dénaturation
1. Susceptibilité thermique
2. Energie d’activation
Conversion de lumière en chaleur :
C’est l’étape optique, pendant laquelle la lumière émise à l’extrémité de la fibre optique, va diffuser dans le sang.
Il existe une atténuation de la lumière au fur et à mesure de la profondeur de pénétration, cette atténuation est
régie par une loi de décroissance exponentielle dite loi de BEER-LAMBERT.
Cette atténuation implique dans cette équation un coefficient de diffusion µs, et d’absorption µa. Elle intègre
aussi un coefficient de réflexion de la lumière, spécifique au tissu concerné. Io représente l’intensité laser
produite au moment du tir.

Loi de Beer-Lambert
I0
d
0,37 I0
P = Profondeur de pénétration
I = I0(1-R) e –(µa + µs) . d
Intensité Réflexion Absorption
Diffusion
Distance d’extinction de la lumière dans le
sang suivant différentes longueurs d’onde
δ = 1 / 3 µa(µa+ µs)
0
0,05
0,1
0,15
0,2
0,25
810 nm
940 nm
980 nm
0,134
0,193
δ(Cm)
0,216
Voici les coefficients optiques pour différentes longueurs d’onde pour le calcul de la distance d’extinction
correspondante ( = distance au delà de laquelle il n’y a plus de diffusion de lumière) :
= 1/( 3a (a + s’)) :
µa = coefficient d’absorption, µs = coefficient de diffusion,
µs’ = coefficient de diffusion réduit = µs (1-g), g étant l’isotropie

LONGUEUR
D'ONDE (NM)
A (CM- 1 )
S’ (CM- 1 )
(CM)
665
1.3
6.11
0.186
960
2.84
3.84
0.132
800
2.01
7.12
0.134
940
1.2
6.21
0.193
980
1.05
5.78
0.216
Ces calculs montrent que la distance jusqu'à laquelle il y a conversion de lumière est de l'ordre de 1.4 à 2 mm.
C'est ainsi que ce processus de conversion de lumière définit un volume chauffé "primaire" à partir duquel, il va
y avoir un transfert de chaleur. C'est ce transfert vers un volume, dit « secondaire », qui va principalement
contribuer au dommage tissulaire final.
L’isotropie évalue la forme du champ de diffusion des photons dans le tissu concerné. Plus ce champ est
directionnel (forme oblongue), plus l’isotropie g se rapproche de 1. Moins il est directionnel (forme sphérique),
plus elle se rapproche de 0. Elle est en fait la représentation de l’angle moyen de diffusion des photons dans le
milieu.
Laser : facteur d’isotropie g
g = 0 g = 0,4 g = 0,6 g = 0,7
g = < cos θ > (0 < g < 1)
Transfert de chaleur :
Cette étape aboutit à la création d’un gradient de température dans le volume sanguin et le tissu concerné. Le but
de la génération de chaleur est son transfert vers la paroi de la veine, ce qui implique un processus de
conduction de chaleur. Chaque tissu se caractérise par sa capacité à transporter la chaleur par un état stationnaire
qui est la conductivité thermique et un état dit transitoire qui est la diffusivité thermique. Cette dernière dépend
du temps de relaxation thermique (TrT) : il correspond à la durée nécessaire pour que l’énergie thermique
remplisse un volume « primaire » puis diffuse à l’extérieur en définissant un volume secondaire, où la
température est équivalente ou supérieure à 50 % de la valeur maximale atteinte. On estime que dans le tissu
veineux , ce front de chaleur se déplace à 1,25 mm par seconde. Pendant ce temps, la cible refroidit. L’équation
se rédige ainsi : TrT = D2 / C.k
D = dimension du volume primaire
k = diffusivité thermique (1,7 .10-3 cm2.s-1 pour le sang).

Le coefficient C va dépendre de la géométrie de la cible : dans le cas d’une sphère C=27, dans le cas d’un
cylindre C=16, dans le cas d’une surface plane C=4.
Si on considère que le volume primaire est une sphère de 2 mm, le TrT est de 0.9s. Cela signifie que si le temps
de tir est inférieur ou égal à cette durée, seul ce volume sera effectivement chauffé. On comprend donc aisément
qu'il est nécessaire d'augmenter le temps de tir afin qu'il y ait une élévation de chaleur de la totalité du vaisseau
et de la paroi de celui-ci. Si on maintient l'irradiation, la chaleur va diffuser progressivement du volume primaire
avec une vitesse de l'ordre de 1.25 mm/s.
Ce tableau propose les durées d'irradiation a priori nécessaires pour chauffer le volume sanguin contenu dans des
vaisseaux de différents diamètres.
Diamètre (mm)
Temps de tir (s)
2
0.9
4
1.7
6
2.5
8
3.3
12
4.9
15
6.1
20
8.1
25
10.1
Des mesures expérimentales de températures ont été réalisées sur un modèle porcin (810 nm, 8-15 W, 1-2s) et
mettent en évidence une température externe à 40,8 °C à 8W/1s puis 48,9 °C à 8 W/2s, 47,1 °C à 10 W/1s et 49,1
°C à 10 W/1,5 s . Ces températures chutent de 30 % si une intumescence (injection d’anesthésique dilué le long
de la veine qui génère un « matelas » de protection thermique autour de la veine) est réalisée ; à 15 W/0,5 s la
température passe de 44 à 34,5 °C. En 980 nm (15 W, Te -1,5 s, Tr -1,5 s, retrait de 3 mm à chaque tir) un travail
effectué sur 63 saphènes détermine l’influence d’une intumescence sur la température périveineuse. La
température mesurée était de 27,7 °C contre 31,3 °C sans intumescence. La baisse moyenne de température
enregistrée était de 3,4 °C en cas d’intumescence. Les températures maximales 12,1 °C d’augmentation (max
40,9 °C) pour le groupe intumescence (I) et 20,6 °C (max 49,8 °C) pour le groupe sans intumescence (II). En fin
de procédure on notait 30,9 °C pour le groupe I et 35,9 °C pour le groupe II.
Des mesures des températures moyennes maximales intra-vasculaires enregistrées lors des tirs de 729 °C (pic à
1334 °C) contre 85°C pour la radiofréquence. Un travail expérimental sur jugulaire de chèvre montre une mesure
endo-veineuse avec une augmentation moyenne de température de 93 °C à 4 mm en distalité de l’extrémité de la
fibre, 307 °C à 2 mm, 729 °C au niveau de l’extrémité de la fibre et de 231 °C à 2 mm en proximalité de son
extrémité. Ces températures élevées ne signifient pas qu’il y aura des lésions à la surface de la peau, par
exemple. Ce qui compte, c’est le volume dit « primaire » dans lequel va se maintenir une telle température, et
pendant combien de temps.
Un modèle mathématique a été établi suivant que les tirs sont pulsés ou continus (vitesses de retrait de 1 à 3
mm/s) sur des vaisseaux de 3 et 5 mm de diamètre. En mode pulsé, 15 - 50 J/cm sont nécessaires pour obtenir
une lésion intimale alors qu’en mode continu il faut 65 - 100 J/cm. Le retrait discontinu de la fibre nécessite une
certaine précision faisant préférer le retrait automatisé par certains auteurs.
Dans un second travail, ce même modèle est appliqué à l’étude comparative du 980 nm (mode continu, 50-160
J/cm, 10-32 W, retrait 2 mm/s) avec le 1320 nm Nd :YAG (mode pulsé, 135 W, 1,2 ms, F 30-50Hz). Le 1320 nm
nécessite moins d’énergie pour altérer toute la paroi vasculaire. Il est conclu que le 980 nm et le 1320 nm
présente des résultats voisins en terme d’occlusion, avec des effets indésirables qui sont cliniquement proches
dans les différentes études. L’influence des longueurs d’onde testées 810 ou 980 nm reste minime. Voici les
résultats de quelques simulations (Société Osyris):
En abscisse (ligne horizontale) est évaluée la longueur de veine, en ordonnée (ligne verticale) le diamètre de
veine traitée. Les couleurs évaluent le niveau de lésion.
Pour visualiser la simulation, cliquez au centre du cadre. La première simule un retrait régulier de la fibre avec
un tir continu, les trois suivantes montrent des tirs discontinus en espaçant progressivement ces tirs de 3 mm,
puis 5 et 7 mm. Dans cette dernière procédure, on constate qu’il persiste des zones entre chaque tir, où il n’y a
pas de sclérose thermique.

 6
6
 7
7
 8
8
1
/
8
100%