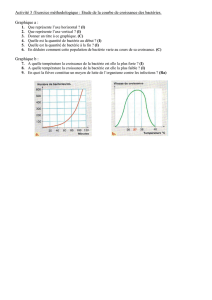
en tête DEA - Ecologie Microbienne Lyon

Master Ecosciences, Microbiologie
Parcours Recherche « Ecologie Microbienne »
Bâtiment Dubois – 2ème étage
Université Claude Bernard Lyon 1
69622 – VILLEURBANNE CEDEX
Tel : 04 72 43 13 77
E-mail : master2.ecomi@univ-lyon1.fr
http://spiral.univ-lyon1.fr/Files_m/M5298/WEB/EcologieMicrobienne.htm
PROPOSITION SUJET de MASTER 2014-2015
TITRE : Etude de la colonisation et de la persistance de la bactérie Acinetobacter chez le
moustique tigre Aedes albopictus
Nom, Prénom du Maitre de Stage : Valiente Moro, Claire
Qualité : Maître de Conférences
Téléphone : 04 72 43 35 65 E-mail : [email protected]
Laboratoire d’accueil, Responsable et équipe :
UMR CNRS 5557 Ecologie Microbienne – Y. MOENNE-LOCCOZ
Equipe Dynamique Microbienne et Transmission Virale – P. MAVINGUI
Adresse : Bat. A. LWOFF, 10 rue Raphaël Dubois
69622 Villeurbanne Cedex
Nom du candidat éventuellement proposé :
S'il n'est pas retenu, acceptez-vous un autre candidat ? Oui - Non
Description du sujet au verso

Sujet (objectif, démarche et technique, collaboration(s),...) :
Contexte et objectifs
Originaire d’Asie, le moustique tigre Aedes albopictus est une des espèces animales les plus invasives au
monde actuellement (Benedict et al, 2007). Sa capacité à transmettre divers arbovirus (virus transmis par
les arthropodes), comme les virus de la Dengue et du Chikungunya, suscite une inquiétude croissante des
autorités sanitaires. Les moyens de lutte actuels reposent essentiellement sur l’utilisation de biocides
chimiques, qui ont malheureusement des effets non intentionnels sur des espèces non cibles, et dont
l’efficacité est confrontée à l’apparition de moustiques résistants. Dans ce contexte, en complément des
agents chimiques, l’exploitation des communautés microbiennes, et en particulier des bactéries
symbiotiques, a été proposée comme une alternative innovante pour la lutte anti-vectorielle (Ricci et al,
2012). En effet, chez certains insectes vecteurs, il a été établi que certaines bactéries pouvaient interférer
avec la survie et la dissémination des pathogènes in insecta, et par conséquent, contribuer à la modulation
de la compétence vectorielle (Weiss et Aksoy, 2011). De plus, de nombreux exemples chez les insectes
ravageurs de culture témoignent de l’implication des bactéries dans des fonctions clés comme la nutrition,
le développement ou encore la reproduction (Feldhaar, 2011). Cependant, le rôle des associations
symbiotiques reste à ce jour très peu documenté chez les insectes hématophages et les moustiques en
particulier.
Récemment, nous avons montré une forte prévalence du symbiote secondaire cultivable Acinetobacter au
sein des populations naturelles d’Ae. albopictus (Minard et al, 2013). Nous faisons l’hypothèse que cette
forte prévalence pourrait témoigner d’une association durable entre cette bactérie et le moustique, avec un
possible rôle dans la biologie de ce dernier. L’objectif de ce travail sera de définir, au moyen
d’infections expérimentales, les caractéristiques de l’association entre Acinetobacter et Ae. albopictus en
évaluant la capacité de la bactérie à coloniser l’insecte et à se maintenir au cours des générations.
Démarche expérimentale
L’élevage et la manipulation du moustique Ae. albopictus seront conduits en insectarium de confinement
niveau 2 au laboratoire d’Ecologie Microbienne. L’ensemble des infections expérimentales sera réalisé
avec la souche Acinetobacter sp. KZ-OAlM que nous avions isolée d’une population naturelle d‘Ae.
albopictus (Zouache et al, 2011), et transformée avec un plasmide exprimant le gène marqueur de la GFP.
Dans un premier temps, la capacité de colonisation de la bactérie sera évaluée par l’analyse de la
cinétique d’infection après inoculation de moustiques femelles via le repas sucré. Des lots de 30 individus
seront prélevés tous les 3 jours sur une période de 30 jours post-inoculation. La dynamique de
colonisation bactérienne sera suivie par localisation in insecta au microscope à épifluorescence en
ciblant différents organes clés (tube digestif, glandes salivaires, ovaires). L’abondance relative des
bactéries Acinetobacter et de la microflore bactérienne totale dans les différents organes sera mesurée par
PCR quantitative. Parallèlement, l’effet de l’inoculation des bactéries sur la fitness du moustique sera
évalué en ciblant différents traits d’histoire de vie (survie, reproduction).
Dans un deuxième temps, la persistance de la bactérie sera évaluée à l’aide des expériences de
transmissions transovarienne et vénérienne chez le moustique. Pour la transmission transovarienne, des
individus femelles seront nourris avec du sang contaminé par les bactéries. Un lot de 10 individus (oeufs,
nymphes, imagos) sera analysé par PCR quantitative et observation au microscope à épifluorescence.
Pour la transmission vénérienne, des individus mâles seront dans un premier temps nourris sur du jus
sucré contaminé puis mis au contact de femelles vierges. Après copulation, ces dernières seront
disséquées et leurs spermathèques observées au microscope à épifluorescence.
Les données obtenues apporteront un premier éclairage sur la capacité de colonisation d’une bactérie
naturellement transformable chez Ae. albopictus et d’en faire un candidat potentiel pour le
développement de nouvelles stratégies de contrôle biologique.
Ce sujet bénéficie d’un financement européen ERA-NET FP7 Biodiversa.
Benedict et al, 2007. Vector Borne Zoonotic Dis 7:76-85.
Ricci et al, 2012. Currr Opin Microbiol 15:278-284.
Weiss et Aksoy, 2011. Trends Parasitol. 27:514-522
Feldhaar, 2011. Ecol Entomol 36 :533-544.
Minard et al, 2013. FEMS Microbiol Ecol 83:63-73.
Zouache et al, 2011. FEMS Microbiol Ecol 75:377-389.
1
/
2
100%