Syndrome X cardiaque et dysfonction coronaire

16:00:20:04:12
Page 173
Page 173
Syndrome X cardiaque et dysfonction
coronaire microvasculaire
C. Noel Bairey Merz, MD ; Carl J. Pepine, MD
Observation clinique : Une femme
de 44 ans est adressée par son
médecin pour aggravation progressive
d’une douleur thoracique présente
depuis 2007, ayant conduit à pratiquer
en mai 2008 une épreuve d’effort
qui s’était révélée anormale, celle-ci
ayant été suivie d’une coronarographie
en juin 2008. Cette patiente avait
précédemment été hospitalisée plu-
sieurs fois pour rechercher un éventuel
infarctus du myocarde, un taux élevé
de troponine ayant été mis en évidence
en 2001 à l’occasion d’une de ces
hospitalisations. Un cancer du sein
avait, par ailleurs, été découvert chez
elle en 2007. Actuellement, elle
présente quotidiennement une douleur
thoracique rétrosternale d’effort qui
irradie dans le bras et la main gauches
et disparaît au repos. Elle exerce la
fonction d’agent de police, ce qui la
conduit fréquemment à devoir pour-
suivre des suspects, de sorte que sa
crainte est de ne plus pouvoir effectuer
son travail. La recherche de facteurs de
risque cardiovasculaire est négative.
Cette femme prend du tamoxifène et
des vitamines ; l’examen physique et
l’ECG pratiqué au repos sont tous
deux normaux. L’analyse de la coro-
narographie précédemment réalisée
confirme l’absence de coronaropathie
obstructive et la normalité de la
fonction ventriculaire gauche.
Pour déterminer l’origine des
symptômes invoqués par cette patiente,
une étude de la réactivité coronaire
(ERC) est pratiquée, qui met en
évidence une réserve coronaire (RC)
déprimée en réponse à l’injection
d’adénosine et une réduction du flux
de réserve coronaire (Figure 1) ainsi
qu’une constriction du réseau artériel
coronaire après injection d’acétyl-
choline, ces anomalies étant en
faveur d’une dysfonction endothéliale
(Figure 2). L’imagerie par résonance
magnétique cardiaque sous épreuve à
l’adénosine suggère l’existence d’une
dysfonction coronaire microvasculaire
(DCM ; Figure 3).
La DCM est un sous-type
à haut risque du
syndrome X cardiaque
Les patients angineux qui présentent
des signes d’ischémie myocardique à
l’épreuve d’effort en l’absence de toute
lésion coronaire occlusive à l’angio-
graphie (trouble autrefois désigné sous
le nom de syndrome X cardiaque, ou
SXC) posent un problème de prise en
charge majeur. Chez les individus
atteints d’un tel syndrome, celui-ci peut
se traduire par une douleur thoracique
persistante, des manifestations
angineuses et un sous-décalage du
segment ST de type ischémique ou un
trouble spontané de la perfusion ou de
la mobilité pariétale du myocarde
pendant l’épreuve d’effort. L’opinion
qui prévalait jusqu’alors sur la base des
premiers travaux était que ce syndrome
avait un pronostic bénin ; toutefois,
les données de l’étude WISE (Women’s
Ischemia Syndrome Evaluation
[évaluation des syndromes ischémiques
de la femme] menée à l’instigation
du National Heart, Lung, and Blood
Institute (Institut Américain de
cardiologie, de pneumologie et
d’hématologie) montrent que jusqu’à
50 % de ces patients pourraient être
atteints d’une DCM, celle-ci ayant un
pronostic péjoratif.1 Des observations
émanant de WISE,1 qui est l’étude la
plus vaste et la plus complète jamais
menée chez la femme d’âge moyen
affectée de ce syndrome, il ressort que,
chez les patients présentant une DCM,
l’écho-Doppler intravasculaire met
fréquemment en évidence la présence
de lésions d’athérosclérose coronaire2
et que le taux annuel d’événements
cardiaques atteint 2,5 %, ces événe-
ments consistant en des infarctus du
myocarde, des accidents vasculaires
cérébraux, des hospitalisations pour
insuffisance cardiaque congestive et
des morts subites.3,4 La DCM apparaît
donc comme un sous-type à haut
risque du SXC.
En l’absence de coronaropathie
obstructive, les artères de faible calibre
et les artérioles siégeant en aval des
artères coronaires épicardiques sont les
principaux sites de résistance au flux
sanguin myocardique. La structure et
la fonction de ces microvaisseaux
jouent un rôle dans la perfusion
myocardique et sa distribution
régionale au sein du myocarde et dans
son épaisseur. La dysfonction micro-
vasculaire peut se manifester par les
anomalies ci-après, présentes isolément
ou de façon conjointe : (1) une altéra-
tion du tonus de repos des cellules
musculaires lisses vasculaires secon-
daire à la dysfonction de ces
dernières ou à celle des cellules
endothéliales, (2) une réponse
Women’s Heart Center, Institut Cardiologique Cedars-Sinai, Cedars-Sinai Medical Center, Los Angeles, Californie (C.N.M.B.) et Service de Médecine
Cardiovasculaire, Université de Floride, Gainesville, Floride, Etats-Unis (C.J.P.).
Correspondance : C. Noel Bairey Merz, MD, Women’s Heart Center, 444 S San Vicente Blvd, Suite 600, Los Angeles, CA 90048, Etats-Unis.
E-mail : merz@cshs.org
(Traduit de l’anglais : Syndrome X and Microvascular Coronary Dysfunction. Circulation. 2011;124:1477–1480.)
© 2011 American Heart Association, Inc.
Circulation est disponible sur le site http://circ.ahajournals.org
173

16:00:20:04:12
Page 174
Page 174
anormale aux stimuli constricteurs ou
dilatateurs, (3) une diminution du
nombre des artérioles et des capillaires
(raréfaction) et (4) des anomalies
Figure 1. Profils des ondes de vélocité du flux sanguin coronaire objectivés par le Doppler
intracoronaire après injections intracoronaires d’adénosine et d’acétylcholine. La réserve
coronaire (RC) est le rapport des pics moyens de vélocité avant et après injection
d’adénosine. Le flux de réserve coronaire (FRC) est le rapport des pics moyens de FRC
mesurés avant et après injection d’acétylcholine.
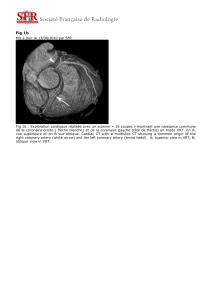
Figure 2. Images coronarographiques montrant la constriction des artères coronaires
(flèche) induite par l’injection intracoronaire d’acétylcholine (ACH) et la dilatation provoquée
par l’injection intracoronaire de trinitrine (TN).
Figure 3. Clichés d’imagerie par résonance magnétique cardiaque montrant la perfusion
ventriculaire sous épreuve de stress à l’adénosine (à gauche) et à au repos (à droite).
Les flèches signalent les zones dans lesquelles la perfusion myocardique est diminuée,
le trouble s’aggravant sous épreuve de stress (à gauche).
structurales ayant pour effets de
réduire le diamètre des lumières
vasculaires, d’augmenter le rapport
paroi/lumière, d’accroître la rigidité des
vaisseaux et de provoquer leur remode-
lage. Une raréfaction des capillaires
myocardiques a été décrite dans la
cardiomyopathie dilatée5 et l’angio-
pathie d’allogreffe cardiaque,6 mais elle
peut également intéresser les vaisseaux
non cardiaques dans un contexte
d’hypertension artérielle7 ou de SXC.8
Il a récemment été établi que les
cellules musculaires lisses vasculaires
interviennent puissamment dans la
biologie des cellules endothéliales, ce
qui semble témoigner de l’existence
d’une interaction régulatrice qui
n’avait pas été perçue jusqu’alors.9
Les troubles de la microcirculation
coronaire exercent une importante
influence pronostique dans les
syndromes coronaires aigus et
chroniques,10 mais aussi dans le
diabète, la cardiomyopathie hyper-
trophique et l’angiopathie coronaire
d’allogreffe,11 ainsi que dans le SXC
comme il ressort des données de l’étude
WISE.4
Diagnostic invasif de la DCM
Le succès du traitement est subor-
donné à l’acquisition d’une certitude
diagnostique. Chez les individus
présentant des signes et symptômes
d’ischémie, la stratification des risques
et l’élaboration de la stratégie de prise
en charge optimale exigent une étude
de la réactivité coronaire (ERC) fondée
sur des perfusions intracoronaires
d’adénosine, d’acétylcholine et de
trinitrine de manière à évaluer les fonc-
tions endothéliale et non endothéliale
des structures tant micro- que macro-
vasculaires (épicardiques), après s’être
assuré de l’absence de lésion coronaire
obstructive. La mise en œuvre d’un
protocole standard d’exploration par
sonde Doppler et administration
d’adénosine, tel qu’utilisé pour
mesurer le FRC,12 dans les coronaro-
graphies quantitatives et qualitatives
et dans les épreuves par perfusion
intracoronaire d’acétylcholine et de
trinitrine,3 permet d’explorer les
possibles mécanismes à l’origine de la
DCM.12 L’apport de cette enquête
diagnostique l’emporte probablement
sur les risques d’incertitude diagnos-
tique et d’échec du traitement visant à
réduire le risque.4 Toutefois, dans la
mesure où elle peut être grevée de
complications potentiellement graves
174 Circulation Mai 2012

16:00:20:04:12
Page 175
Page 175
telles qu’une dissection d’artère
coronaire, l’ERC ne doit être pratiquée
que par des cardiologues intervention-
nels expérimentés chez des patients
reconnus à risque. Il importe égale-
ment d’avoir à l’esprit que le FRC,
qui est le principal paramètre non
dépendant de l’endothélium mesuré
par l’ERC, est influencé par la
demande myocardique en oxygène. De
ce fait, son évaluation doit tenir
compte de la fréquence cardiaque, de
la pression artérielle ainsi que de la
pression de remplissage et de la
contractilité du ventricule gauche.13
La patiente qui nous occupe
présente des signes de dysfonction
endothéliale de ses artères coronaires
épicardiques (qui, notamment, se
contractent en réponse à l’injection
d’acétylcholine). Le trouble s’étend
probablement à la microvascularisa-
tion ; de plus, cette femme présente
également des signes de dysfonction
artériolaire (tel qu’un faible FRC
mesuré sous perfusion d’adénosine).
La dilatation de ses artères coronaires
épicardiques en réponse à l’injection de
trinitrine semble par ailleurs normale.
Diagnostic non invasif
de la DCM
Lorsque l’ERC s’avère anormale, il est
possible de rechercher l’existence d’un
trouble de la perfusion myocardique
par une approche non invasive fondée
sur la tomodensitométrie à émission
de simples photons, la tomographie à
émission de positons et l’imagerie par
résonance magnétique cardiaque avec
épreuve de stress1 ; cela étant, la sensi-
bilité et la spécificité de ces techniques
ne sont pas encore parfaitement
établies. La méthode de référence en
matière de diagnostic d’une DCM
demeure l’ERC invasive. Une étude
ancillaire de WISE commanditée par le
NHLBI des Etats-Unis est actuelle-
ment menée pour évaluer l’intérêt de
l’imagerie par résonance magnétique
cardiaque dans le diagnostic et le bilan
pronostique (estimation du risque)
de la DCM chez la femme.14 Si
les résultats préliminaires14–16 sont
confirmés, cette technique sera, pour
l’heure, la seule utilisable en pratique
clinique pour évaluer la distribution
transmurale du flux sanguin coronaire
(en vue, par exemple, d’une étude com-
parative entre territoires endocardique
et épicardique).
Traitement du SXC et
de la DCM
Les actuelles recommandations de
prise en charge de l’angor et du SXC ne
proposent pas d’attitude spécifique en
ce qui concerne la DCM.17,18 Le traite-
ment doit viser deux objectifs princi-
paux : (1) combattre l’athérosclérose et
l’ischémie afin de réduire le risque de
complication cardiaque et (2) abolir les
symptômes angineux de manière à
améliorer la qualité de vie du patient.
En raison de la forte prévalence des
lésions d’athérosclérose coronaire et du
mauvais pronostic rapportés chez ces
individus, nous faisons également
nôtres les recommandations formulées
par le comité d’experts du National
Cholesterol Education Program (Pro-
gramme américain d’éducation sur le
cholestérol) dans son 3ème rapport sur le
traitement de l’adulte,19 consistant
en la mise en œuvre de mesures théra-
peutiques visant à améliorer l’hygiène
de vie,20 celles-ci étant complétées par
la prescription d’aspirine à faible dose
et d’une statine en considérant que
le trouble présenté par ces patients
équivaut à une maladie coronaire.
Les données des essais cliniques
montrent que les bêtabloquants, les
inhibiteurs de l’enzyme de conversion
de l’angiotensine, les dérivés nitrés, les
inhibiteurs calciques, la ranolazine,
les dérivés xanthiques tels que l’amino-
phylline, la contrepulsion externe
renforcée, la thérapie comportementale
cognitive, les antidépresseurs tricy-
cliques à faible dose et la neurostimula-
tion sont utiles pour améliorer les
symptômes angineux, les paramètres
de l’épreuve d’effort et la fonction
endothéliale (Tableau). Il convient de
noter que la doxazosine est dénuée
d’effet bénéfique et que l’augmentation
des risques d’accident vasculaire
cérébral et d’insuffisance cardiaque
qui lui a été imputée dans ALLHAT
(Antihypertensive and Lipid-Lowering
treatment to prevent Heart Attack
Trial [évaluation des traitements anti-
hypertenseur et hypolipémiant dans la
prévention de l’infarctus du myocarde])
doit conduire à proscrire cet alpha-
bloquant, y compris chez la femme
hypertendue. L’hormonothérapie à
faible dose1 semble inefficace et la
supplémentation en L-arginine s’est
révélée néfaste chez les patients en
phase de post-infarctus, bien qu’elle ait
amélioré les signes et symptômes dans
une cohorte d’individus atteints de
SXC. Le diltiazem n’améliore pas le
FRC chez ces patients. En revanche, les
bêtabloquants ont régulièrement fait la
preuve de leur supériorité par rapport
aux dérivés nitrés et aux inhibiteurs
calciques dans les essais cliniques
randomisés. Un essai exploratoire
mené dans la continuité de WISE en
vue d’évaluer l’intérêt du sildénafil
chez cette population de patients
semblerait montrer que ce médicament
améliore le FRC.
Conclusions
Chez les sujets présentant un SXC,
défini par la présence de précordialgies
persistantes évocatrices d’un angor et
de symptômes ischémiques en l’ab-
sence de lésion coronaire obstructive, il
existe très fréquemment une DCM,
Tableau. Traitement des patients
angineux présentant des
manifestations d’ischémie
myocardique en l’absence de
coronaropathie obstructive
Bairey Merz et Pepine Syndrome X cardiaque et dysfonction coronaire microvasculaire 175

16:00:20:04:12
Page 176
Page 176
laquelle a une valeur pronostique
péjorative. L’ERC demeure la méthode
diagnostique de référence ; une
approche non invasive de diagnostic de
la DCM est en cours d’étude et semble
prometteuse. La mise en œuvre de
mesures thérapeutiques destinées à
améliorer l’hygiène de vie et la pres-
cription d’aspirine à faible dose et
d’un traitement hypolipémiant sont
recommandées en raison de la forte
prévalence des lésions d’athérosclérose
coronaire et du risque élevé de compli-
cations cardiovasculaires. Des données
limitées émanant d’essais cliniques
suggèrent que la prescription d’un
traitement anti-ischémique et anti-
angineux (qui, dans ces essais, a le plus
souvent reposé sur l’administration
d’un bêtabloquant) serait susceptible
d’améliorer les symptômes, les para-
mètres de l’épreuve d’effort ainsi que la
fonction endothéliale et/ou la micro-
circulation coronaire. Bien que de
vastes études de résultat soient actuelle-
ment programmées chez les patients
atteints de DCM, les données au-
jourd’hui disponibles sont suffisantes,
malgré leur tendance évolutive, pour
incorporer les stratégies spécifique-
ment préconisées à l’égard de cette
population aux recommandations déjà
existantes en matière de prise en charge
de l’angor et des syndromes coronaires
aigus. Les deux préoccupations
majeures du médecin doivent être
l’identification de l’ischémie et la mise
en œuvre des mesures prônées dans
les recommandations pour traiter
l’angor et réduire les facteurs de risque
cardiaque.
Suivi et évolution de notre
observation clinique
Le traitement prescrit à la patiente a
consisté à associer 40 mg de sim-
vastatine per os par jour, 81 mg
d’aspirine per os par jour, 6,25 mg de
carvédilol per os deux fois par jour et
0,4 mg de trinitrine sublinguale à la
demande et avant tout effort physique.
Au terme de deux ans de suivi, les
symptômes que présentait cette
femme se sont atténués ; elle a pu
conserver son emploi et n’a fait
l’objet d’aucune autre hospitalisation
pour angor ou suspicion de syndrome
coronaire aigu.
Sources de financement
Cette étude a été financée par des dotations
du NHLBI des Etats-Unis (Nos N01-HV-
68161, N01 HV-68162, N01-HV-68163
et N01-HV68164), par une bourse des
General Clinical Research Centers (M01-
RR00425) du National Center for Research
Resources des Etats-Unis et par des bourses
de la Gustavus and Louis Pfeiffer Research
Foundation (Denville, New-Jersey, États-
Unis) ainsi que de la Women’s Guild, de
l’Edythe L. Broad Women’s Heart Research
Fellowship et du Barbra Streisand Women’s
Cardiovascular Research and Education
Program qui sont tous trois rattachés au
Cedars-Sinai Medical Center (Los Angeles,
Californie, Etats-Unis). Le Dr Pepine a
bénéficié de bourses des NIH/NHLBI
(5 U01 HL087366–04, 5 R01 HL091005–03,
5 R01 HL090957–03 et 2 U01 GM074492–
06), d’une dotation 3 U01 AG022376–
05A2S1 du National Institute on Aging et
d’une bourse 5 UL1 RR029890–02 du
National Center for Research Resources,
qui sont deux divisions des National
Institutes of Health.
Déclarations
Le Dr Bairey Merz a bénéficié de bourses de
recherche dans le cadre de l’étude WISE
(NIH/NHLBI 5 R01 HL090957) ; il a, par
ailleurs, été rémunéré par la Women-Heart
Coalition, le Centre Médical Los Robles,
l’Hôpital Communautaire de Monterey,
Primed, l’Association des Gynécologues-
Obstétriciens de Los Angeles et la North
American Menopause Society; il a égale-
ment été rétribué en qualité de consultant
par le NHLBI. Le Dr Pepine a bénéficié de
bourses de recherche dans le cadre de
l’étude WISE (NIH/NHLBI U01 HL6489
et NIH/NHLBI 5 R01 HL090957).
Références
1. Bairey Merz CN, Shaw LJ, Reis SE, Bittner
V, Kelsey SF, Olson M, Johnson BD, Pepine
CJ, Mankad S, Sharaf BL, Rogers WJ,
Pohost GM, Lerman A, Quyyumi AA,
Sopko G. Insights from the NHLBI-
sponsored Women’s Ischemia Syndrome
Evaluation (WISE) study, part II: gender
differences in presentation, diagnosis, and
outcome with regard to gender-based
pathophysiology of atherosclerosis and
macrovascular and microvascular coronary
disease. J Am Coll Cardiol. 2006;47:
S21–S29.
2. Khuddus MA, Pepine CJ, Handberg EM,
Bairey Merz CN, Sopko G, Bavry AA,
Denardo SJ, McGorray SP, Smith KM,
Sharaf BL, Nicholls SJ, Nissen SE,
Anderson RD. An intravascular ultrasound
analysis in women experiencing chest pain
in the absence of obstructive coronary
artery disease: a substudy from the National
Heart, Lung, and Blood Institute-sponsored
Women’s Ischemia Syndrome Evaluation
(WISE). J Interv Cardiol. 2010;23:511–519.
3. von Mering GO, Arant CB, Wessel TR,
McGorray SP, Bairey Merz CN, Sharaf BL,
Smith KM, Olson MB, Johnson BD, Sopko
G, Handberg E, Pepine CJ, Kerensky RA.
Abnormal coronary vasomotion as a
prognostic indicator of cardiovascular
events in women: results from the National
Heart, Lung, and Blood Institute-
sponsored Women’s Ischemia Syndrome
Evaluation (WISE). Circulation. 2004;109:
722–725.
4. Pepine CJ, Anderson RD, Sharaf BL, Reis
SE, Smith KM, Handberg EM, Johnson
BD, Sopko G, Bairey Merz CN. Coronary
microvascular reactivity to adenosine pre-
dicts adverse outcome in women evaluated
for suspected ischemia: results from the
National Heart, Lung, and Blood Institute
WISE (Women’s Ischemia Syndrome
Evaluation) study. J Am Coll Cardiol.
2010;55:2825–2832.
5. Tsagalou EP, Anastasiou-Nana M, Agapi-
tos E, Gika A, Drakos SG, Terrovitis JV,
Ntalianis A, Nanas JN. Depressed coronary
flow reserve is associated with decreased
myocardial capillary density in patients with
heart failure due to idiopathic dilated cardio-
myopathy. J Am Coll Cardiol. 2008;52:
1391–1398.
6. Escaned J, Flores A, Garcia-Pavia P, Sego-
via J, Jimenez J, Aragoncillo P, Salas C,
Alfonso F, Hernandez R, Angiolillo DJ,
Jimenez-Quevedo P, Banuelos C, Alonso-
Pulpon L, Macaya C. Assessment of micro-
circulatory remodeling with intracoronary
flow velocity and pressure measurements:
validation with endomyocardial sampling
in cardiac allografts. Circulation. 2009;120:
1561–1568.
7. Rakusan K, Flanagan MF, Geva T,
Southern J, Van Praagh R. Morphometry
of human coronary capillaries during
normal growth and the effect of age in left
ventricular pressure-overload hypertrophy.
Circulation. 1992;86:38–46.
8. Antonios TF, Kaski JC, Hasan KM,
Brown SJ, Singer DR. Rarefaction of skin
capillaries in patients with anginal chest
pain and normal coronary arteriograms.
Eur Heart J. 2001;22:1144–1148.
9. Balcells M, Martorell J, Olive C, Santacana
M, Chitalia V, Cardoso AA, Edelman ER.
Smooth muscle cells orchestrate the
endothelial cell response to flow and injury.
Circulation. 2010; 121:2192–2199.
10. Schachinger V, Britten MB, Zeiher AM.
Prognostic impact of coronary vasodilator
dysfunction on adverse long-term outcome
of coronary heart disease. Circulation. 2000;
101:1899–1906.
11. Camici PG, Crea F. Coronary microvascular
dysfunction. N Engl J Med. 2007;356:
830–840.
12. Phan A, Shufelt C, Merz CN. Persistent
chest pain and no obstructive coronary
artery disease. JAMA. 2009;301:1468–1474.
13. Kern MJ, Lerman A, Bech JW, De Bruyne
B, Eeckhout E, Fearon WF, Higano ST, Lim
MJ, Meuwissen M, Piek JJ, Pijls NH, Siebes
M, Spaan JA. Physiological assessment
of coronary artery disease in the cardiac
catheterization laboratory: a scientific
statement from the American Heart
Association Committee on Diagnostic and
Interventional Cardiac Catheterization,
176 Circulation Mai 2012

16:00:20:04:12
Page 177
Page 177
Council on Clinical Cardiology. Circulation.
2006;114:1321–1341.
14. Shufelt C, Kar S, Slivka M, Thomson L,
Yang Y, Berman D, Polk D, Tolstrup K,
Merz CB. Cardiac magnetic resonance
imaging and coronary reactivity testing: a
useful noninvasive tool. J Am Coll Cardiol.
2008;51:A231.
15. Ishimori ML, Martin R, Berman DS,
Goykhman P, Shaw LJ, Shufelt C, Slomka
PJ, Thomson LE, Schapira J, Yang Y,
Wallace DJ, Weisman MH, Bairey Merz
CN. Myocardial ischemia in the absence of
obstructive coronary artery disease in
systemic lupus erythematosus. JACC
Imaging. 2011;4:27–33.
16. Panting JR, Gatehouse PD, Yang GZ,
Grothues F, Firmin DN, Collins P, Pennell
DJ. Abnormal subendocardial perfusion
in cardiac syndrome X detected by cardio-
vascular magnetic resonance imaging.
N Engl J Med. 2002;346:1948–1953.
17. Fraker TD Jr, Fihn SD, Gibbons RJ,
Abrams J, Chatterjee K, Daley J, Deed-
wania PC, Douglas JS, Ferguson TB Jr,
Gardin JM, O’Rourke RA, Williams SV,
Smith SC Jr, Jacobs AK, Adams CD,
Anderson JL, Buller CE, Creager MA,
Ettinger SM, Halperin JL, Hunt SA,
Krumholz HM, Kushner FG, Lytle BW,
Nishimura R, Page RL, Riegel B, Tarking-
ton LG, Yancy CW. 2007 Chronic angina
focused update of the ACC/AHA 2002
guidelines for the management of patients
with chronic stable angina: a report of the
American College of Cardiology/American
Heart Association Task Force on Practice
Guidelines Writing Group to Develop the
Focused Update of the 2002 Guidelines for
the Management of Patients With Chronic
Stable Angina. Circulation. 2007;116:
2762–2772.
18. Anderson JL, Adams CD, Antman EM,
Bridges CR, Califf RM, Casey DE Jr,
Chavey WE 2nd, Fesmire FM, Hochman
JS, Levin TN, Lincoff AM, Peterson ED,
Theroux P, Wenger NK, Wright RS, Smith
SC Jr, Jacobs AK, Halperin JL, Hunt SA,
Krumholz HM, Kushner FG, Lytle BW,
Nishimura R, Ornato JP, Page RL, Riegel B.
ACC/AHA 2007 guidelines for the man-
agement of patients with unstable angina/
non-ST-elevation myocardial infarction: a
report of the American College of Cardi-
ology/ American Heart Association Task
Force on Practice Guidelines (writing com-
mittee to revise the 2002 guidelines for the
management of patients with unstable
angina/ non-ST-elevation myocardial
infarction): developed in collaboration with
the American College of Emergency
Physicians, the Society for Cardiovascular
Angiography and Interventions, and the
Society of Thoracic surgeons: endorsed by
the American Association of Cardio-
vascular and Pulmonary Rehabilitation
and the Society for Academic Emer-
gency Medicine. Circulation. 2007;116:
e148–e304.
19. Third report of the National Cholesterol
Education Program (NCEP) Expert Panel
on Detection, Evaluation, and Treatment
of High Blood Cholesterol in Adults
(Adult Treatment Panel III) final report.
Circulation. 2002;106: 3143–3421.
20. Mehta PK, Bairey Merz CN. Treatment of
angina in subjects with evidence of
myocardial ischemia and no obstructive
coronary artery disease. In: Bonow RO,
ed. Braunwald’s Heart Disease. 9th ed.
Philadelphia, PA: Elsevier; 2011.
Bairey Merz et Pepine Syndrome X cardiaque et dysfonction coronaire microvasculaire 177
1
/
5
100%