TS2014 - Devoir n°3

Terminale S www.sciencesphysiques.info
Devoir de Sciences Physiques n°3 : correction Page 1 / 3
Devoir de Sciences Physiques nÀ3 : correction
Exercice I
1.1 Les composés A et B ont tous deux pour formule brute C
8
H
10
O. Ce sont donc des isomères.
1.2
La molécule C est un aldéhyde : elle porte un groupe carbonyle.
La molécule D est acide carboxylique : elle porte un groupe carboxyle.
La molécule E est un ester : elle porte groupe caractéristique des ester.
2.1 Etude du spectre infrarouge de la molécule A :
(a) : la bande fine de forte intensité à 1600 cm
-1
correspond à la liaison O – H
libre
(b) : la bande de très faible intensité à 3050 cm
-1
correspond aux liaisons C
tri
– H du cycle.
(c) : la bande fine d’intensité moyenne à 3000 cm
-1
correspond aux liaisons C
tétra
– H
(d) : la bande fine à 1500 cm
-1
correspond aux liaisons doubles C = C du cycle aromatique.
2.2 Les signaux (a) et (g) représentent tous deux une liaison O – H mais dans la molécule A la liaison est
libre (bande fine à 3600 cm
-1
) alors que dans la molécule B elle est liée (bande large à 3300 cm
-1
). Cela est
dû aux interactions intermoléculaires dans le milieu d’étude : le spectre du composé A a été obtenu à partir
d’une solution diluée de A dans le tétrachlorométhane, ce qui rend les interactions entre molécules A peu
probables alors que le spectre du composé B a été obtenu à partir d’un film de B pur à l’état liquide où les
interactions entre molécules B sont très fortes (liaisons hydrogène).
2.4 Les deux constituants principaux du vin blanc sont l’eau (environ 88%) et l’éthanol environ (12%). La
formule semi-développée de l’éthanol est CH
3
– CH
2
– OH.
Les bandes caractéristiques de l’éthanol sont liquide sont donc : O – H
lié
, C – H et C – C.
2.5 Les bandes d’absorption de l’éthanol sont en partie les mêmes que celles de composés A et B, en
particulier la bande O – H
lié
qui sera large et intense puisqu’il y a liaisons hydrogène entre les molécules
d’éthanol et d’eau. Celle-ci va donc cacher celles des composés A et B et rendre l’observation de ces
molécules impossible sur un spectre IR.
3.1 Formule développée de la molécule B :
3.2 La molécule B est associée au document n°3 :
- Groupe de protons équivalents n°1 : pas de couplage,
on observe sur le spectre un singulet à 7,2 ppm (Ar-H)
- Groupe n°2 : ces protons équivalents ont deux protons
voisins d’où un triplet à 2,7 ppm (C-CH
2
-Ar)
- Groupe n°3 : ces protons ont 2 protons voisins, d’où un
triplet à 3,6 ppm (C-CH
2
-O-H)
- Proton n°4 : ce proton n’est pas couplé, d’où un singulet
à 2,0 ppm (R-OH)
1 2 3 4

Terminale S www.sciencesphysiques.info
Devoir de Sciences Physiques n°3 : correction Page 2 / 3
Exercice II
Partie A : mouvement d’un projectile dans un champ de pesanteur uniforme
A1/ Après largage par la fusée, le booster est soumis à la force d’attraction gravitationnelle exercée sur lui
par la Terre. Les frottements étant négligeables du fait de la très faible densité de l’atmosphère à cette
altitude, il n’est soumis qu’à cette force et sa chute est donc une « chute libre » tant qu’il n’atteint pas les
couches denses de l’atmosphère.
Remarque : il est impropre de parler ici de poids puisque le booster n’est plus au « voisinage de la Terre »
mais à une altitude de 53 km où l’intensité de la pesanteur ne vaut plus 9,8 m.s
-2
. Cela dit, on peut appliquer
la relation P = mg si l’on pense à recalculer la valeur de g à cette altitude (l’énoncé donne 9,6 m.s
-2
).
A2/ Deuxième loi de Newton :
amF
booster
ext
×=
∑
or gmFF
booster
ext
booster/Terre
×==
∑
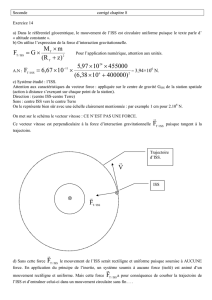
donc ga = Coordonnées du vecteur accélération : )g- ; 0( a
A3/ Vecteur vitesse du centre de gravité du booster : on intègre les coordonnées du vecteur accélération
(attention, l’angle de 63° est donné par rapport à la verticale donc v
0x
= v
0
× sin
α
et v
0z
= v
0
× cos
α
).
v
x
(t) = v
0
× sin
α
v
z
(t) = – g × t + v
0
× cos
α
A4/ Equations horaires du centre de gravité du booster : on intègre à nouveau.
tsinv)t(x
0
×α=
htcosvtg
2
1
)t(z
0
2
+×α+×
−
=
A5/ Au sommet de la trajectoire, la composante verticale de la vitesse du booster est nulle : v
z
(t
max
) = 0
On a donc : v
z
(t
max
) = – g × t
max
+ v
0
× cos α = 0 donc
g
cosv
t
0
max
α
=
Altitude correspondante : htcosvtg
2
1
)t(z
max0
2
maxmaxmax
+×α+×
−
=
h
g
cosv
cosv
g
cosv
g
21
)t(z
0
0
2
0
max
+
α
×α+
α
×
−
=
h
g2
cosv
h1
2
1
g
cosv
)t(z
22
0
22
0
max
+
α
=+
+−×
α
=
Application numérique : m 8900053400
6,92 )63(cos1820
)t(z
22
max
=+
×
×
= soit 89 km
Partie B : lois de Kepler et satellisation
B1/ Dans le repère de Frenet : N
)zR( mGm
F
2
T
PT
P/T
+
= (la force est attractive donc suivant N )
B2/ Le système étudié est le vaisseau Progress de masse m
P
soumis uniquement à l’attraction terrestre :
Deuxième loi de Newton : amF
P
ext
×=
∑
or N
)zR( mGm
F F
2
T
PT
P/Text
+
==
∑
et
N
zR v
a
T
2
+
=
d’où zRv
m
)zR( mGm
T
2
P
2
T
PT
+
×=
+ et donc
2
T
T
v
zR
Gm =
+
L’expression de la vitesse orbitale est :
zR
Gm
v
T
T
+
=

Terminale S www.sciencesphysiques.info
Devoir de Sciences Physiques n°3 : correction Page 3 / 3
Application numérique :
1
33
2411
s.m 7710
10.33410.6380 10.98,510.67,6
v
−
−
=
+
×
= soit 7,71 km/s
C1/ Quantité de mouvement d’un système ponctuel de masse m et de vitesse vectorielle
v : vmp ×=
C2/ Lorsqu’un système est isolé, c’est-à-dire que la somme des forces extérieures agissant sur lui est nulle, la
quantité de matière du système est constante en direction, sens et norme :
0F
ext
=
∑
or
dt
pd
dt
)vm(d
dt
vd
mamF
ext
==×=×=
∑
donc 0
dt
pd = et ctep =
C3/ Il y a deux manières de traiter cette question :
- soit l’on se place dans un référentiel lié au centre d’inertie du système {ISS + Progress + carburant} :
la quantité de mouvement du système est alors nulle.
- soit on se place dans le référentiel géocentrique et on travaille non pas sur la quantité de mouvement
mais sur les variations de la quantité de mouvement.
Le système {ISS + Progress + carburant} est en orbite circulaire uniforme autour de la Terre donc son
vecteur vitesse et par conséquent son vecteur quantité de mouvement sont tangentiels à sa trajectoire. Le
système n’est soumis qu’à une seule force, l’attraction gravitationnelle, or celle-ci est radiale et centripète,
donc n’a pas de composante tangentielle. En appliquant le principe d’inertie suivant un axe tangentiel à la
trajectoire, le système est donc isolé et sa quantité de mouvement totale constante. On a donc :
éjectés gaz)ogressPrISS()carburantogressPrISS(
ppp += +++
On considère enfin que la masse de gaz éjectés est égale à la masse de carburant (+ comburant pour être
précis) embarquée d’après la loi de conservation de la matière lors d’une réaction chimique.
Première méthode : on considère un référentiel lié au centre de gravité du système {ISS + Progress +
carburant}. Dans ce référentiel, le système est immobile. On a alors :
0p
)carburantogressPrISS(
=
++ et donc 0pp
éjectés gaz)ogressPrISS(
=+
+
d’où
éjectés gaz
éjectés gaz
ogressPrISS
PISS
vm v)mm( ×−=×+ + et
éjectés gaz
PISS
éjectés gaz
ogressPrISS
v
mm
m
v×
+
−
=
+
Application numérique :
1
3
3
éjectés gaz
PISS
éjectés gaz
ogressPrISS
s.m 293300
10.42610.8,3
v
mm
m
v−
+=×=×
+
=
Deuxième méthode : on travaille dans le référentiel géocentrique sur les variations de la quantité de
mouvement : la vitesse initiale du système n’est alors pas connue.
cteppp
éjectés gazogressPrISScarburantogressPrISS
=+= +++ donc 0ppp
éjectés gazogressPrISScarburantogressPrISS
=∆+∆=∆ +++
d’où
éjectés gazogressPrISS
pp ∆−=∆ + et
éjectés gaz
éjectés gaz
ogressPrISS
PISS
vm v)mm( ∆×−=∆×+ +
On arrive à :
éjectés gaz
PISS
éjectés gaz
ogressPrISS
v
mm
m
v∆×
+
−
=∆ +
Application numérique :
1
3
3
éjectés gaz
PISS
éjectés gaz
ogressPrISS
s.m 293300
10.42610.8,3
v
mm
m
v−
+=×=∆×
+
=∆
C4/ L’énoncé dit que le vaisseau Progress doit accélérer la station de 25 m.s-1 or il dispose de suffisamment
de carburant pour l’accélérer de 29 m.s-1 donc l’opération de remorquage peut être réalisée sans consommer
tout le carburant. Il doit rester un peu de carburant au vaisseau pour ensuite, une fois décroché de la station,
ralentir et maitriser sa propre rentrée dans l’atmosphère.
1
/
3
100%