C1 15-16

Épreuve de CHIMIE
1/2
Nom :
No:
Contrôle 1, Novembre 2015
Classe : 2de A – B – C
Durée : 50 min
L’usage d’une calculatrice non programmable est permis
Ce sujet comporte 2 pages numérotées 1/2 et 2/2
Données :
- Masse d’un nucléon : mnucléon = 1,67 x 10 - 27 Kg
- Charge élémentaire : e = 1,6 x 10 - 19 C
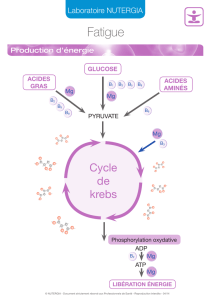
Premier exercice (10 points)
Atome ou ion
On se propose d’identifier deux entités chimiques X et Y en exploitant, les informations des
documents ci-dessous.
Document 1 : L’entité chimique X Document 2 : L’entité chimique Y
Document 3: Les éléments de transition
1. Identification de l’entité X
1.1 Déterminer le numéro atomique de X.
1.2 Préciser si cette entité chimique est un atome ou un ion.
1.3 En déduire sa formule.
1.4 Justifier, que l’entité X possède 30 neutrons.
2. Identification de l’entité Y
2.1 Vérifier, si les deux entités X et Y appartiennent à un même élément. Nommer cet élément.
2.2 Y est un ion de formule Yn+. Déterminer n.
2.3 Considérer chacune des affirmations suivantes et préciser si elle est correcte ou non.
a. X et Y possèdent le même nombre d’électrons.
b. X et Y sont des cations.
c. La charge du nuage électronique de chacune des entités, X et Y, est la même.
- Masse de X: m(X) = 9,352 x 10 - 26 Kg
- Charge du noyau de X : q1= 4,16 x 10 - 18 C
- X contient 24 électrons dans son nuage
électronique.
- Charge du noyau de Y : q2= 4,16 x 10 - 18 C
- Charge du nuage électronique de Y :
q3= - 3,68 x 10 - 18 C
Les éléments de transition représentent une large fraction de la classification périodique. Ils
constituent essentiellement le bloc d.
Parmi ces éléments, on cite : Vanadium, V (Z = 23) ; Chrome, Cr (Z = 24) ; Fer, Fe (Z = 26)

2/2
Deuxième exercice (6 points)
Le magnésium
Un manque de magnésium peut provoquer des crampes, un état dépressif …
Le chocolat, riche en magnésium a la réputation d’être un bon antistress, s’il est consommé avec
modération !
Le numéro atomique du magnésium est 12.
Il existe dans la nature trois isotopes stables du magnésium : 24Mg, 25Mg et 26Mg.
1. Rappeler la définition des atomes isotopes.
2. Ecrire la configuration électronique de l’atome de magnésium.
3. Préciser la position de l’élément magnésium dans le tableau périodique.
4. Le magnésium est assimilé par notre organisme sous forme ionique.
Donner la formule de l’ion magnésium.
5. Pour pallier des carences en magnésium graves, on peut administrer à un patient, par injection
intraveineuse, du chlorure de magnésium composé d’ions chlorure et d’ions magnésium.
L’ion chlorure porte une charge égale à – e.
5.1 Nommer la famille du tableau périodique à laquelle appartient l’élément chlore.
5.2 Justifier la charge que portent les éléments de cette famille.
5.3 Choisir parmi ces trois formules, MgCl, MgCl2et Mg2Cl, celle qui correspond au chlorure de
magnésium. Justifier votre choix.
Troisième exercice (4 points)
Au laboratoire de chimie …
1. Nommer la verrerie schématisée ci-dessous.
2. Schématiser une pipette jaugée.
3. Donner les risques et les précautions à prendre lors de la manipulation d’un produit chimique
portant le pictogramme suivant :
1
/
2
100%