Travail II de Chimie générale 1ère année d`études de Bachelier en

Nom : Décembre 2011
Prénom :
Section :
Travail II de Chimie générale
1ère année d’études de Bachelier en Sciences
Consignes :
Ce travail doit être rendu le lundi 9 janvier 2012, entre 10h30 et 14H, bureau 1.92,
B6a
Indiquez votre nom et votre prénom sur chacune des feuilles de réponse et agrafez
ces feuilles.
Veillez à ce que vos réponses soient claires et lisibles.
Ressources à exploiter :
Cours de Chimie Générale, Professeur Cloots.
Répétitions de Chimie Générale relatives au cours du Professeur Cloots.
Formulaire de Chimie Générale relatif au cours du Professeur Cloots.
J. W. Hill, R.H. Petrucci, T.W. McCreary, S.S. Perry, Chimie Générale, Erpi, 2ème
Ed.
J.W. Hill, R.H. Petrucci, T.W. McCreary, S.S. Perry, Chimie des solutions, Erpi.
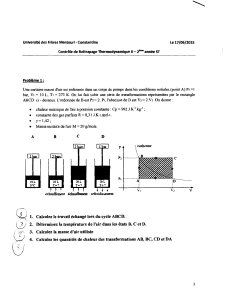
Question 1 : Cinétique chimique – 17 pts
Soit la réaction élémentaire ci-dessous entre le 2-bromooctane et l’ion OH- (hydroxyde de
potassium):
C6H13-CH-Br + OH- → C6H13-CH-OH + Br-
│ │
CH3 CH3
On réalise une étude cinétique de la réaction à 25°C pour des concentrations initiales en 2-
bromooctane et en ion hydroxyde de 0,5 M.
Après 1000 s, la concentration en Br- est de 0,202 M.
a) Qu’est-ce qu’une réaction élémentaire ? Pourquoi est-il important de préciser que la
réaction étudiée est une réaction élémentaire ?
b) Etablissez la loi de vitesse.
c) La loi de vitesse étant toujours exprimée par rapport aux concentrations des réactifs, il
faut veiller à transformer les quantités de produits formés en quantités de réactifs
restants. Complétez donc le tableau ci-dessous (cfr exercice 2c)).
2-bromooctane +
OH- ↔
Octan-2-ol +
Br-
Nombre de
moles (par L)
initial
Nombre de
moles (par L)
après 1000 s

Nom : Décembre 2011
Prénom :
Section :
d) Calculez alors, à partir de la loi de vitesse établie en b) et des concentrations en
réactifs calculées en c), la valeur de la constante de vitesse à 25°C.
e) Quelle autre méthode peut également être utilisée pour obtenir la valeur de k ?
Décrivez-la en quelques mots.
f) Si l’on est parti d’un volume de 200 mL de mélange réactionnel, quel est le nombre de
moles d’octan-2-ol produit après 2h de réaction à 25°C ?
g) On a trouvé qu’un catalyseur adéquat permettrait de réduire de 10% la valeur de
l’énergie d’activation (Ea = 83,7 kJ/mol). Par quel facteur la vitesse de réaction serait-
elle multipliée dans ces conditions ?
Question 2 : Equilibres chimiques – 20 pts
On chauffe à 627°C, dans un ballon de 0,472 dm3, 0,631 g de phosgène, COCl2 qui se
dissocie partiellement en CO et Cl2 selon l’équation :
COCl2 (g)
⇌
CO (g) + Cl2 (g)
Lorsque l’équilibre est établi, le nombre de moles de COCl2 dans le ballon est de 0,77.10-3
moles.
1) Calculez la constante d’équilibre Kc de cette réaction (travaillez avec les nombres de
moles et les concentrations molaires).
2) A partir de la valeur de Kc obtenue en 1), déterminez la valeur de la constante
d’équilibre Kp.
3) Calculez également la valeur de Kp à partir des pressions partielles des différents
constituants à l’équilibre et comparez la valeur obtenue avec celle calculée en 2).
4) Déterminez quelles sont les pressions partielles des différents gaz présents à
l’équilibre si on introduit 0,02 moles de COCl2 et 0,01 moles de Cl2 dans un ballon de
1 dm3 et qu’on laisse l’équilibre s’établir à la même température, à savoir 627°C.
5) Dans quel sens évoluerait la réaction si le système contenait initialement 0,2 atm de
COCl2, 0,3 atm de CO et 0,3 atm de Cl2 à la température de 627°C? Justifiez votre
réponse par le calcul du quotient réactionnel Q.
6) On introduit maintenant 0,1 mol d’argon (gaz inerte, c’est-à-dire pas de réaction) dans
le système à l’équilibre en maintenant le volume constant. L’équilibre sera-t-il
déplacé ? Si oui, dans quel sens ? Appliquez ici le principe de Le Chatelier.
7) La réaction de décomposition du phosgène étant endothermique, une élévation de
température déplacera-t-elle l’équilibre vers la gauche ou vers la droite ? Justifiez
votre réponse.
Question 3 : Equilibres de solubilité – 10 pts
En ajoutant 100 mL d’une solution de chlorure de sodium 1.10-3 M à 100 mL d’une solution
1.10-2 M en nitrate d’argent et 1.10-4 M en nitrate de plomb (II), on observe l’apparition d’un
précipité.
Données : Kps (Chlorure d’argent) = 10-9,75 M2 ; Kps (Chlorure de plomb (II)) = 10-4,8 M3
1) Donnez les écritures ioniques des deux réactions de précipitation hypothétiques, sur
base de la table de solubilité dans l’eau des principaux sels et hydroxydes.

Nom : Décembre 2011
Prénom :
Section :
2) Lequel des deux composés peu solubles va effectivement précipiter ? Justifiez votre
réponse par le calcul de Q.
3) Calculez la solubilité de ce composé dans l’eau pure. Exprimez cette grandeur en
mol/L et en g/L.
4) A partir de la valeur de la solubilité obtenue en 3), calculez le volume minimum d’eau
nécessaire pour dissoudre totalement 0,4 mg de ce composé ?
5) Que deviendrait la solubilité de ce même composé dans une solution 0,001 mol/L en
chlorure de potassium ? Justifiez votre réponse
a. sur base du principe de Le Châtelier.
b. par calcul de la solubilité s’ en mol/L.
Question 4 : Equilibres acide-base – solutions tampons – 10 pts
On dispose de 100 mL d’une solution d’acide acétique 0,2 M. On désire préparer une
solution tampon de pH = 4,6 à 25°C.
1) Quelle est la composition générale d’une solution tampon ?
2) Quelle est la propriété chimique caractéristique des solutions tampons ?
3) A l’aide de quelle équation peut-on calculer le pH d’une solution tampon ? Précisez
les conditions d’applicabilité de cette formule.
4) Pour préparer la solution tampon dont il est question, on dispose d’acétate de sodium
solide. Quelle quantité en grammes d’acétate de sodium devra-t-on dissoudre dans la
solution d’acide acétique ? (on considère que la dissolution du solide ne modifie pas le
volume de la solution).
5) On peut également préparer la solution tampon en formant l’ion acétate dans la
solution suite à la réaction entre l’acide acétique et NaOH ajouté. Quel volume d’une
solution de NaOH 2 M faudra-t-il ajouter à la solution d’acide acétique de départ ?
Question 5 : Equilibres acide-base – 12 pts
On titre 20 mL d’acide hypochloreux HClO 0,02 M par une solution d’hydroxyde de
potassium 0,01 M.
1) Ecrivez l’équation de la réaction de neutralisation sur laquelle repose ce titrage.
2) Relevez les valeurs de : la concentration en acide Ca, le volume d’acide titré Va et la
concentration en base Cb. Calculez alors le volume de base ajouté au point équivalent
Vb,éq.
3) Calculez également le nombre de moles d’acide dans l’échantillon titré, na.
4) Dessinez l’allure théorique de la courbe de titrage. Indiquez sur chaque zone de cette
courbe la nature des espèces présentes :
1ère zone : Vb = 0 mL
2ème zone : 0 < Vb < Vb,éq
3ème zone : Vb = Vb,éq
4ème zone : Vb > Vb,éq
5) Calculez le pH de la solution après ajout de 0 mL, 10 mL, 20 mL, 40 mL et 80 mL de
NaOH, en suivant la méthode ci-dessous :

Nom : Décembre 2011
Prénom :
Section :
Acide + Base → ……………. + ……………
Ca = ……. Cb = ..……
Va = …….
→ na = …….
Vb = …..
na
nb ajoutées
n
Temps initial
Ca . Va
Cb . Vb
0
Après réaction
1
/
4
100%