Exercice 2 : Satellites

Exercice 1 : MOUVEMENTS PLANS
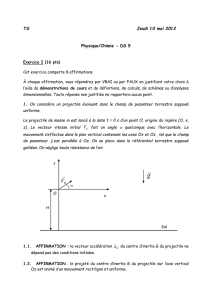
1. On considère un projectile évoluant dans le champ de pesanteur terrestre supposé uniforme.
Le projectile de masse m est lancé à la date t = 0 s d’un point O, origine du repère (O, x, z). Le vecteur
vitesse initial
0
V
fait un angle
quelconque avec l’horizontale. Le mouvement s’effectue dans le plan
vertical contenant les axes Ox et Oz , tel que le champ de pesanteur
g
est parallèle à Oz. On se place dans
le référentiel terrestre supposé galiléen. On néglige toute résistance de l’air.
1.1. AFFIRMATION : le vecteur accélération
G
a
du centre d’inertie G du projectile ne dépend pas des
conditions initiales.
1.2. AFFIRMATION : le projeté du centre d’inertie G du projectile sur l’axe vertical Oz est animé d’un
mouvement rectiligne et uniforme.
1.3. AFFIRMATION : dans le cas où le projectile est lancé d’une hauteur H au dessus du sol avec une
vitesse
0
V
horizontale, l’abscisse de son point de chute est x =
g
H
V2
0
On rappelle qu’à t = 0 s, le projectile est en O, origine du repère.
Exercice 2 : Satellites
On considère un satellite artificiel soumis uniquement à la force
gravitationnelle de la Terre. Le satellite de masse m, situé à
l’altitude h par rapport au sol terrestre est animé d’un mouvement
circulaire et uniforme à la vitesse V. On se place dans le référentiel
géocentrique supposé galiléen.
On donne :
le rayon de la Terre : RT = 6380 km
la masse de la Terre : MT = 5,98
1024 kg
la constante de gravitation universelle : G = 6,67
10 -11 S.I.
2.1. AFFIRMATION : la constante de gravitation universelle G s’exprime en m.s-2.
2.2. AFFIRMATION : le vecteur accélération
G
a
du centre d’inertie du satellite est centripète.
z
x
O
Sol
H
g
0
V
Terre
Satellite
h
RT

2.3. AFFIRMATION : la vitesse du satellite est donnée par la relation V =
)( hR
GM
T
T
2.4. AFFIRMATION : à l’altitude h = 12 800 km, la période de révolution du satellite vaut 2,64104 s
EXERCICE 3 : Energie dans un circuit RLC
On a réalisé le montage ci-dessous avec les composants suivants : un conducteur ohmique de résistance
R = 4,0102 , une bobine d’inductance L = 0,40 H (résistance interne de la bobine négligée) et un
condensateur de capacité C = 1,0. 10-6 F.
On charge le condensateur,
commutateur basculé en position
1, puis, à l’instant de date t0 = 0, le
commutateur est basculé en
position 2.
Les points A, B et M sont reliés
à un ordinateur ou à un système
d’acquisition. Grâce à un
logiciel adapté on observe
l’évolution des tensions au
cours du temps (schéma ci-
après).
1. A propos des courbes
La courbe 1 visualisée est :
a. la tension aux bornes
du condensateur
b. la tension aux bornes
du conducteur ohmique
c. la tension aux bornes de la bobine
La courbe 2 visualisée est :
d. la tension aux bornes de la bobine
e. la tension aux bornes du conducteur ohmique
2. A propos des énergies
A l’instant initial le circuit RLC a emmagasiné une énergie E1 de :
a. 8,0 mJ b. 8,0. 10-6 J c. 2,0. 10-6 J
3. Lorsque les deux courbes se coupent pour la première fois, la valeur de l’intensité du courant vaut :
a. 5,0 mA; b. 7,7 mA c. 4,2 mA
4. Lorsque les deux courbes se coupent pour la première fois, la somme des énergies emmagasinée dans la
bobine et dans le condensateur notée E2 est :
a. 7,0. 10-6 J b. 5,0. 10-6 J c. 2,0. 10-6 J
5. Lorsque les deux courbes se coupent pour la première fois, l’énergie qui a été dissipée dans la résistance
vaut : a. 3,0. 10-6 J b. 1,0. 10-3 J c. 10 mJ
On donne le graphe représentant en fonction du temps l’énergie cinétique et l’énergie potentielle élastique
d’un système solide–ressort horizontal, écarté de sa position d’équilibre, lâché sans vitesse initiale à l’instant
t = 0 s et à l’abscisse x0.
A
1 2
R
M
B
L
C
E = 4,0 V
commutateur
i

L’origine des abscisses correspond à la position d’équilibre du système.
1. La courbe correspondant à l’énergie cinétique est représentée en trait plein.
2. On suppose que l’énergie potentielle de pesanteur est nulle au niveau horizontal où se situe le
système. Le système de masse m, comporte un ressort de raideur k.
L’expression de l’énergie mécanique du système est donnée par l’expression :
2
0
2
1kxEm
3. L’allure des courbes permet d’affirmer qu’il n’y a pas de frottements.
EXERCICE 4 : énergie dans une pile
On dispose d’une solution de nitrate d’argent Ag+(aq) + NO3-(aq) de concentration 0,10 mol.L-1, d’une solution
de sulfate de cuivre de concentration 0,50 mol.L-1, d’un fil d’argent, d’une lame de cuivre et d’un pont salin
au nitrate de potassium.
On peut former une pile par l’association des couples Ag+(aq) / Ag(s) et Cu2+(aq) / Cu(s).
Soit l’équation de réaction : 2 Ag+(aq) + Cu(s) = 2 Ag(s) + Cu2+(aq)
La constante d’équilibre est K = 2,0.1015.
1. On relie les deux métaux constituant les bornes de la pile par une chaîne conductrice, le quotient de
réaction initial de ce système, pour l’équation donnée est :
a) Qr, i = 50, alors la réaction est spontanée dans le sens direct.
b) Qr, i = 50, alors la réaction est spontanée dans le sens inverse.
c) Qr, i = 0,02, alors la réaction est spontanée dans le sens direct.
d) Qr, i = 0,02, alors la réaction est spontanée dans le sens inverse.
2. Lorsque cette pile fonctionne (ou débite) son quotient de réaction :
a) augmente.
b) diminue.
c) ne varie pas.
3. Quel est le pôle négatif de la pile :
a) l’électrode d’argent ?
b) l’électrode de cuivre ?
Une pile de ce type a une f.é.m. E = 2,0 V ; elle est prévue pour fonctionner pendant 10 h si elle débite de
manière constante un courant d’intensité 320 mA.
Données : 1 F = 9,65.104 C.mol-1
1. L’énergie maximale disponible de cette pile est égale à :
a) 11,5 J ;
b) 1,15.104 J ;
c) 2,30.104 J.

2. La quantité d’électrons qui circulent pendant la durée totale du fonctionnement est égale à :
a) 0,12 mol ;
b) 1,0 mol ;
c) 2,0 mol.
Exercice 5 Propagation d'une onde.
On fixe un vibreur à l'extrémité d'une corde tendue. Une onde sinusoïdale de fréquence f = 25 Hz se
propage le long de la corde. Le milieu n'est pas dispersif.
Affirmation 1 : l'onde est transversale.
Affirmation 2 : la célérité de l'onde est v = 20 m.s-1.
Affirmation 3 : la célérité de l'onde dépend de la fréquence de la source.
Affirmation 4 : au moment de la prise de vue, le point M descend.
Dans un milieu non dispersif, une onde rectiligne sinusoïdale traverse une fente dont la largeur, fixe, est de
l'ordre de grandeur de la longueur d'onde.
Affirmation 5 : le phénomène de diffraction est d'autant plus marqué que la fréquence de l'onde est grande.
Exercice 6 Radioactivité.
Le graphe ci-contre (figure 2) représente l'évolution
temporelle de l'activité A d'un échantillon de radon
222.
Affirmation 6 : la demi-vie du radon 222 est :
t1/2 = 5,5 jours
Affirmation 7 : à l'instant de date t = 1,0 jour, il reste
environ 2,4 108 noyaux de radon 222 dans
l'échantillon.
Exercice 7 Évolution des systèmes électriques RC et RL
• La résistance du circuit de la figure 3 est réglable. Le générateur
délivre une tension constante E = 6,0 V. Le condensateur a une capacité
C = 1,0 µF
Un système d'acquisition permet d'enregistrer l'évolution
de la tension aux bornes du condensateur en fonction du
temps (figure 4).
À l'instant de date t = 0 s, on ferme l'interrupteur.
Affirmation 8 : à l'instant de date t = 0 s, le
condensateur est déchargé.
Affirmation 9 : en régime permanent l'intensité du
courant qui circule dans le circuit est nulle.

Affirmation 10 : pour obtenir la courbe 1, il faut donner à la résistance la valeur R = 2,0 k.
Affirmation 11 : pour passer de la courbe 1 à la courbe 2, il suffit de diminuer la valeur de la résistance.
• La résistance du circuit de la figure 5 est réglable. Le générateur
délivre une tension constante E = 6,0 V. La bobine a une résistance
interne négligeable devant R et une inductance L.
Un système d'acquisition permet d'enregistrer l'évolution au cours du
temps de l'une des tensions indiquées sur le schéma.
A l'instant de date t = 0 s, on ferme l'interrupteur.
Affirmation 12 : l'intensité du courant qui circule dans le
circuit vérifie l'équation différentielle : i –
L di E
R dt
Affirmation 13 : la courbe de la figure 6 représente la
tension aux bornes du conducteur ohmique.
Exercice 8. Évolution des systèmes chimiques.
• La courbe l de la figure 7 représente
l'évolution au cours du temps de l'avancement
de la réaction entre une mole d'acide
éthanoïque et une mole d'éthanol à
100°C sans catalyseur. La réaction conduit
à un équilibre chimique.
Affirmation 14 : à l'instant de date t = 0 h,
la vitesse de la réaction est nulle.
Affirmation 15 : une élévation de température
du milieu réactionnel modifie
la vitesse de réaction.
Affirmation 16 : la vitesse de la réaction
diminue au cours du temps.
Affirmation 17 : l'ajout d'un catalyseur
dans le milieu réactionnel permet d'obtenir
la courbe 2.
On étudie la réaction d'oxydation de
l'acide oxalique HOOC-COOH (solution
incolore) par l'ion permanganate
MnO
4
(aq) en milieu acide (solution de
couleur violette). Le suivi de la réaction
est réalisé par un enregistrement
spectrophotométrique. La transformation
est totale. Parmi tous les réactifs et
produits présents dans le milieu
réactionnel, seul l'ion permanganate est
coloré et absorbe à la longueur d'onde
choisie. L'évolution de l'absorbance du
milieu réactionnel en fonction du temps est donnée sur le graphe ci-contre (figure 8).
Affirmation 18 : l'ion permanganate n'est pas le réactif limitant.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%






![Exercice 1 [Bac Liban 2016] : Solution page 1 Un automate peut se](http://s1.studylibfr.com/store/data/001876471_1-aac3bd8ca65b5f5251c8e166c1447a0c-300x300.png)