Cours

THEME 2 - ACIDES ET BASES DANS LES MILIEUX BIOLOGIQUES
Pour simplifier, on peut le représenter par
1.11. La partie 2 de l’ion carboxylate est-elle hydrophile ou hydrophobe ?
1.12. Parmi les schémas suivants, choisir le schéma correct en justifiant brièvement la réponse.
1. La saponification.
( )
1.13. Considérons une salissure grasse à la surface d’un tissu plongé dans une solution d’eau savonneuse. Indiquer sur votre copie le
numéro du schéma correct. Justifier votre réponse par une phrase.
On prépare au laboratoire un savon à partir de 20,0 g d’un triglycéride et d’un volume V = 40,0 mL d’une solution d’hydroxyde de
sodium (Na+, OH-) de concentration C = 10,0 mol/L.
L’équation de la réaction peut s’écrire
C57H110O6 + 3 (Na+, HO-) 3 CH3 - (CH2)16 - COO- , Na+ + C3H8O3
Triglycéride Hydroxyde de sodium Savon Glycérol
1.1. Donner le nom de la réaction entre le triglycéride et la soude.
1.2. Quelles sont ses caractéristiques ?
1.3. Pour synthétiser un savon au lycée, il faut utiliser le montage donné en Annexe (à coller). Indiquer le nom d’un tel montage. Quel
est son intéret ?
1.4. Nommer la partie située dans le rectangle en pointillé du montage et préciser son rôle.
1.5. Donner la formule semi-développée du glycérol
1.6. Calculer la quantité de matière du triglycéride introduit. Donnée M(Triglycéride) = 890 g/mol.
1.7. Recopier puis compléter la phrase suivante en indiquant les valeurs manquantes et les noms des espèces chimiques.
«1 mole de triglycéride nécessite ............... moles d’hydroxyde de sodium pour former ......... moles de ...................... et 1 mole de ..............»
1.8. En déduire la quantité de matière n(Savon) de savon qui se forme.
1.9. Calculer la masse de savon correspondante. Donnée M(Savon) = 306,5 g/mol.
Le savon a pour formule CH3 - (CH2)16 - COO-, Na+
1.10. Indiquer lequel des deux ions est l’ion carboxylate.
On peut représenter schématiquement l’ion carboxylate du savon de la façon suivante:
1.14. Dans une maison, l’eau du robinet est qualifiée de dure. Que peut-on dire de l’efficacité du savon avec cette eau ?
2. Acide faible et base faible en solution.
On dispose d’une bouteille d’eau minérale. Le pH de l’eau minérale indiqué sur l’étiquette de la bouteille est 6,3.
2.1. Cette eau minérale est-elle acide, basique ou neutre ? Justifier votre réponse.
2.2. Comment peut-on déterminer la valeur du pH d’une solution ?
2.3. Montrer que la concentration en ion oxonium [H3O+] de cette eau minérale est voisine de 5,0 x 10-7 mol/L.
2.4. Calculer la quantité de matière d’ions oxonium n(H3O+) contenue dans cette bouteille de volume V = 1,5 L.

2.5. Entourer puis nommer les deux groupes caractéristiques présents dans la formule de l’acide lactique.
2.6. Déterminer la formule brute de l’acide lactique et montrer que sa masse molaire moléculaire est égale à 90 g/mol.
Données masses molaires atomiques: M(H) = 1 g/mol M(C) = 12 g/mol M(O) = 16 g/mol
2.7. Donner la définition d’un acide et d’une base selon Brönsted, en vous aidant du couple acide lactique / ion lactate.
2.8. Dans le couple H3O+ / H2O, l’eau est-elle considérée comme un acide ou une base ? Justifier votre réponse.
2.9. En déduire l’équation-bilan de la réaction acide-basique de l’acide lactique avec l’eau.
2.10. Donner l’expression de la constante d’acidité du couple acide lactique / ion lactate.
2.11. Le pKa de ce couple est 3,9. Représenter sur un axe gradué en pH, le diagramme de prédominance de l’acide lactique et de l’ion
lactate.
2.12. Le pH du verre qui contient le lait est égal à 11. En s’aidant du diagramme précédemment tracé, nommer l’espèce qui prédomine
dans le verre de lait. Justifier.
3. Titrage pHmétrique
Une bouteille de lait présente dans un réfrigérateur a été ouverte il y a quelques jours. Afin de savoir si le lait est toujours frais, un
chimiste décide de doser l’acide lactique présent. Le chimiste prélève un volumeVA = 20,0 mL de lait qu’il dose par une solution
d’hydroyde de sodium (Na+, HO-), solution appelée aussi soude, de concentration CB = 5,0 x 10-2 mol/L.
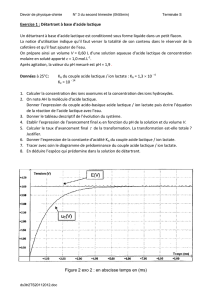
L’évolution du pH en fonction du volume VB de soude versé est présentée dans la figure (voir question 3.3.).
L’équation de la réaction acido-basique qui a lieu au cours du dosage est la suivante
acide lactique + OH-ion lactate + H2O
Pour procéder au dosage, on utilise le matériel suivant: une pipette jaugée, un bécher, un pH-mètre, une burette, un agitateur magnéti-
que.
3.1. Faire le montage du dispositif.
3.2. Quelle est la solution à introduire initialement dans le bécher ? A quoi sert la pipette jaugée ?
3.3. Coller les courbes proposées. Parmi celles-ci, quelle est celle qui correspond au titrage étudié ?
3.4. Coller la courbe de pHmétrie. La décrire. Donner la valeur initiale du pH du lait.
3.5. Définir l’équivalence acido-basique et montrer qu’à l’équivalence on peut écrire CA x VA = CB x VBE.
3.6. Vérifier que le volume de soude versé à l’équivalence VBE est égal à 12,0 mL. Faire apparaître la méthode graphique employée.
3.7. On aurait pu également utiliser un indicateur coloré pour déterminer
l’équivalence. Définir la notion d’indicateur coloré. Expliquer la méthode.
Quel indicateur coloré allez-vous choisir ? Justifier la réponse.
3.8. Le volume de soude versé à l’équivalence VBE est donc égal à 12,0 mL.
En déduire que la concentration molaire en acide lactique dans le lait est égale à
CA = 0,030 mol/L.
3.9. Calculer la concentration massique Cmassique en acide lactique.
Cmassique
On rappelle la relation: Cmolaire = avec Cmolaire en mol/L Cmassique en g/L M en g/mol
M
3.10. En déduire la masse d’acide lactique présente dans un litre de lait.
3.11. Un lait est considéré comme frais lorsque la masse d’acide lactique est inférieure à 1,8 g par litre de lait. Ce lait est-il frais ? Justifier.
On dispose d’une bouteille de lait. Le lait contient de l’acide lactique de formule semi-développée:
Zone de virage de quelques indicateurs colorés
Petit exercice pour voir si j’ai compris:
Sur l’étiquette d’une bouteille de soda on peut lire entre autres: conservateur: benzoate de sodium. L’ion benzoate a pour formule
C6H5COO- et fait partie du couple acide benzoïque/ion benzoate.
a. L’ion benzoate est-il une base ou un acide ?
b. Le pKa du couple acide benzoïque/ion benzoate est 4,2. Représenter sur un axe gradué en pH, le diagramme de prédominance de
l’acide benzoïque et de l’ion benzoate.
c. Le pH de l’estomac est égal à 2. En s’aidant du diagramme précédemment tracé, dire ce qu’il advient de l’ion benzoate lorsqu’on
avale le soda. Reste-t-il sous forme d’ion benzoate ou se transforme-t-il en acide benzoïque ? Justifier.
1
/
2
100%