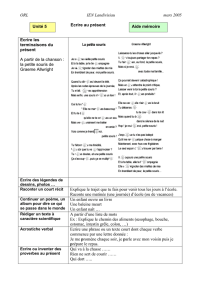
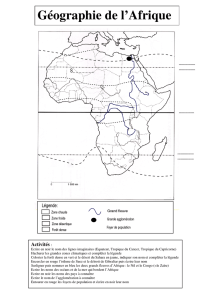
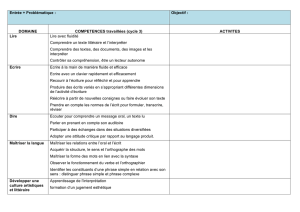
EXAMEN DE MATURITA

PROBLEME
GROUPES CARACTERISTIQUES
Réaction 1 :
Dans un ballon on chauffe un volume de VET = 100 mL d’éthanol. En absence d’air, on fait passer
les vapeurs obtenues sur du cuivre maintenu vers 250°C. On obtient deux produits A et B.
A donne un test positif avec la 2,4 – DNPH. B est un gaz dont la combustion, parfois explosive,
fournit de l’eau.
1. A quelle famille appartient le composé organique A obtenu par la réaction ? Justifier. Ecrire sa
formule semi-développée et le nommer.
2. Quel est le rôle du cuivre dans cette réaction ? Quel est l’impact de son action sur la réaction ?
3. En utilisant les formules semi-développées, écrire l’équation de la réaction 1. De quel type de
réaction chimique s’agit-il ?
4. Calculer la quantité initiale nETi d’éthanol utilisé dans la réaction 1.
5. Lorsque tout l’éthanol a réagi, calculer la masse de A obtenue ainsi que le volume du gaz B
dégagé.
L’éthanol réagit avec une solution acidifiée de permanganate de potassium. Lorsque l’oxydant est
en défaut on obtient le produit A et lorsqu’il est en excès, on obtient le produit C qui ne réagit pas
avec la 2,4 – DNPH ni avec la liqueur de Fehling.
6. Identifier le produit C. A quelle famille de composés appartient-il ? Ecrire sa formule semi-
développée et le nommer.
7. Ecrire les demi-équations d’oxydoréduction et l’équation de la transformation de l’éthanol en C.
Pour le permanganate de potassium le couple oxydant-réducteur est
2
4/MnMnO
.
Réaction 2 :
Dans un ballon on chauffe une masse mD = 3,0 g d’un alcool D de formule brute C3H8O. On fait
passer les vapeurs de cet alcool dans un tube qui contient de l’alumine (Al2O3) à 450°C.
A la sortie du tube on récupère de la vapeur d’eau et un hydrocarbure gazeux E qui décolore l’eau
de brome.
8. Ecrire l’équation de la réaction 2 en utilisant les formules brutes.
9. De quel type de réaction chimique s’agit-il et quel est le rôle de l’alumine ?
10. A quelle famille de composés organiques appartient le produit organique E obtenu ? Ecrire sa
formule semi-développée et le nommer.
11. Ecrire toutes les formules semi-développées possibles pour D.
12. La réaction de l’alcool D avec C donne de l’éthanoate de propyle. Ecrire la formule semi-
développée de cet ester. Identifier alors l’alcool D et le nommer.
13. Calculer la quantité initiale niD d’alcool utilisé dans la réaction 2.
14. Calculer la masse d’eau et le volume de E formés au cours de la réaction 2.
Données :
Masses molaires (en g.mol-1) : MH = 1, MC = 12, MO = 16
Volume molaire à 20°C : Vm = 24 L.mol-1
Masse volumique de l’éthanol à 20°C : ρET = 800 kg.m-3
1
/
1
100%