Combustions – Transformations chimiques

4ème CORRECTION
Chimie Devoir 2 – a
EXERCICE I
1. Définitions :
Un réactif est une substance chimique qui disparaît au cours d'une transformation chimique.
Un produit est une substance chimique qui apparaît au cours d'une transformation chimique.
Un comburant est une substance chimique qui permet à un combustible de brûler (l'exemple le plus courant étant le dioxygène de
l'air).
Un combustible est la substance chimique qui brûle lors d'une combustion.
2. Une combustion est incomplète si le comburant n'est pas en quantité suffisante pour que l'ensemble du combustible brûle de
manière correcte. Il se forme alors des produits de combustion qui sont encore combustibles. Par exemple, lors de la combustion
incomplète du butane, il se forme du carbone (dépôt noir sur la coupelle posée sur la flamme) et du monoxyde de carbone.
3. Une transformation est physique si les substances changent d'état (passage de l'état solide à l'état liquide, dissolution par exemple).
Il n'y a pas alors production de nouvelles substances.
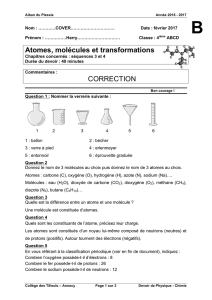
4. a – Vrai b – Faux c – Faux d – Faux
EXERCICE II
2 H + Cl2 2 HCl 2 Al + 2 Cl2 Al2Cl4
Cu + O2 CuO2C5H12 + 8 O2 5 CO2 + 6 H2O
2 NO + O2 2 NO22 Cu + 2 Al2O3 4 Al + Cu2O6
C4H8 + 4 O2 4 CO + 4 H2O C2H4 + 3 O2 2 CO2 + 2 H2O
Cr2O3 + 2 Al 2 Cr + Al2O3
Exercice III
1. Bilan de la transformation chimique :
Méthane + dioxygène Dioxyde de carbone + Eau
2. Voir schéma ci-contre.
3. Les formules chimiques des molécules intervenant dans
cette transformation sont CH4 pour le méthane, O2 pour le
dioygène, CO2 pour le dioxyde de carbone et H2O pour
l'eau.
4. Dans la molécule de méthane de formule CH4, on a un
atome de carbone de symbole C et quatre atomes
d'hydrogène de symbole H ; dans la molécule de dioxygène
de formule O2, on a deux atomes d'oxygène de symbole O ;
dans la molécule de dioxyde de carbone de formule CO2 , on
a un atome de carbone de symbole C et deux atomes d'oxygène de symbole O ; dans la molécule d'eau de formule H2O, on a deux
atomes d'hydrogène de symbole H et un atome d'oxygène de symbole O.
5. 1 CH4 + 2 O2 1 CO2 + 2 H2O
6. D'après l'équation bilan équilibrée, il faut deux molécules de dioxygène pour faire réagir une molécule de méthane. C'est ce
qu'indique les coefficients de l'équation bilan (une molécule de méthane réagit avec deux molécules de dioxygène pour donner
une molécule de dioxyde de carbone et deux molécules d'eau).
7. Si on fait réagir 5 molécules de méthane et 10 molécules de dioxygène, on aura assez de dioxygène pour faire réagir les 5
molécules de méthane. On obtiendra donc 5 molécules de dioxyde de carbone (
5×1
) et 10 molécules (
5×2
) d'eau.
Par contre, en n'apportant que 8 molécules de dioxygène, on ne pourra faire réagir que 4 molécules de méthane (une pour deux
molécules de dioxygène), on n'obtiendra donc uniquement 4 molécules de dioxyde de carbone et 8 molécules d'eau. Il restera une
molécule de méthane qui n'aura pas réagi.
8. Le principe de conservation de la masse lors d'une transformation chimique nous permet d'écrire :
mbutane mdioxygène = mdioxydede carbone meau
.
Nous pouvons donc en déduire la première ligne puisque
Pour les autres lignes, il faut se servir des relations de proportionnalité qui existent.
Ainsi, entre la ligne 1 et la ligne 2, il y a un facteur 1/5. On passe en effet, en multipliant par 1/5, de 30 à 6, de 112 à 22,4. Il suffit
de faire de même pour la masse du dioxyde de carbone (88/5) et celle de l'eau (54/5).
Entre la ligne 1 et la ligne 3, le coefficient de proportionnalité sera 1/2 (56 / 112) et entre la ligne 1 et 4, il sera de 0,06 (1,8 / 30).
Masse de butane
(en gramme)
Masse de dioxygène
(en gramme)
Masse de dioxyde de carbone
(en gramme)
Masse d'eau
(en gramme)
30 112 88 54
6 = 30/5 22,4 = 112 / 5 88/5 = 17,6 54/5 = 10,8
30/2 = 15 56 = 112 / 2 44 = 88 / 2 54/2 = 27
1,8 = 30 * 0,06 112 * 0,06 = 6,72 88 * 0,06 = 5,28 54 * 0,06 = 3,24
Téléchargé sur http://gwenaelm.free.fr/gest2classe
COMBUSTIONS – TRANSFORMATIONS
CHIMIQUES
mdioxydede carbone = mbutane mdioxygène − meau = 30112−54 = 88g.
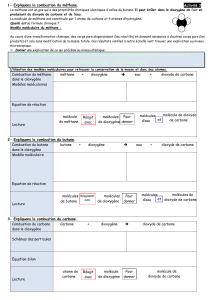
Méthane en
combustion
Sulfate de
cuivre anhydre
Sulfate de
cuivre hydraté
Eau de chaux
troublée
Aspiration
1
/
1
100%