Mentions légales

MENTIONS LEGALES QUTENZA (Août 2015)
N° ML Qutenza 2015-1
DÉNOMINATION DU MÉDICAMENT : Qutenza 179 mg patch cutané.
COMPOSITION QUALITATIVE ET QUANTITATIVE : Chaque patch cutané de 280 cm2
contient au total 179 mg de capsaïcine, soit 640 microgrammes de capsaïcine par cm2 de patch.
Excipient à effet notoire : Chaque tube de 50 g de gel nettoyant pour Qutenza contient 0,2 mg/g de
butylhydroxyanisole (E320). Pour la liste complète des excipients, voir rubrique « Liste des
excipients ». FORME PHARMACEUTIQUE : Patch cutané. Chaque patch mesure 14 cm x 20 cm
(280 cm2) et comprend une face adhésive contenant la substance active et une couche de support
constituant la face externe. La face adhésive est couverte d’un film de protection détachable,
transparent, sans impression et coupé en diagonale. Sur la face externe de la couche de support est
imprimé « capsaicin 8 % ». DONNÉES CLINIQUES : Indications thérapeutiques : Qutenza est
indiqué pour le traitement des douleurs neuropathiques périphériques chez les adultes, seul ou en
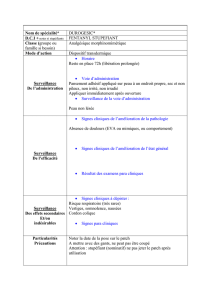
association avec d’autres médicaments antidouleur. Posologie et mode d’administration : Le patch
cutané Qutenza doit être appliqué par un médecin ou un professionnel de santé sous la supervision
d’un médecin. Posologie : Qutenza doit être appliqué sur les zones cutanées les plus douloureuses (en
utilisant jusqu’à 4 patchs au maximum). La zone douloureuse doit être déterminée par le médecin et
délimitée par un marquage sur la peau. Qutenza doit être appliqué sur une peau intacte, non irritée et
sèche, et laissé en place pendant 30 minutes pour les pieds (p. ex. en cas de neuropathie associée au
VIH ou NA-VIH, de neuropathie diabétique douloureuse) et 60 minutes pour d’autres endroits du
corps (p. ex. pour la douleur post-zostérienne ou DPZ). Les applications de Qutenza peuvent être
répétées tous les 90 jours, si la douleur persiste ou apparaît de nouveau. La zone d’application peut
être prétraitée par un anesthésique topique ou le patient peut recevoir un antalgique par voie orale
avant l’application de Qutenza pour réduire la gêne potentielle liée à la procédure. L’anesthésique
topique doit être appliqué de façon à couvrir la totalité de la zone à traiter par Qutenza et à la dépasser
de 1 à 2 cm. L’anesthésique topique ou l’antalgique par voie orale doit être utilisé en respectant les
instructions d’utilisation du médicament. Dans les essais cliniques, les patients ont été prétraités par la
lidocaïne à 4%, la lidocaïne/prilocaïne (2,5/2,5%) topique ou par 50 mg de tramadol. La crème
anesthésiante doit être retirée avant l’application de Qutenza et la peau soigneusement lavée et séchée.
Insuffisance rénale et/ou hépatique : Aucun ajustement posologique n’est nécessaire chez les patients
souffrant d’insuffisance rénale ou hépatique. Population pédiatrique : La sécurité et l’efficacité de
Qutenza chez les enfants, de la naissance jusqu’à l’âge de 18 ans n’ont pas été établies. Aucune
donnée n’est disponible. Mode d’administration : Usage cutané uniquement. Précautions à prendre
avant la manipulation ou l’administration du médicament : Il faut porter des gants en nitrile lors de
chaque manipulation de Qutenza et lors du nettoyage des zones traitées. NE PAS utiliser des gants en
latex car ils n’assurent pas une protection suffisante. Le port d’un masque et de lunettes de protection
est recommandé, en particulier lors de l’application et du retrait du patch. Ces précautions doivent être
prises pour éviter de toucher involontairement les patchs et les autres matériels qui sont entrés en
contact avec les zones traitées. Une exposition accidentelle peut entraîner, de façon transitoire,
érythème et sensation de brûlure (les muqueuses étant particulièrement sensibles), douleur oculaire,
irritation des yeux et de la gorge et toux. Les patchs ne doivent pas être placés près des yeux et des
muqueuses. Si nécessaire, les poils couvrant la zone à traiter doivent être coupés ras, pour favoriser
l’adhérence du patch (ne pas les raser). Les zones à traiter doivent être lavées doucement avec de l’eau
et du savon. Une fois les poils coupés et la peau lavée, celle-ci doit être soigneusement séchée. Mode
d’emploi : Qutenza est un patch à usage unique et peut être coupé aux dimensions et à la forme de la
zone à traiter. Il faut couper Qutenza avant de retirer le film de protection. Ce dernier DOIT être
enlevé JUSTE AVANT l’application. Le film de protection est coupé en diagonale pour pouvoir être
retiré facilement. Une partie du film de protection doit être décollée et pliée et la face adhésive du
patch imprimé placée sur la zone à traiter. Le patch doit être maintenu en place. Le film de protection
est ensuite décollé par en dessous lentement et avec précaution d’une main, pendant que le patch est
simultanément lissé sur la peau de l’autre main pour assurer un contact parfait entre le patch et la peau,
sans bulles d’air ni humidité. Pour le traitement des pieds, les patchs Qutenza peuvent être enveloppés
autour des faces dorsales, latérales et plantaires de chaque pied afin de recouvrir complètement la zone
à traiter. Pour s’assurer que Qutenza reste en contact avec la zone à traiter, on peut utiliser des
chaussettes extensibles ou une bande de gaze. Les patchs Qutenza doivent être retirés doucement et
lentement en les enroulant vers l’intérieur pour minimiser le risque d’aérosolisation de la capsaïcine.

MENTIONS LEGALES QUTENZA (Août 2015)
N° ML Qutenza 2015-1
Après le retrait de Qutenza, du gel nettoyant doit être appliqué généreusement sur la zone traitée et
laissé en place pendant au moins une minute. Il doit ensuite être essuyé avec une compresse sèche,
pour éliminer toute trace de capsaïcine de la peau. Une fois le gel nettoyant essuyé, la zone traitée doit
être lavée doucement avec de l’eau et du savon. La douleur aiguë pendant et après l’application doit
être traitée par des méthodes de refroidissement local (par exemple par application d’une compresse
froide) et des antalgiques par voie orale (p. ex., opiacés d’action rapide). Pour les instructions
concernant la manipulation et l’élimination des matériels utilisés lors de l’application, voir la rubrique
« Précautions particulières d’élimination et manipulation ».
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la
rubrique « Liste des excipients ». Mises en garde spéciales et précautions d’emploi : Les
professionnels de santé doivent porter des gants en nitrile lorsqu’ils manipulent les patchs et nettoient
les zones traitées (voir rubrique « Posologie et mode d’administration »). Il est conseillé d’administrer
Qutenza dans une zone de soin correctement ventilée. Evaluation cutanée : Qutenza ne doit être utilisé
que sur une peau sèche et intacte (non lésée) et jamais sur le visage, ni au-dessus de la limite du cuir
chevelu, et ni à proximité des muqueuses. Chez les patients atteints de neuropathie diabétique
douloureuse, un examen visuel minutieux des pieds doit être réalisé avant chaque application de
Qutenza et lors des visites cliniques ultérieures en vue de détecter d’éventuelles lésions cutanés liées à
une neuropathie sous-jacente et à une insuffisance vasculaire. Fonction sensorielle : Des réductions de
la fonction sensorielle ont été rapportées suite à l’administration de Qutenza. Les diminutions des
fonctions sensorielles sont généralement mineures et temporaires (incluant stimuli thermiques et
mécaniques), cependant, un seul cas d’hypoesthésie persistante a été rapporté dans les études cliniques
des neuropathies diabétiques douloureuses. Pour ce cas un lien avec Qutenza ne peut être exclu. Une
prudence est recommandée chez les patients dont la sensibilité est réduite au niveau des pieds et chez
ceux présentant un risque accru de modifications de la fonction sensorielle. Tous les patients
présentant des déficits sensoriels pré-existants doivent être évalués sur le plan clinique en vue de
détecter une perte sensorielle avant chaque application de Qutenza. Si une perte sensorielle est
détectée ou s’aggrave, le traitement par Qutenza doit être reconsidéré. Surveillance et prise en charge
des réactions au site d’application : Les réactions locales et transitoires au niveau du site d’application,
tels que brûlure, douleur, érythème et prurit sont fréquentes voire très fréquentes. De plus, des cas de
brûlures, y compris des brûlures au second degré ont été rapportés chez des patients traités avec des
patchs de capsaïcine. Voir rubrique « Effets indésirables ». Chez les patients présentant une douleur
intense, le patch doit être retiré et la peau examinée pour s’assurer de l’absence de brûlure chimique.
Exposition involontaire : Si Qutenza entre en contact avec une zone cutanée qui ne doit pas être
traitée, il faut appliquer du gel nettoyant pendant une minute et l’essuyer avec une compresse sèche
pour enlever toute trace de capsaïcine de la surface de la peau. Une fois le gel nettoyant retiré, la zone
doit être lavée doucement avec de l’eau et du savon. En cas de brûlure des yeux, de la peau ou des
voies respiratoires, le sujet doit être éloigné de Qutenza. Les yeux ou les muqueuses doivent être
rincés ou lavés à l’eau. Des soins médicaux appropriés doivent être dispensés en cas de dyspnée.
Augmentation de la pression artérielle : L’intensification de la douleur liée au traitement peut induire
des augmentations passagères de la pression artérielle (en moyenne < 8,0 mm Hg) pendant et juste
après l’application de Qutenza. La pression artérielle doit être surveillée pendant la procédure de
traitement. Pour les patients souffrant d’une hypertension artérielle instable ou mal contrôlée ou ayant
un antécédent de maladie cardiovasculaire, le risque d’événements indésirables cardiovasculaires dus
au stress potentiel de la procédure doit être pris en considération avant de commencer le traitement par
Qutenza. Une attention particulière doit être apportée aux patients diabétiques présentant des
comorbidités telles que : maladie coronarienne, hypertension et neuropathie autonome
cardiovasculaire (NAC). Gêne liée au traitement : Les patients souffrant de douleurs pendant et après
l’application du patch doivent recevoir un traitement de soutien tel qu’un refroidissement local ou des
antalgiques par voie orale (c’est-à-dire des opiacés d’action rapide). Les patients prenant de fortes
doses d’opiacés peuvent ne pas répondre à des antalgiques opiacés par voie orale lorsqu’ils sont
utilisés pour soulager la douleur aiguë pendant et après la procédure de traitement. Il convient
d’examiner minutieusement les antécédents du patient avant de commencer le traitement et de mettre
en place une stratégie alternative de réduction de la douleur avant de traiter par Qutenza les patients
chez lesquels une forte tolérance aux opiacés est suspectée. Gel nettoyant : Le gel nettoyant pour

MENTIONS LEGALES QUTENZA (Août 2015)
N° ML Qutenza 2015-1
Qutenza contient du butylhydroxyanisole pouvant provoquer des réactions cutanées locales (telles
qu’une dermatite de contact) ou une irritation des yeux et des muqueuses.
Interactions avec d’autres médicaments et autres formes d’interactions : Aucune étude formelle
d’interactions avec d’autres médicaments n’a été réalisée, car il a été montré que Qutenza ne donne
lieu qu’à de faibles niveaux transitoires d’absorption systémique. Fertilité, grossesse et allaitement :
Grossesse : Il n’existe pas de données ou il existe des données limitées sur l’utilisation de la capsaïcine
chez la femme enceinte. Au vu des propriétés pharmacocinétiques chez l’homme, qui montrent une
faible exposition systémique transitoire à la capsaïcine, la probabilité que Qutenza augmente le risque
d’anomalies du développement lorsqu’il est administré à des femmes enceintes est très faible.
Toutefois, Qutenza ne sera prescrit qu'avec prudence chez la femme enceinte. Allaitement : On ne sait
pas si la capsaïcine/métabolites sont excrétés dans le lait maternel humain. Les données
pharmacodynamiques/toxicologiques disponibles chez l’animal ont mis en évidence l’excrétion de la
capsaïcine/métabolites dans le lait (voir rubrique « Données de sécurité préclinique »). Un risque pour
les nouveaux-nés/nourrissons ne peut être exclu. L’allaitement doit être interrompu au cours du
traitement avec Qutenza. Fertilité : Aucune donnée n’est disponible sur la fertilité chez l’Homme. Une
étude de toxicité sur la reproduction chez le rat a montré une diminution du nombre et du pourcentage
de spermatozoïdes mobiles et du nombre de gestations (voir rubrique « Données de sécurité
préclinique » ). Effets sur l’aptitude à conduire des véhicules et à utiliser des machines : Qutenza
n’a aucun effet ou qu’un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des
machines. Effets indésirables : Résumé du profil de tolérance : Sur 1826 patients traités par Qutenza
dans des essais randomisés et contrôlés, 1089 (59 ,6 %) ont signalé des effets indésirables considérés
par l’investigateur comme étant liés au médicament. Les effets indésirables les plus fréquemment
rapportés étaient une sensation de brûlure, une douleur, un érythème et un prurit, locaux et transitoires
au niveau du site d’application. Les effets indésirables ont été transitoires, ils ont disparu,
spontanément et ont été généralement d’intensité légère à modérée. Dans tous les essais contrôlés, le
taux de patients ayant arrêté prématurément le traitement en raison d’effets indésirables a été de
2,0% chez les patients traités par Qutenza et de 0,9 % chez les patients traités dans le groupe témoin .
Liste tabulée des effets indésirables : Dans le tableau 1 ci-dessous, tous les effets indésirables survenus
avec une fréquence supérieure à celle observée dans le groupe témoin et chez plus d’un patient dans
les essais cliniques contrôlés menés chez des patients souffrant de douleur post-zostérienne (DPZ), de
neuropathie associée au Virus de l’Immunodéficience Humaine (NA-VIH) et de neuropathie
diabétique douloureuse, sont énumérés par classe de système d’organes et par fréquence : très fréquent
(≥ 1/10), fréquent (≥ 1/100, < 1/10) et peu fréquent (≥ 1/1000, < 1/100) et fréquence indéterminée (ne
peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les
effets indésirables sont présentés suivant un ordre décroissant de gravité. Tableau 1 : Liste tabulée
des effets indésirables
Classe de systèmes d’organes et
fréquence
Effet indésirable
Infections et infestations
Peu fréquent
Zona
Affections du système nerveux
Fréquent
Sensation de brûlure
Peu fréquent
Dysgueusie, hypoesthésie,
Affections oculaires
Peu fréquent
Irritation oculaire
Affections cardiaques
Peu fréquent
Bloc auriculo-ventriculaire (AV) du premier degré, tachycardie,
palpitations
Affections vasculaires
Peu fréquent
Hypertension artérielle
Affections respiratoires,
thoraciques et médiastinales
Peu fréquent
Toux, irritation pharyngée
Affections gastro-intestinales

MENTIONS LEGALES QUTENZA (Août 2015)
N° ML Qutenza 2015-1
Peu fréquent
Nausées
Affections de la peau et du tissu
sous-cutané
Peu fréquent
Prurit
Affections musculo-squelettiques
et systémiques
Fréquent
Douleurs des extrémités
Peu fréquent
Spasmes musculaires
Troubles généraux et anomalies
au site d'administration
Très fréquent
Douleur au site d’application, érythème au site d’application
Fréquent
Prurit au site d’application, papules au site d’application, vésicules au site
d’application, œdème au site d’application, gonflement au site
d’application, sécheresse au site d’application
Peu fréquent
Urticaire au site d’application, paresthésie au site d’application, dermatite
au site d’application, hyperesthésie au site d’application, inflammation au
site d’application, réaction au site d’application, irritation au site
d’application, contusion au site d’application, œdème périphérique
Investigations
Peu fréquent
Augmentation de la pression artérielle
Lésions, intoxications et
complications liées aux
procédures
Fréquence indéterminée Brûlures au second degré, exposition accidentelle (comprenant douleur
oculaire, irritation des yeux et de la gorge et toux)
Description d’autres effets indésirables : Temporairement, des réductions mineures de la détection de
la chaleur (1°C à 2°C) et de la sensibilité aux objets pointus ont été décelées au niveau du site
d’application de Qutenza dans des essais cliniques menés chez des volontaires sains. Déclaration des
effets indésirables suspectés : La déclaration des effets indésirables suspectés après autorisation du
médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du
médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système
national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (Ansm)
et réseau des Centres Régionaux de Pharmacovigilance. Site internet : www.ansm.sante.fr.
Surdosage : Aucun cas de surdosage n’a été rapporté. Qutenza doit être administré par un médecin ou
sous la supervision d’un médecin. Par conséquent, il est improbable qu’un surdosage se produise. Le
surdosage peut être associé à des réactions sévères au niveau du site d’application, par exemple une
douleur, un érythème, un prurit au site d’application. En cas de suspicion de surdosage, il faut retirer
doucement le patch, appliquer du gel nettoyant pendant une minute, puis l’essuyer avec une compresse
sèche et laver doucement la zone traitée avec de l’eau et du savon. Des traitements d’appoint doivent
être mis en place s’ils sont cliniquement nécessaires. Il n’y a pas d’antidote à la capsaïcine.
PROPRIETES PHARMACOLOGIQUES : Propriétés pharmacodynamiques : Classe
pharmacothérapeutique : Anesthésiques, autres anesthésiques locaux, Code ATC : N01BX04.
Mécanisme d’action : La capsaïcine ou 6-nonénamide, N-[(4-hydroxy-3-méthoxyphényl)méthyl]-8-
méthyl, (6E), est un agoniste hautement sélectif du récepteur vanilloïde 1 à potentiel de récepteur
transitoire (TRPV1, transient receptor potential vanilloid 1). L’effet initial de la capsaïcine est
l’activation de nocicepteurs cutanés exprimant le TRPV1, à l’origine du piquant et de l’érythème dus à
la libération de neuropeptides vasoactifs. Effets pharmacodynamiques : Suite à une exposition à la
capsaïcine, les nocicepteurs cutanés deviennent moins sensibles à divers stimuli. Ces effets retardés de
la capsaïcine sont fréquemment appelés « désensibilisation » et sont supposés être à l’origine du
soulagement de la douleur. La sensibilité des nerfs cutanés qui n’expriment pas le TRPV1 est censée
rester inchangée, notamment la capacité à détecter des stimuli mécaniques et vibratoires. Les
modifications induites par la capsaïcine au niveau des nocicepteurs cutanés sont réversibles et il a été
rapporté et observé que la fonction normale (la détection de sensations nocives) se rétablit en quelques
semaines chez les volontaires sains. Efficacité et sécurité cliniques : L’efficacité d’une application

MENTIONS LEGALES QUTENZA (Août 2015)
N° ML Qutenza 2015-1
unique de Qutenza pendant 30 minutes sur les pieds a été démontrée dans des essais cliniques
contrôlés menés chez des patients souffrant de neuropathie associée au Virus de l’Immunodéficience
Humaine (NA-VIH) et de neuropathie diabétique douloureuse. L’efficacité d’une application unique
de Qutenza pendant 60 minutes au niveau des autres zones que les pieds a été démontrée dans des
essais cliniques contrôlés menés chez des patients souffrant de douleur post-zostérienne (DPZ). Le
soulagement de la douleur a été observé la première semaine pour la DPZ, la deuxième semaine pour
la NA-VIH et la troisième semaine pour la neuropathie diabétique douloureuse. Pour les trois
étiologies, l’efficacité a été maintenue pendant toute la durée de l’étude de 12 semaines. En ce qui
concerne la neuropathie diabétique douloureuse, une efficacité constante reproductible a été démontrée
avec des traitements répétés sur une période de 52 semaines. Le profil de sécurité de Qutenza chez les
patients diabétiques correspondait à celui observé dans la population non diabétique. Qutenza s’est
avéré efficace lorsqu’il était utilisé seul ou en association avec des médicaments à visée systémique
pour les douleurs neuropathiques. Propriétés pharmacocinétiques : La capsaïcine contenue dans
Qutenza est destinée à être libérée dans la peau. Des données in vitro (expériences de dissolution de la
substance active et de perméation cutanée) démontrent que la vitesse de libération de la capsaïcine de
Qutenza est linéaire pendant le temps d’application. Sur la base d’études in vitro, il est estimé
qu’environ 1 % de la capsaïcine est absorbé par l’épiderme et le derme pendant des applications d’une
durée d’une heure. La quantité de capsaïcine libérée par le patch par heure étant proportionnelle à la
surface d’application, cela représente une dose totale maximale possible estimée à environ 7 mg pour
une surface d’application de 1000 cm2. En supposant qu’une surface de patch de 1000 cm2 libère
environ 1 % de capsaïcine à une personne de 60 kg, l’exposition maximale potentielle à la capsaïcine
est approximativement de 0,12 mg/kg, une fois tous les trois mois. Selon le Comité Scientifique de
l'Alimentation de la Commission Européenne, en Europe l’ingestion moyenne de capsaïcine est de
1,5 mg/jour (0,025 mg/kg/jour pour une personne de 60 kg) et le niveau d’exposition alimentaire le
plus élevé est de 25 à 200 mg/jour (jusqu’à 3,3 mg/kg/jour pour une personne de 60 kg). Des données
pharmacocinétiques chez l’homme ont montré une exposition systémique transitoire et faible
(< 5 ng/ml) à la capsaïcine chez près d’un tiers des patients souffrant de DPZ, chez 3% des patients
souffrant de neuropathie diabétique douloureuse et chez aucun patient souffrant de NA-VIH, après des
applications de Qutenza d’une durée de 60 minutes. Aucune donnée n’est disponible pour les
traitements d’une durée de 30 minutes. En général, le pourcentage de patients souffrant de DPZ ayant
une exposition systémique à la capsaïcine a augmenté avec des surfaces de traitement plus étendues et
des durées de traitement plus longues. La concentration de capsaïcine la plus élevée détectée chez des
patients traités pendant 60 minutes a été de 4,6 ng/ml et elle a été atteinte immédiatement après le
retrait de Qutenza. La plupart des taux quantifiables ont été observés au moment du retrait de Qutenza,
avec une nette tendance à disparaître dans les 3 à 6 heures suivantes. Aucun taux détectable de
métabolites n’a été observé chez aucun des sujets. Une analyse de la pharmacocinétique de population
de patients traités pendant 60 et 90 minutes a indiqué que les taux plasmatiques de capsaïcine
atteignaient un pic à peu près 20 minutes après le retrait de Qutenza et qu’ils diminuaient très
rapidement, avec une demi-vie d’élimination moyenne d’environ 130 minutes. Données de sécurité
préclinique : Les données non cliniques issues des études conventionnelles de pharmacologie de
sécurité, de toxicologie en administration unique et de toxicologie en administration répétée, n’ont pas
révélé de risque particulier pour l’homme. Les études de génotoxicité réalisées avec la capsaïcine ont
montré une faible réponse mutagène dans le test du lymphome de souris et des réponses négatives
dans le test d’Ames, le test du micronoyau chez la souris et le test d’aberrations chromosomiques
réalisé sur des lymphocytes de sang humain périphérique. Une étude de cancérogenèse réalisée chez la
souris indique que la capsaïcine n’est pas cancérogène. Une étude de toxicologie de la reproduction
menée chez le rat a montré une diminution statistiquement significative du nombre et du pourcentage
de spermatozoïdes mobiles chez des rats ayant reçu un traitement pendant 3 heures/jour, commencé 28
jours avant la cohabitation, poursuivi pendant la cohabitation et jusqu’au jour précédant le sacrifice.
Bien qu’ils ne soient ni statistiquement significatifs ni dose-dépendants, l’indice de fertilité et le
nombre de gestations par rapport au nombre de rats en cohabitation ont diminué dans tous les groupes
traités par la capsaïcine. Une étude de tératologie conduite chez le lapin n’a montré aucun potentiel de
toxicité embryofoetale. Des retards d’ossification du squelette (diminutions du nombre de métatarsiens
ossifiés) ont été observés dans une étude tératologique chez le rat à des niveaux de doses supérieurs
aux niveaux thérapeutiques utilisés chez l’homme ; la signification de ce résultat pour l’homme n’est
 6
6
1
/
6
100%