p2-ue5-ranouil-physiologie_cardiaque-25-10-16-pdf

1/25
UE5 - Ranouil
Physiologie cardiaque
Date :25/10/1016
Promo :2016/2017 16h15-18h15
Ronéistes : Dr.RANOUIL
LAMY Pierre
MARBOIS Simon
I. Automatisme cardiaque et tissu nodal
1. Généralités
2. Rappel anatomique
3. Electrophysiologie du tissu nodal
4. Propagation
5. Régulation
6. Electrophysiologie des myocytes
7. Conclusion
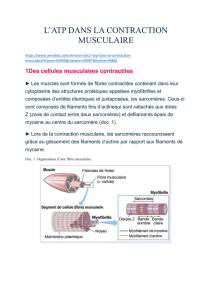
II. Coupla ge excitation-contraction
1. Généralités
2. Histologie
3. Propagation du PA
4. Couplage
5. Contraction
6. Relaxation
7. Régulation
8. Conclusion
III. Sources d'énergie du muscle cardiaque/myocarde
1. Généralités
2. Les substrats
3. Les mitochondries
4. Le cycle de Krebs
5. La chaine respiratoire
6. Conclusion
IV. Annales

2/25
I. Automatisme cardiaque et tissu nodal
1. Généralités
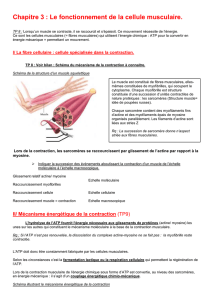
Le cœur est un muscle automatique, c’est-à-dire il se contracte tout seul.
Cet automatisme est lié à la présence de cellules aux propriétés spécifiques regroupées au sein d’un tissu : le
tissu nodal qui donne au cœur la caractéristique de se contracter spontanément.
Le cœur est donc constitué de deux populations cellulaires :
– les myocytes contractiles, assurant le travail mécanique et donnant l’énergie nécessaire à la propulsion du
sang.
– les myocytes automatiques, assurant l’automatisme cardiaque (moins nombreuses).
2. Rappel anatomique
Le tissu nodal comprend :
- Le nœud sinusal (situé dans la partie haute de l’OD au pied de la VCS) qui a une taille d’environ
15mm de long sur 8mm de diamètre se contractant à l’environ de 100 batt/min et donnant la cadence
au cœur.
- Le nœud auriculo ventriculaire (situé à la jonction des oreillettes et des ventricules, près de la valve
tricuspide dans la partie basse du septum Interventriculaire sur le versant droit) avec une fréquence
de 60-70 batt/min.
En raison de son emplacement, on peut accéder à sa physiologie en mettant des sondes dans la cavité
droite par exemple.
- Le faisceau de His dont le tronc chemine dans le septum IV et se divise en deux branches : droite et
gauche. Il faut savoir que le ventricule gauche est plus important, il occupe 2/3 de l’espace
ventriculaire total. Donc la branche gauche va encore se subdiviser en 2 hémi-branches : la première
branche est pour le bloc antérieur (HBAG pour hémi-branche antérieure gauche) et la seconde est
pour le bloc postérieur (HBPG pour hémi-branche postérieure gauche).
- Le réseau de Purkinje complète le maillage en s’enfonçant dans l’épaisseur du myocarde
ventriculaire de façon à amener l’activité électrique au plus près des cellules de l’ensemble du muscle
cardiaque en particulier pour les cellules des ventricules qui assurent l’essentielle de l’activité
musculaire cardiaque.
3. Electrophysiologie du tissu nodal
La fréquence de dépolarisation du NS est de 100 battements/min.
Le nœud AV a une fréquence de dépolarisation plus lente 60-70 battements/min. Cette fréquence est définie
en partie par la génétique. Il joue un rôle de frein à l’activité du NS.
En situation normale le NS impose sa fréquence à l’ensemble du cœur car il est situé plus en hauteur, les
autres éléments s’y adaptent.
Le faisceau de His et le réseau de Purkinje assurent une conduction rapide de la dépolarisation à l’ensemble
du myocarde ventriculaire à la vitesse d’au moins 1 m/s.
Les cellules sont chargées négativement, cette charge se traduit par une différence de potentiel (DDP) entre
l’intérieur et l’extérieur de la cellule de -70 à -90mv.
Cette DDP est liée à des échanges de Na+, K+, Cl-, Ca2+ permanents, par des phénomènes passifs (gradient
de concentration) mais aussi actifs avec des pompes échangeuses d’ions qui fonctionnent grâce à l’énergie
fournie par l’ATP. C’est une forme d’équilibre instable qui permet aux cellules à un moment donné d’être
dans un état excitable.

3/25
Les cellules du NS ont une dépolarisation automatique spontanément (sans influx initiateur), ces propriétés
s’expliquent par une courbe de potentiel de membrane particulière.
Le potentiel de repos est instable spontanément, il oscille entre -90 mV et -70 mV (pas horizontale mais
légèrement ascendant sur un graphe). A partir de la valeur la plus négative du potentiel de membrane
(appelé potentiel diastolique maximal), la cellule se dépolarise lentement jusqu’à un certain seuil (= pente
diastolique), niveau à partir duquel la dépolarisation va être brutale.
Cette propriété de dépolarisation spontanée et permanente est liée à la présence d’un canal particulier appelé
canal if ou funny échangeur de Na+, pour l’entrée de Na+ dans la cellule. Ce canal est inhibé par le césium
et certaines molécules comme l’Ivabradine. Ces molécules sont utilisées pour ralentir la fréquence
cardiaque en modifiant la vitesse de dépolarisation spontanée du NS dont les cellules seront moins vite
dépolarisées. Ce ralentissement permet de diminuer la consommation en oxygène du myocarde ce qui peut
avoir un intérêt dans certaines pathologies comme les cardiopathies.
Comme le potentiel de repos est instable il va augmenter progressivement et lorsqu’il atteint le potentiel
seuil, puis sous l’action de ce canal funny, il y a ouverture de canaux calciques voltages dépendants (ne
s’ouvre qu’à partir d’une certaine valeur du potentiel) et une entrée massive de Ca2+ dans la cellule ce qui
entraine une dépolarisation rapide de la cellule.
Ainsi, on observe un potentiel d’action réel de la cellule avec une entrée de Ca2+ puis le Na+ ce qui entraine
une dépolarisation de la cellule qui était majoritairement négative et qui devient donc positive.
Les cellules du tissu nodal ne présentent pas de phase de plateau, la repolarisation débute dès le pic atteint et
correspond au retour à l'état de départ par sortie du K+ de la cellule, la cellule retrouve alors son potentiel de
membrane de départ (potentiel diastolique maximal) et peut donc débuter un nouveau cycle.

4/25
On a :
- le potentiel diastolique maximum qui correspond à l'état de base de la cellule instable,
- puis la dépolarisation lente instable qui est spécifique aux cellules du nœud sinusal avec une pente liée aux
canaux if,
- puis le seuil est franchi donc on a une ouverture des canaux calciques et sodiques et la genèse d'un potentiel
d'action permettant à la cellule de devenir fortement positive,
- puis absence de plateau, on a la repolarisation avec une sortie de K+ permettant à la cellule de revenir à son
potentiel diastolique maximum pour recommencer un cycle.
.
Donc la cellule va se dépolariser régulièrement à une fréquence prédéfinie par certains éléments notamment
génétique mais pas seulement. C’est cette fréquence de dépolarisation c’est-à-dire le temps qui sépare 2
potentiels d’action qui va définir la fréquence cardiaque de repos du nœud sinusal qu’il va imposer à
l’ensemble des autres cellules du myocarde.
4. Propagation
Le potentiel d'action ainsi généré au niveau du nœud sinusal par cet automatisme va se propager aux cellules
musculaires car le NS et le myocarde sont en contact de façon continue. Il y a donc une propagation du
potentiel d’action de proche en proche aux autres cellules.
La propagation commence avec les cellules en contact avec le nœud sinusal : les myocytes auriculaires, puis
elle continue de proche en proche et arrive au nœud auriculo-ventriculaire. Ce nœud a un rôle de ralentisseur
de la fréquence cardiaque. L’influx continue de se propager à travers les fibres du tissu nodal avec le tronc
du faisceau de His avec ses 2 branches (droite et gauche) qui correspondent à des voies de conduction
rapides de la base vers la pointe. Puis ça se disperse dans le myocarde grâce au réseau de Purkinje en
particulier dans les ventricules pour qu’ils puissent se contracter de manière coordonnée, synchrone et
symétrique. Et enfin, à l’intérieur du myocarde par des cellules musculaires de proche en proche (myocytes
ventriculaires).
S’il y a un problème de conduction, les 2 ventricules ne se contractent pas en même temps ce qui peut
aboutir à des déficiences mécaniques qui peuvent se traduire en clinique par des symptômes comme
l’essoufflement.

5/25
- Nœud sinusal : potentiel instable (120 coups/min)
- Nœud auriculo-ventriculaire : les cellules du NAV ont les mêmes propriétés que les cellules du NS mais à
leur état de base sans stimulation du NS, elles ont une fréquence de dépolarisation un peu plus lente. Si le
NS donne le tempo, elles vont suivre son rythme et se contracter à la fréquence prédéfinie.
- Cellules du myocarde (auriculaire et ventriculaire) : il y a une stabilité du potentiel de membrane au repos
car elles ne sont pas douées d’automatisme, lorsqu'elles sont stimulées par une impulsion des cellules
automatiques, elles se dépolarisent puis se contractent. On notera la présence d’un plateau inexistant au
niveau du SN et du NAV.
Donc l’intégrité de ce système est indispensable au bon fonctionnement du muscle cardiaque car lorsque le
tissu nodal est défaillant cela aboutit au décès du patient ou à la mise en place d’un pace maker (appareil
électrique qui va délivrer une impulsion et va venir remplacer l’automatisme cardiaque qui est défaillant
pour des raisons variées comme des pathologies ou le vieillissement).
5. Régulation
L’activité du NS est modulée par le SNA (vie végétative), en effet les cellules du NS reçoivent de
nombreuses afférences des nerfs sympathiques et parasympathiques.
Ci-dessous, le centre parasympathique qui est cardio inhibiteur ou modérateur et entraine le ralentissement
de la fréquence cardiaque par l’intermédiaire du nerf pneumogastrique ou nerf vague (X). En effet le nerf
vague a un impact sur le nœud sinusal en le ralentissant dès que la synapse cholinergique fonctionne à
l’acétylcholine dans le bulbe rachidien.
Le centre orthosympathique est stimulateur, il a un effet accélérateur, tachycardisant. Il agit par
l’intermédiaire d’une première synapse dans la moelle épinière dorsale et ensuite avec un relais
ganglionnaire qui a une première connexion cholinergique et une deuxième connexion adrénergique avec de
l’adrénaline. C’est la modulation de ces 2 systèmes agissant de manière concertée qui va définir la fréquence
cardiaque qui va être propre à chaque individu en fonction des circonstances, par exemple lors d’un stress la
stimulation orthosympathique l’emporte (accélération de la fréquence cardiaque) alors que dans le cas d’un
mal du transport la stimulation parasympathique l’emporte (ralentissement de la fréquence cardiaque, pâleur,
nausées, vomissement).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%