Ap4bis ts analyse ir et uv visible

SPECTROSCOPIE INFRAROUGE et UV-VISIBLE
0. Indiquer les grandeurs axiales dans un spectre IR et préciser les unités et les
orientations.
Exercice 1 : Utiliser une banque de spectres IR
1. Écrire les formules semi-développées et topologiques de l’acide pentanoïque
et du propanoate d’éthyle.
2. À quelles classes fonctionnelles ces molécules appartiennent-elles?
3. Justifier que l’acide pentanoïque et le propanoate d’éthyle sont deux
molécules isomères.
4. Sur le site d’une banque de spectres IR, http://spirex.ccdmd.qc.ca, on a trouvé
les spectres de l’acide pentanoïque et du propanoate d’éthyle, mais les
étiquettes se sont mélangées.
Chacun de ces spectres IR peut-il être facilement attribué à une molécule ?
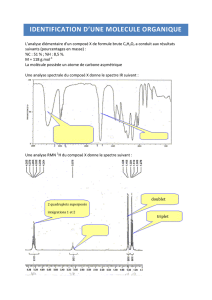
Exercice 2 : Identification d’une molécule organique
Une molécule organique notée M a pour formule brute C4H8O. On sait
qu’il ne s’agit pas d’une molécule cyclique.
1. Quels sont les groupes caractéristiques connus qui sont compatibles avec la
présence d’un seul atome d’oxygène dans la molécule M ?
2. Par comparaison avec la formule brute du butan-1-ol, confirmer la
présence d’une liaison double au sein de la molécule, soit entre deux
atomes de carbone, soit entre un atome de carbone et un atome d’oxygène.
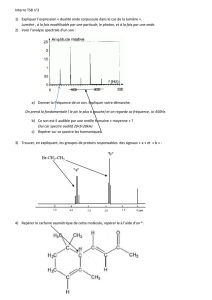
3. Le spectre IR de l’espèce chimique en phase condensée est représenté ci-
dessous.
a. Quel renseignement supplémentaire ce spectre fournit-il ?
b. Écrire les formules topologiques des trois molécules
envisageables, puis les nommer.
4. La molécule a été obtenue par oxydation d’un alcool secondaire. Conclure.
Exercice 3 : Chlorophylle A
1. A quelle(s) longueur(s) d’onde absorbe la
chlorophylle A ?
2. En déduire la couleur de la chlorophylle A.
3. Une des caractéristiques spectroscopiques
de la chlorophylle A est la suivante :
= 111000 SI ;
= 434 nm ; A = 0,74
Donner l’expression de la loi de Beer-Lambert.
4. Quelle est l’unité du coefficient ε ?
5. Déterminer la concentration de la chlorophylle A dans cet échantillon sachent
que la largeur de la cuve est de 1,0 cm.
Spectre
n°1
Spectre
n°2
Terminale S
Accompagnement Personnalisé n°4bis
Spectre
n°3

Liaison
Nombre
d’onde
(cm-1)
Intensité
(1)
Liaison
Nombre
d’onde
(cm-1)
Intensité
(1)
O-Hlibre(2)
3580-3650
F, fine
C=Oester
1700-1740
F
O-Hliée(2)
3200-3400
F ;large
C=Oaldéhyd. cétone
1650-1730
F
N-H
3100-3500
M
C=Oacide
1680-1710
F
Ctri – H(3)
3000-3100
M
C=C
1625-1685
M
Ctri – Haromat(4)
3030-3080
M
C=Caromat
1450-1600
M
Ctét – H(5)
2800-3000
F
Ctri – Haldéhyde
2750-2900
M
O– Hacide carb.
2500-3200
F ;large
(1) l’intensité traduit l’importance de l’absorption : F : forte ; M : moyenne
(2) O-Hlibre : sans liaison hydrogène ; O-Hliée : avec liaison hydrogène
(3) Ctri : correspond à un carbone trigonal (engagé dans une double liaison)
(4) aromat : désigne un composé avec un cycle aromatique comme le benzène ou ses dérivés.
(5) Ctét : correspond à un carbone tétragonal (engagé dans 4 liaisons simples)
Liaison
Nombre
d’onde
(cm-1)
Intensité
(1)
Liaison
Nombre
d’onde
(cm-1)
Intensité
(1)
O-Hlibre(2)
3580-3650
F, fine
C=Oester
1700-1740
F
O-Hliée(2)
3200-3400
F ;large
C=Oaldéhyd. cétone
1650-1730
F
N-H
3100-3500
M
C=Oacide
1680-1710
F
Ctri – H(3)
3000-3100
M
C=C
1625-1685
M
Ctri – Haromat(4)
3030-3080
M
C=Caromat
1450-1600
M
Ctét – H(5)
2800-3000
F
Ctri – Haldéhyde
2750-2900
M
O– Hacide carb.
2500-3200
F ;large
(1) l’intensité traduit l’importance de l’absorption : F : forte ; M : moyenne
(2) O-Hlibre : sans liaison hydrogène ; O-Hliée : avec liaison hydrogène
(3) Ctri : correspond à un carbone trigonal (engagé dans une double liaison)
(4) aromat : désigne un composé avec un cycle aromatique comme le benzène ou ses dérivés.
(5) Ctét : correspond à un carbone tétragonal (engagé dans 4 liaisons simples)
Liaison
Nombre
d’onde
(cm-1)
Intensité
(1)
Liaison
Nombre
d’onde
(cm-1)
Intensité
(1)
O-Hlibre(2)
3580-3650
F, fine
C=Oester
1700-1740
F
O-Hliée(2)
3200-3400
F ;large
C=Oaldéhyd. cétone
1650-1730
F
N-H
3100-3500
M
C=Oacide
1680-1710
F
Ctri – H(3)
3000-3100
M
C=C
1625-1685
M
Ctri – Haromat(4)
3030-3080
M
C=Caromat
1450-1600
M
Ctét – H(5)
2800-3000
F
Ctri – Haldéhyde
2750-2900
M
O– Hacide carb.
2500-3200
F ;large
(1) l’intensité traduit l’importance de l’absorption : F : forte ; M : moyenne
(2) O-Hlibre : sans liaison hydrogène ; O-Hliée : avec liaison hydrogène
(3) Ctri : correspond à un carbone trigonal (engagé dans une double liaison)
(4) aromat : désigne un composé avec un cycle aromatique comme le benzène ou ses dérivés.
(5) Ctét : correspond à un carbone tétragonal (engagé dans 4 liaisons simples

CORRECTION SPECTROSCOPIE UV-Visible / IR
0. Dans un spectre IR, l’abscisse correspond à un nombre d’onde σ = 1/λ (en cm-1) qui augmente vers la gauche ; l’ordonnée
correspond à une transmittance T.
Exercice 1 : Utiliser une banque de spectres IR
1.
acide pentanoïque
propanoate d’éthyle
Semi
CH3-CH2-CH2-CH2-COOH
CH3-CH2-COO-CH2-CH3
Topo
Classe
Acide carboxylique
Ester
Formule brute
C5H10O2
C5H10O2
2. L’acide pentanoïque et le propanoate d’éthyle sont deux molécules isomères car elles ont la même formule brute mais une
formule semi-développée différente.
3. * Etude du 1er spectre :
Rq : d’après ce que l’on sait avant, ce n’est pas possible de trouver une cétone, un aldéhyde…
1710cm-1 ne donne pas la même information que 1740cm-1 : soyez donc précis dans la mesure des nombres d’onde !
σ1 = 1740 cm-1 → liaison C=O ester d’après les tables !!
σ2 = 3000 cm-1 → liaison C-H (tétraédrique)
* Etude du 2ème spectre : σ1 = 1710 cm-1 → liaison C=O acide
σ2 = 3000 cm-1 ; large → liaison O-H acide carboxylique
Le spectre 1 correspond au propanoate d’éthyle et le spectre 2 à l’acide pentanoïque.
Exercice 2 : Identification d’une molécule organique
Une molécule organique notée M a pour formule brute C4H8O. On sait qu’il ne s’agit pas d’une molécule cyclique.
1. D’après la formule brute, on voit qu’elle est composée de C, de H et de O. On peut donc déjà éliminer les amines et les amides.
De plus, Il n’y a qu’un seul oxygène. On peut donc éliminer les esters et les acides carboxyliques.
Ce n’est pas non plus un alcane (molécule uniquement constitué de C et de H).
Il ne reste plus que : alcool, aldéhyde ou cétone. Autrement dit, les groupes caractéristiques possibles sont :
hydroxyle ou carbonyle.
2. Ecrivons la formule développée du butan-1-ol. soit une formule brute : C4H10O.
La molécule M comporte 2 atomes d’hydrogène en moins ce qui implique la présence d’une double liaison. Cette
double liaison peut être soit entre deux atomes de carbone soit entre un atome de carbone et un atome d’oxygène.
3. Phase condensée = liquide (voire solide)
a. On constate la présence de deux bandes : σ1 = 1710 cm-1 ; fine → liaison C=Oaldéhyde cétone.
σ2 = 3000 cm-1 ; fine → liaison C-H.
b. Écrire les formules topologiques :
O
butanal
butan-2-one
2-méthylpropanal
4. Si on oxyde un alcool secondaire, on obtient une cétone.
Si on oxyde un alcool primaire, on obtient un aldéhyde.
Un alcool tertiaire ne peut pas être oxydé.
On peut donc conclure que la molécule étudiée est la butan-2-one.

Exercice 3 : Chlorophylle A
1. La chlorophylle A absorbe aux longueurs d’onde : λ1 = 438 nm & λ2 = 662 nm.
2. Les ondes de longueur d’onde comprise entre 500 nm et 600 nm ne sont pas absorbées par la chlorophylle A ce qui correspond
au vert.
OU
La chlorophylle absorbe le bleu (λ1) et le rouge (λ2) mais pas le vert donc elle est verte, la couleur complémentaire du mélange
bleu-rouge (= magenta).
Pour connaitre la couleur de la chlorophylle, il faut avoir, sous la main, un cercle chromatique.
3. Expression de la loi de Beer-Lambert : A = ε.L.c
= 111000 SI ;
= 434 nm ; A = 0,74
4. En se servant de l’expression de la loi de Beer-Lambert, on arrive à :
=> ε s’exprime en « L.mol-1.cm-1 »
5.
= 6,7.10-6 mol.L-1
1
/
4
100%