DTL de Physique-chimie N°2

CLASSE DE TERMINALE D.T.L. de PHYSIQUE-CHIMIE N°2
P.E. BONNEAU ANNEE 2006-2007 Page 1/11
Nom : Classe de TS
Prénom : le 25/11/2006
D.T.L. de Physique-chimie N°2
Durée : 3H00 - Coefficient 2
Calculatrice autorisée – Documents interdits
Ce sujet comporte 11 pages
TOUTES LES PAGES DU SUJET DOIVENT OBLIGATOIREMENT ETRE RENDUES
La rédaction s’effectue sur le sujet lui-même.
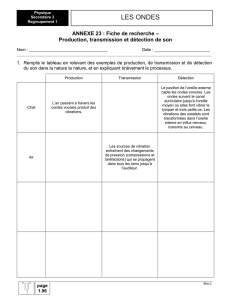
Exercice n°1 (5 points) : Comment les ondes sismiques se propagent-elles ?
Quand la Terre tremble, les vibrations se propagent dans toutes les directions à partir du
foyer du tremblement de terre situé dans les profondeurs de la couche terrestre. Les
vibrations sont initialement de deux types : celles qui compriment et détendent
alternativement les roches, à la manière d'un accordéon, et celles plus destructrices qui les
cisaillent. Les premières, les plus rapides (appelées ondes P), voyagent dans la croûte à une
vitesse de 6 km/s environ, mais peuvent être ralenties dans les roches peu consolidées. Les
secondes (appelées ondes S) sont, à cause des propriétés élastiques des roches,
systématiquement deux fois plus lentes mais environ cinq fois plus fortes que les premières.
Ainsi, lors d'un séisme lointain, ayant ressenti l'onde P, on peut anticiper l'arrivée des ondes
S. Peut-on les distinguer quand un séisme a lieu sous nos pieds ?
Oui : les ondes P vibrent dans leur direction de propagation,
elles soulèvent ou affaissent le sol, tandis que les ondes S
vibrent perpendiculairement et nous secouent horizontalement.
Heureusement, lors de leur voyage à travers le sous-sol, les
ondes perdent de leur énergie.
En s'éloignant du foyer, elles s'amortissent et leurs effets
s'atténuent. Voilà pourquoi les séismes superficiels, trop
proches pour être affaiblis, sont les plus destructeurs.
D'après La Recherche (n° exceptionnel août octobre 2001 Les séismes)
I ) Ondes mécaniques :
1) (0,5 pt) Les ondes sismiques appartiennent au domaine des ondes mécaniques.
Donner la définition générale d'une onde mécanique.
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
2) (0,5 pt) Dans le texte, on peut lire : "les premières voyagent dans la croûte à une vitesse
de 6 km/s environ". Quel terme plus approprié que "vitesse" devrait-on utiliser, pourquoi ?
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….

CLASSE DE TERMINALE D.T.L. de PHYSIQUE-CHIMIE N°2
P.E. BONNEAU ANNEE 2006-2007 Page 2/11
II ) Les ondes sismiques peuvent être, selon les cas, qualifiées par les termes suivants :
ondes longitudinales ; ondes de cisaillement ; ondes transversales ; ondes de compression.
1) (0,5 pt) En utilisant deux termes de la liste ci-dessus, caractériser une onde P. Justifier la
réponse : .………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………….
2) (0,5 pt) En utilisant deux termes de la liste ci-dessus, caractériser une onde S. Justifier la
réponse : ……………………………………………………………………………………………………..…………………………………………………
………………………………………………………………………………………………………………………………………………………………………….
3) (0,5 pt) Associer chacun des deux schémas ci-dessous aux ondes P ou S. Justifier la
réponse.
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
III) (0,5 pt) Les expériences ci-dessous peuvent modéliser les ondes P ou S. Associer chaque
expérience à l'un des deux types d'onde.
Schéma 3 Schéma 4
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
IV ) Epicentre et foyer du séisme

CLASSE DE TERMINALE D.T.L. de PHYSIQUE-CHIMIE N°2
P.E. BONNEAU ANNEE 2006-2007 Page 3/11
Une onde sismique commence à se propager à partir du foyer à la date t = 0. Une station
enregistreuse est située à une distance D de l'épicentre et à une distance d du foyer. On
note VP la célérité de l'onde P et VS la célérité de l'onde S dans la croûte.
1) (0,25 pt) Donner l'expression de tP et tS, dates d'arrivée respectivement des ondes P et S
à la station enregistreuse
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
2) On ne peut pas connaître précisément VP et VS. Cependant, on sait qu'elles obéissent à la
relation : 1/VS – 1/VP 1/8 où VS et VP étant exprimées en km.s-1.
a) (0,5 pt) Si on mesure les dates tS et tP, établir l'expression de la distance d en fonction
de ces dates.
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
b) (0,75 pt) Un capteur de la station mesure l'intervalle de temps séparant l'arrivée des deux
ondes à la station : t = 25 s. En déduire la distance de la station au foyer du séisme.
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
3) (0,5 pt) On appelle foyer superficiel un foyer très proche de la surface terrestre. Dans
ce cas, on peut considérer que d D. Une des méthodes utilisées pour localiser l'épicentre du
séisme dans ce cas est la méthode dite des trois cercles : trois stations S1, S2 et S3
mesurent la distance à laquelle elles se trouvent du foyer d'un séisme. On note des distances
respectivement d1, d2 et d3. On suppose que le milieu est isotrope, c'est à dire que les ondes
se propagent à la même vitesse dans toutes les directions. Expliquer brièvement le principe
de la méthode dite « des trois cercles ».
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….

CLASSE DE TERMINALE D.T.L. de PHYSIQUE-CHIMIE N°2
P.E. BONNEAU ANNEE 2006-2007 Page 4/11
Exercice n°2 (8 points) : chimie et spéléologie
Dans le cadre d’un projet pluridisciplinaire sur le thème de la spéléologie, des élèves de
terminale doivent faire l’exploration d’une grotte où ils risquent de rencontrer des nappes de
dioxyde de carbone CO2. A teneur élevée, ce gaz peut entraîner des évanouissements et
même la mort. Le dioxyde de carbone est formé par action des eaux de ruissellement acides
sur le carbonate de calcium CaCO3 présent dans les roches calcaires. Le professeur de chimie
leur propose d’étudier cette réaction.
Données :
- température du laboratoire au moment de l’expérience : 25°C soit T = 298 K
- pression atmosphérique : Patm = 1,020.105 Pa
- loi des gaz parfaits : P.V = n.R.T
- constante des gaz parfaits : R = 8,31 SI
- masses molaires atomiques, en g.mol-1 : M(C) = 12 ; M(H) = 1 ; M(O) = 16 ; M(Ca) = 40
- densité d’un gaz par rapport à l’air :
29
M
d
, où M est la masse molaire du gaz.
Dans un ballon, on réalise la réaction entre le carbonate de calcium CaCO3(s) et l’acide
chlorhydrique (H3O+(aq) + Cl–(aq)). Le dioxyde de carbone formé est recueilli par déplacement
d’eau, dans une éprouvette graduée.
Un élève verse dans le ballon, un volume VS = 100 mL d’acide chlorhydrique à 0,1 mol.L-1. A la
date t = 0 s, il introduit rapidement dans le ballon 2,0 g de carbonate de calcium CaCO3(s)
tandis qu’un camarade déclenche un chronomètre. Les élèves relèvent les valeurs du volume
VCO2 de dioxyde de carbone dégagé en fonction du temps. Elles sont reportées dans le tableau
ci-dessous. La pression du gaz est égale à la pression atmosphérique.
t (s)
0
20
40
60
80
100
120
140
160
180
200
220
VCO2 (mL)
0
29
49
63
72
79
84
89
93
97
100
103
t (s)
240
260
280
300
320
340
360
380
400
420
440
VCO2 (mL)
106
109
111
113
115
117
118
119
120
120
121
La réaction chimique étudiée peut être modélisée par l’équation :
CaCO3(s) + 2 H3O+(aq) = Ca2+(aq) + CO2(g) + 3H2O(l)
1. (0,5 pt) Calculer la densité par rapport à l’air du dioxyde de carbone CO2(g). Dans quelles
parties de la grotte ce gaz est-il susceptible de s’accumuler ?
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….

CLASSE DE TERMINALE D.T.L. de PHYSIQUE-CHIMIE N°2
P.E. BONNEAU ANNEE 2006-2007 Page 5/11
2. (0,5 pt) Déterminer les quantités de matière initiale de chacun des réactifs.
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
3. (1 pt) Dresser le tableau d’avancement de la réaction. En déduire la valeur xmax de
l’avancement maximum. Quel est le réactif limitant ?
Equation chimique
CaCO3 (s) + 2 H3O+ (aq) = Ca2+ (aq) + CO2 (g) + 3 H2O(l)
Etat du système
Avancement
(mol)
Etat initial
En cours de
transformation
Etat final
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
4.a) (0,75 pt) Exprimer l’avancement x de la réaction à une date t en fonction de VCO2, T, Patm
et R. Calculer sa valeur numérique à la date t = 20 s.
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
b) (0,5 pt) Calculer le volume maximum de gaz susceptible d’être recueilli dans les conditions
de l’expérience. La transformation est-elle totale ?
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………….
5. Les élèves ont calculé les valeurs de l’avancement x et reporté les résultats sur le graphe
donné page suivante.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%