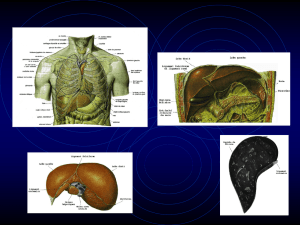
Ponction biopsie hépatique

256
La lettre du l’hépato-gastroentérologue - n° 5 - vol. IV - octobre 2001
La ponction biopsie hépatique (PBH) est un examen essentiel pour établir le diagnostic et le pronostic
de nombreuses maladies hépatiques (1). Dans cette fiche pratique ne sera abordée que la biopsie hépa-
tique réalisée pour une maladie parenchymateuse diffuse du foie. La PBH est réalisée habituellement,
en l’absence de contre-indication, par voie transpariétale (1). Dans une étude prospective française
récente regroupant 2 084 PBH, 91 % des PBH étaient réalisées par voie transpariétale et 9 % par voie
transjugulaire (2). Seize mille PBH transpariétales pour maladie parenchymateuse diffuse sont réalisées
chaque année en France auxquelles il faut ajouter environ 2 000 PBH par voie transjugulaire (3).
Il existe à mon sens deux contre-indications absolues à la réalisation d’une PBH : l’absence d’informa-
tion du malade et l’absence de bénéfice direct ou indirect que peut en retirer le patient. Le problème de
la preuve d’information est un autre débat qu’il ne m’appartient pas de développer ici. Ainsi, comme
pour tout geste invasif, le rapport risque-bénéfice doit être évalué pour chaque patient.
La principale indication en 1997, représentant 54 % des PBH, est l’appréciation des lésions nécrotico-
inflammatoires et de fibrose de l’hépatite C (2). En effet, les lésions d’activité et de fibrose, appréciées
par le score Métavir et/ou par le score de Knodell plus utilisé par les Anglo-Saxons, déterminent les
indications de la bithérapie par interféron-ribavirine ou interféron pégylé-ribavirine. Cependant, le
développement récent de marqueurs de fibrose pourrait faire diminuer les indications de la biopsie
hépatique dans ce cas (4). Dans les autres hépatopathies chroniques, notamment dans l’hépatite B, là
encore, la PBH a pour place l’appréciation des lésions de nécrose et de fibrose. Chez les patients
atteints d’hémochromatose, la PBH n’est indiquée que lorsqu’il existe une hépatomégalie et/ou une
augmentation des SGOT et/ou une ferritinémie supérieure à 1 000. Les auteurs de Rennes ont bien
montré qu’en l’absence de ces anomalies cliniques et/ou biologiques, il n'existait pas de fibrose exten-
sive ou de cirrhose.
Il n’y a pas d’indication à la biopsie hépatique dans les hépatites aiguës virales. La PBH peut se discu-
ter dans les hépatites aiguës médicamenteuses au cas par cas, uniquement s’il s’agit d’un médicament
récemment introduit sur le marché pour lequel aucun cas d’hépatotoxicité n’a été rapporté, ou éven-
tuellement lorsqu’un nombre très faible d’observations a été publié, le nombre de trois à cinq observa-
tions pourrait être choisi arbitrairement.
À mon sens, une hépatite sévère d’étiologie indéterminée est une indication à la PBH qui doit être réa-
lisée par voie transjugulaire afin de ne pas méconnaître une hépatopathie auto-immune dans une forme
séronégative ou une maladie de Wilson qui pourrait bénéficier d’un traitement spécifique, traitement
immunosuppresseur ou traitement par D-pénicillamine.
Dans une étude rétrospective récente (3), 85 % des centres exigeaient un taux de plaquettes supérieur
à70000/mm3, et 100 % des centres un taux de prothrombine supérieur à 50 %. Le temps de cépha-
line activé (TCA), seul à même de dépister un déficit en facteur VIII, IX et XI pouvant entraîner des com-
plications hémorragiques, n’était pas pris en compte dans 20 % des cas. Il me semble qu’un TCA infé-
Ponction biopsie hépatique
J.F. Cadranel
Unité d’hépatologie, centre hospitalier Laennec, Creil.
Quelles sont les
bonnes indications
de la PBH, dès lors
que le patient peut en
retirer un bénéfice ?
Quelles sont les
limites acceptables
des paramètres de
l’hémostase
permettant
de réaliser une PBH
par voie
transpariétale ?
Fiche
Ponction biopsie hépatique
N°21
Fiche
technique
.../...
HGE 5 05/11/01 12:53 Page 256

p 257
Roche Nicolas
HGE 5 05/11/01 12:53 Page 257

.../...
258
La lettre du l’hépato-gastroentérologue - n° 5 - vol. IV - octobre 2001
rieur ou égal à 1,5 fois le témoin doit être exigé pour réaliser une PBH par voie transpariétale.
Si l’interrogatoire à la recherche de prise d’aspirine et/ou d’AINS a été correctement fait lors de la
prise de décision de PBH, il n’existe pas d’argument scientifique pour recommander la réalisation
d’un temps de saignement. Un arrêt de l’aspirine et/ou des AINS d’au moins 8 jours paraît néces-
saire et suffisant, mais il est possible que ce délai soit de 10 jours pour certains anti-agrégants pla-
quettaires. Il est nécessaire d’attendre 72 heures, après une PBH, pour réintroduire les anti-agré-
gants plaquettaires. S’il existe des antécédents personnels et/ou familiaux d’hémorragie, il faut
réaliser un temps de saignement. Lorsque le TP est strictement supérieur à 50 %, qu’il n’existe pas
de déficit en facteur de la coagulation et que les plaquettes sont supérieures à 70 000, une biopsie
hépatique par voie transpariétale peut être réalisée. Lorsque le TP est supérieur à 50 % et les pla-
quettes comprises entre 50 et 70 000, il est bon de mesurer le temps de saignement par une méthode
fiable. Si le temps de saignement est augmenté, une biopsie hépatique par voie transjugulaire doit
être réalisée. Si le temps de saignement est normal, il n’y a pas de raison de contre-indiquer la biop-
sie par voie transpariétale, en tout cas sur le plan théorique. En cas de thrombopénie inférieure à
50 000, la plupart des auteurs recommandent une biopsie hépatique par voie transjugulaire. Lorsque
les paramètres d’hémostase sont limites, il n’y a pas, à mon sens, compte tenu de la faisabilité de la
biopsie hépatique transjugulaire, d’indication à réaliser des PBH par voie transpariétale sous couvert
de transfusion de plasma frais congelé et/ou de plaquettes. Chez les hémophiles, la biopsie hépa-
tique doit être réalisée par voie transjugulaire, après correction du déficit.
Le foie cardiaque, les troubles de l’hémostase, l’hémophilie, la maladie de Rendu-Osler, l’hémodialyse
restent des contre-indications à la biopsie hépatique par voie transpariétale, de même que l’emphysème
et la dilatation des voies biliaires. L’existence d’une tumeur vasculaire ou d’un hémangiome sur le tra-
jet de ponction et d’un kyste hydatique sont également des contre-indications absolues. Le diagnostic
d’amylose est une contre-indication théorique à la biopsie hépatique par voie transpariétale en raison
d’un risque hémorragique accru, d’autant que le diagnostic d’amylose peut être fait par des méthodes
moins invasives, en particulier la biopsie rectale. En cas d’ascite, sauf si elle n’est visualisée qu’à l’écho-
graphie, la voie transpariétale doit être évitée.
Il n’y a aucun argument dans la littérature pour recommander la réalisation d’une biopsie à jeun ou
après un petit déjeuner léger. Il est recommandé, si la biopsie n’est pas réalisée après repérage écho-
graphique du site de ponction, de faire prendre au patient un petit déjeuner léger de façon à ne pas
risquer une piqûre vésiculaire.
La PBH par voie transjugulaire, qui nécessite un opérateur entraîné, s’applique aux contre-indications
de la PBH transpariétale et/ou lorsqu’une étude hémodynamique est nécessaire.
Quand on réalise une PBH par voie transpariétale, une échographie récente est indispensable. Il est dif-
ficile, même si certains arguments sont en faveur de cette attitude (coût-efficacité, absence de risque de
ponction d’organe de voisinage), de recommander un repérage systématique du point de ponction
immédiatement avant la PBH. Il n’y a pas, à ce jour, d’argument scientifique suffisant pour imposer cette
pratique qui induirait des contraintes organisationnelles très importantes.
En dehors de l’adaptation à chaque cas particulier de la voie d’abord, PBH transpariétale ou PBH trans-
jugulaire, il faut noter qu’un geste réalisé par un opérateur expérimenté (> 150 PBH), avec un seul pas-
sage si possible, diminue les douleurs et augmente l’acceptabilité (2). Le nombre de complications aug-
mente au-delà d’un passage, et le nombre de complications graves au-delà de trois passages. Une
prémédication diminue l’anxiété. Nous utilisons pour notre part une prémédication par atropine qui pour-
rait diminuer le risque de choc vagal (0,5-1 mg en fonction du poids) et une sédation par Atarax® (25-
100 mg en fonction du poids). Il n’y a pas d’argument pour poser systématiquement une perfusion, ce
qui est réalisé par 41 % des centres et qui accroît l’inconfort des patients. Nous utilisons dans notre unité
Peut-on améliorer la
tolérance,
l’acceptabilité de cet
examen invasif
et en diminuer les
risques ?
Ponction biopsie hépatique
.../...
HGE 5 05/11/01 12:53 Page 258

Transipeg
p 259
HGE 5 05/11/01 12:53 Page 259

260
La lettre du l’hépato-gastroentérologue - n° 5 - vol. IV - octobre 2001
un obturateur qui permet l’administration rapide d’antalgiques intraveineux. Il faut probablement adminis-
trer une antibiothérapie préventive en raison d’un risque infectieux accru chez un transplanté hépatique
ayant une anastomose hépatico-jéjunale. Il est possible, lorsqu’elle est réalisable sans risque (pas de patho-
logie associée, distance courte en temps entre le centre ayant pratiqué le geste et le domicile du patient,
patient accompagné la nuit suivant la biopsie), que la biopsie ambulatoire améliore l’acceptabilité d’une
biopsie ultérieure. L’équipement de l’hôpital doit comporter la possibilité de faire une transfusion sanguine
et, au minimum, la présence d’un chirurgien digestif de garde. Il est d’ailleurs de bonne pratique en cas de
douleur persistant malgré l’administration d’antalgiques, de prévenir le chirurgien de garde, car il s’agit
habituellement d’une plaie biliaire pouvant nécessiter une intervention chirurgicale. Il faut rappeler cepen-
dant que malgré toutes ces précautions, la prévalence des complications graves dans une étude récente était
de 0,57/1 000 (2) et que la mortalité de l’ordre de 1/10 000 (1). L’indication de ce geste invasif doit donc
reposer sur un rapport risque-bénéfice en faveur du bénéfice, pour tout patient soumis à une PBH. ■
“Les opinions émises par l’auteur n’engagent pas la responsabilité du groupe de travail sur les recom-
mandations de pratique clinique sur la PBH.”
Références bibliographiques
1. Degos F, Benhamou JP. Liver biopsy. In : Bircher J, Benhamou JP, Mac Intyre N et al. (eds.) Clinical Hepatology. Oxford :
Oxford University Press, 1999 : 541-8.
2. Cadranel JF, Rufat P, Degos F. For the groupe of epidemiology of the french association for the study of the liver (AFEF). Prac-
tices of liver biopsy in France : results of a prospective nationwide survey. Hepatology 2000 ; 32 : 477-81.
3. Cadranel JF, Rufat P, Degos F. Pour le groupe “Évaluation et Épidémiologie” de l’Association française pour l’étude du foie.
Pratiques de la ponction-biopsie hépatique transpariétale en France. Résultats d’une étude nationale rétrospective.
Gastroenterol Clin Biol 2001 ; 25 : 77-80.
4. Imbert-Bismut F, Ratziu V, Piervin L et al. For the multivir C group. Biochemical markers of liver fibrosis in patients with hepa-
titis C infection : a prospective study. Lancet 2001 ; 357 : 1069-75.
Ponction biopsie hépatique
ERRATUM
La rédaction prie les auteurs de bien vouloir l’excuser de l’erreur portant sur le cliché b de la figure 2 de l’article intitulé
“Grossesse et autre grosseur” et paru dans le n°4 vol.IV, p. 205. Le cliché 2b rectifié est présenté ci-dessous.
2a
2c
2b
.../...
Figure 2a. Coupe axiale en pondération
T1 avec saturation de graisse avant injec-
tion de contraste. Masse isthmique bien
limitée avec un signal intermédiaire dis-
crètement hétérogène.
Figure 2b. Coupe axiale en pondération
T1 avec saturation de graisse au temps
artériel précoce après injection de contras-
te. Masse peu vascularisée.
Figure 2c. Coupe axiale en pondération T1
avec saturation de graisse au temps artériel
parenchymateux après injection de produit
de contraste. Prise de contraste tardive, plu-
tôt périphérique, hétérogène.
HGE 5 05/11/01 12:53 Page 260
1
/
5
100%