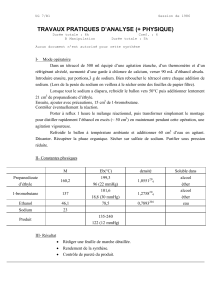
- enseignement Catholique

1
Document1
AUTEUR : Pascale Sartiaux
Fiche d’expérience 6
Un métal se transforme en ion
Ces expériences seront réalisées sous hotte par le professeur.
1. Objectif de l’expérience
Illustrer la réaction chimique qui se produit lorsqu’un atome métallique se transforme en ion positif.
2. Description générale
Les métaux ont des propriétés physiques communes. Qu’en est-il de leurs propriétés chimiques. Se
comportent-ils tous de la même manière ?
Pour répondre à cette question, la réaction entre le sodium et l’eau, d’une part, et la réaction entre
le calcium et l’eau, d’autre part, vont être réalisées. Ces expériences montreront que les propriétés
chimiques du sodium et du calcium sont semblables, mais « l’intensité » des réactions est différente.
3. Matériel et produits
- du sodium (conservé à l’abri de l’air dans l’éther de pétrole)
- du calcium en granulés
- de l’eau distillée
- une solution de phénolphtaléine
- 2 berlins de 500 mL
- 1 grillage de protection
- 1 cutter (ou scalpel)
- 1 pince
- 1 petit entonnoir
- 1 tube à essai
- 1 briquet ou allumette
HGT - SCB
Chimie
UAA1

2
Document1
4. Procédure
a) Réaction entre le sodium et l’eau
1) Remplir un berlin avec environ 50 mL d’eau distillée.
2) Ajouter quelques gouttes de phénolphtaléine. Observer la
couleur de la solution.
3) Découper un petit morceau de sodium à l’aide du cutter
et le prélever à l’aide de la pince. Observer son éclat gris
métallique visible sur la tranche fraîchement coupée.
4) Jeter le morceau de sodium dans l’eau et couvrir aussitôt le berlin avec le grillage.
5) Observer, écouter.
b) Réaction entre le calcium et l’eau
1) Remplir un berlin avec environ 50 mL d’eau distillée.
2) Ajouter quelques gouttes de phénolphtaléine. Observer la
couleur de la solution.
3) Préparer l’entonnoir surmonté du tube à essai.
4) Jeter quelques grains de calcium dans l’eau.
5) Aussitôt, placer l’entonnoir surmonté du tube à essai sur
le calcium (voir schéma ci-contre). Observer.
6) Après réaction, réaliser le test d’identification de l’H2.
5. Notes pour le professeur
- Au cours des deux réactions, on peut observer une effervescence (due à la libération de
dihydrogène). Le dihydrogène est récolté lors de la réaction avec le calcium. Il est possible de
montrer que le gaz produit est du dihydrogène en approchant une flamme du tube à essai (bruit
caractéristique).
- Il est possible de montrer la tendance différente des métaux à perdre des électrons en visualisant
la violence de la réaction.
o Dans le cas du sodium, la réaction est vive, le sodium flotte, se déplace rapidement à la
surface de l’eau (signe qu’un gaz est émis lors de la réaction) et prend la forme d’une boule
(fusion). La réaction peut être accompagnée de petites flammes jaune-orange (couleur
caractéristique du sodium), l’explosion de dihydrogène peut survenir (le grillage en évite les
inconvénients).
o Dans le cas du calcium, la réaction est moins spectaculaire : des bulles se dégagent au niveau
du calcium et se rassemblent dans le tube à essai. L’hydroxyde de calcium est peu soluble, il
apparaît sous forme d’un précipité blanc autour du métal.
- Après l’ajout de sodium ou de calcium, l’indicateur (la phénolphtaléine) prend une teinte rose
fuchsia, caractéristique des milieux basiques.
- On peut faire observer les propriétés du sodium :
o le sodium est un métal qui réagit très bien avec le dioxygène de l’air,
o on peut facilement écraser le sodium avec une spatule (il est malléable),
o lorsqu’on le jette dans l’eau, le sodium flotte (sa masse volumique est inférieure à celle de
l’eau : Na = 0,968 kg/L à 20°C),
o il se met en boule au contact de l’eau car il fond (sa température de fusion est de 97,8°C),
o il réagit avec l’eau.

3
Document1
6. Sécurité
La réalisation d’expériences en particulier en chimie suppose le respect d’un certain nombre de règles
permettant à chacun, élèves et professeur, de vivre ces séances de laboratoire dans les meilleures
conditions de sécurité.
Pour chaque local où se déroulent de telles expériences, existe un règlement de laboratoire, approuvé
par le Conseiller en Prévention. Il sera signé par le chef d’établissement, le professeur, l’élève et ses
parents/responsables.
Chaque élève a une bonne connaissance de ce document.
Analyse de risques
Phases
Points-clés
Sources de danger ou nature du
risque
Mesures de prévention préconisées
Avant
(Professeur)
Organisation de la
classe
Les élèves doivent se placer de
façon à bien voir les
expériences sans être trop près
(risques possibles d’explosion)
Le professeur porte des lunettes de
sécurité. Au besoin reproduire
l’expérience pour que la réaction soit
visible pour tous.
Pendant
(Professeur
et élèves)
Réaction du sodium
avec l’eau.
Test d’identification
de l’H2
Explosion.
Travailler avec de petites quantités de
métal.
Travailler sous hotte.
Tenir les élèves à une distance
raisonnable.
Après
(Professeur
et élèves)
Evacuation des
déchets et nettoyage
du laboratoire
Récolter les solutions basiques dans un
container prévu à cet effet. L’évacuer
selon les normes.
Informations sur les réactifs
Sodium
Conserver à l’abri de l’air et de l’eau. Ne jamais laisser le sodium à découvert dans
son récipient. Si le sodium a un aspect blanchâtre (sodium recouvert d’une couche
étanche de carbonate de sodium. Ce phénomène est dû au sodium qui s’est oxydé
et est resté au contact du CO2 atmosphérique), il faut le gratter avant de l’utiliser ou
n’utiliser que des morceaux fraîchement coupés.
Calcium
7. Prolongement possible
Il est possible de montrer la réactivité croissante au sein d’une famille en visionnant des expériences
postées sur Youtube.
Par exemple (vidéo en anglais), https://youtu.be/zmmu607BZDI (page consultée le 08/10/2016)

4
Document1
8. Développements attendus principalement visés
Illustrer le concept d’ion au travers d’une situation expérimentale ou quotidienne (C9).
Pour une substance donnée,
- soit l’élève met en évidence les ions présents, ainsi que leur charge électrique à l’aide des
données fournies par l’étiquette du contenant ;
- soit l’élève identifie l’existence d’ions en réalisant une expérience de conductivité électrique.
Expliciter la composition d’un ion (C10).
Pour un ion monoatomique donné, l’élève repère la position de l’atome correspondant dans le tableau
périodique des éléments. Il en déduit la composition de cet ion (nombre de protons et de neutrons dans
le noyau, nombre d’électrons).
9. Bibliographie
- TOMASINO, A., LORRIN, C., Chimie 2e, Ed. Nathan, France, 1993
- DELSATE, Ph., CAPELLE, Ph., Recommandations pour une meilleure sécurité dans les
laboratoires de sciences – Tous degrés, Fédération de l’enseignement secondaire catholique,
2006, téléchargeable à l’adresse suivante : http://admin.segec.be/documents/4675.pdf (page
consultée le 03/11/2015)
1
/
4
100%