Résumé de la littérature

REVUE DE PRESSE
Revue de presse
CHIRURGIE MAMMAIRE CONSERVATRICE ET
RADIOTHÉRAPIE : UNE POSSIBILITÉ THÉRAPEUTIQUE
POUR LE CARCINOME LOBULAIRE IN SITU ?
Cutuli B, de Lafontan B, Quetin P, Mery E. Breast-conser-
ving surgery and radiotherapy: a possible treatment for lobu-
lar carcinoma in situ. European Journal of Cancer 41
2005:380-5.
Résumé.
Le carcinome lobulaire in situ du sein est traité le plus
souvent par une chirurgie mammaire de type conservatrice, plus
rarement de type mastectomie.
Cette étude a porté sur une série de patientes présentant un carci-
nome lobulaire in situ (CLIS) traité par chirurgie conservatrice et
radiothérapie du sein.
De 1980 à 1992, 25 patientes avec un âge moyen de 54 ans ont
bénéficié d'une tumorectomie (20) ou quadrantectomie (5), asso-
ciée à une irradiation totale du sein (dose médiane 52 Gy).
Cinq patientes avaient une lésion palpable, dix-neuf des images
mammographiques isolées et, une, un écoulement mamelonnaire.
Douze patientes ont reçu du tamoxifène à la dose de 20 mg par
jour pendant deux ans. Le taux global de carcinome bilatéral était
de 17,6 % (2 synchrones, 1 métachrone). La médiane de survie
étant de 153 mois (de 58 à 240), une seule récidive locale infil-
trante a été enregistrée. Aucun cas de carcinome lobulaire in situ
traité par radio-chirurgie n'a été décrit en détail dans la littérature
jusqu’à nos jours. Le taux de carcinome lobulaire infiltrant, surve-
nant après diagnostic de carcinome lobulaire in situ sur biopsie
seule, est de 15 %.
Ainsi, le traitement radiochirurgical conventionnel pourrait repré-
senter une alternative intéressante vis-à-vis d’une chirurgie
conservatrice ou d’une mastectomie, en sachant que la chirurgie
ou la radiothérapie peuvent être le seul traitement proposé.
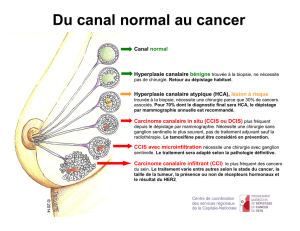
Commentaire. Le carcinome lobulaire in situ représente 1 à 2 %
des cancers mammaires et 15 à 20 % de tous les carcinomes in
situ. Il est plus reconnu comme étant un facteur de risque de sur-
venue de cancer que comme un cancer véritable, d’où la proposi-
tion d’Haagensen et al., en 1978, d’utiliser le terme de “néoplasie
lobulaire”.
Ce terme de “néoplasie lobulaire” regroupait toutes les lésions
lobulaires allant de l’hyperplasie lobulaire atypique jusqu’au car-
cinome lobulaire in situ. Les carcinomes lobulaires in situ ont un
risque de survenue de carcinome infiltrant deux fois supérieur aux
hyperplasies lobulaires atypiques.
En 2003, l’OMS a suggéré de regrouper toutes ces lésions sous
l’appellation de “néoplasie intra-épithéliale lobulaire”, ou “lobu-
lar intra-epithelial neoplasia”, ou LIN.
Cette décision s”appuie sur les résultats d”études de biologie
moléculaire montrant que les hyperplasies lobulaires atypiques et
les carcinomes lobulaires in situ sont des proliférations néopla-
siques, et ont un profil génétique identique entre eux et à celui du
carcinome infiltrant.
L’OMS individualise trois groupes : LIN1 (HLA), LIN2 (HLA +
CLIS), LIN3 (CLIS pléomorphe). La LIN3 est caractérisée par un
comblement et une distension des lobules avec parfois nécrose
centrale, par des cellules non cohésives de grande taille, aty-
piques, pléomorphes, n’exprimant pas la E-cadhérine
D’après les résultats de l’essai NASBP B-17 (recul de 5 ans), les
LIN3, et en moindre proportion les LIN2, ont un risque plus élevé
d’association avec un carcinome infiltrant.
Les LIN3 semblent donc s’individualiser des deux autres groupes
et nécessiter une reprise chirurgicale en cas de découverte sur
biopsie, afin de vérifier l’absence de contingent infiltrant associé.
Un enregistrement prospectif devrait permettre d’évaluer l’intérêt
d’une radiothérapie complémentaire en cas de chirurgie conserva-
trice dans le sous-groupe de plus mauvais pronostic (LIN3). ■
E. Mery, Institut Claudius-Regaud, Toulouse.
DENSITÉ MAMMOGRAPHIQUE, DENSITÉ MINÉRALE
OSSEUSE ET RISQUE DE CANCER DU SEIN
Kerlikowske K, Shepherd J, Creasman J, Tice JA, Ziv E,
Cummings SR. Are breast density and bone mineral density
independent risk factors for breast cancer ? J Natl Cancer
Inst 2005;97: 68-74.
Résumé. Les auteurs examinent les corrélations entre la den-
sité mammographique (DM), mesurée qualitativement selon
les types BI-RADS ou quantitativement en pourcentage de sur-
face dense d’une part, la densité minérale osseuse (DMO)
d’autre part, et le risque de cancer du sein dans une étude cas-
contrôle de 108 cas versus 436 contrôles. Ni la densité miné-
rale vertébrale ni celle de la hanche ne sont corrélées avec la
DM, quelle que soit la modalité de mesure. Ni la densité miné-
rale vertébrale ni celle de la hanche ne sont associées significa-
tivement avec le risque de cancer du sein. En revanche, les
femmes dont la DM est dans le sextile le plus élevé ont un
risque de cancer du sein environ triplé par rapport aux femmes
du sextile le plus bas (OD : 2,7 ; IC 95 % : 1,4-5,4). Les
auteurs concluent, après une analyse multivariée prenant en
compte les autres facteurs de risque connus, que la DM est
significativement associée à une augmentation du risque de
La Lettre du Sénologue - n° 28 - avril/mai/juin 2005
27

28
La Lettre du Sénologue - n° 28 - avril/mai/juin 2005
REVUE DE PRESSE
cancer du sein alors que ce n’est pas le cas de la DMO, même
si celle-ci est un marqueur possible de l’exposition totale aux
estrogènes au cours de la vie.
Commentaire. Cette étude suggère donc qu’une des raisons
pour lesquelles la DM contribue au risque de cancer du sein est
indépendante des effets médiés par les estrogènes. Cette hypo-
thèse est soutenue par l’observation qu’une importante DM est
aussi fortement associée à des cancers du sein récepteurs estro-
gènes positifs que récepteurs estrogènes négatifs (1), renvoyant
à des biomarqueurs moléculaires encore inconnus, mais très
certainement liés à des facteurs génétiques. En analysant 353
paires de jumelles homozygotes australiennes et 218 paires de
jumelles homozygotes canadiennes et américaines d’une part,
et 246 paires de jumelles hétérozygotes australiennes et 134
paires de jumelles hétérozygotes canadiennes et américaines
d’autre part, il a été montré que le coefficient de corrélation du
pourcentage de DM varie respectivement entre 0,61 et 0,67
pour les paires de jumelles homozygotes et 0,25 à 0,27 pour
les paires de jumelles hétérozygotes, permettant de conclure
qu’ajustés à l’âge, 63 % de la densité mammographique relè-
vent d’une cause génétique, 20 à 30 % du poids, de la parité et
du statut hormonal (2).
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Ziv E et al. Mammographic density and estrogen receptor status of breast
cancer. Cancer Epidemiol Biomarkers Prev 2004;13:2090-5.
2. Boyd NF et al. Heritability of mammographic density, a risk factor for breast
cancer. N Engl J Med 2002;347:886-94.
■
G. Boutet,
28, rue de Norvège, 17000
La Rochelle
DOIT-ON RETARDER LA RÉÉDUCATION DE L’ÉPAULE
CHEZ DES PATIENTES OPÉRÉES D’UN CANCER DU SEIN ?
Shamley DR, Barker K, Simonite V, Beardshaw A. Delayed ver-
sus immediate exercises following surgery for breast cancer: a
systematic review. Breast Cancer research and Treatment
2005;90(3):263-71.
Résumé.
La chirurgie pour cancer du sein peut entraîner la for-
mation d’un lymphocèle le plus souvent axillaire. Elle peut
aussi avoir pour conséquence une diminution de la mobilité de
l’épaule qui motive des exercices de rééducation. Les lympho-
cèles, quant à eux, sont ponctionnés quand ils sont trop volumi-
neux, donc gênants et/ou douloureux. Le risque de cette ponc-
tion est la surinfection. La question est de savoir s’il faut
retarder la rééducation de l’épaule pour diminuer le risque de
lymphocèle.
Les auteurs ont comparé deux groupes de patientes opérées
pour un cancer du sein avec, selon le groupe, rééducation pré-
coce ou retardée. Ils ont évalué pour chaque groupe la mobilité
de l’épaule dans le temps, les ponctions éventuelles de lympho-
cèles et, plus globalement, les conséquences des lymphocèles.
La rééducation retardée diminue très significativement la for-
mation de lymphocèles (p = 0,00001), mais il n’a pas été
retrouvé de différence significative tant pour le volume de
lymphe ponctionné que pour le nombre de consultations médi-
cales. Les auteurs concluent qu’il n’est pas possible de prendre
position pour une rééducation précoce ou retardée.
Commentaire. Une patiente opérée pour un cancer du sein
prend naturellement une position de protection de la zone opé-
rée avec l’épaule surélevée et en avant. Cela a pour consé-
quence un blocage progressif de l’épaule qui motive la rééduca-
tion postopératoire qui, elle-même, augmente le nombre de
lymphocèles. Cette rééducation est d’autant plus laborieuse
qu’elle est réalisée de façon tardive.
Il est facile de donner quelques conseils à la patiente le jour de
l’intervention et le lendemain pour la rassurer sur la “solidité”
de la cicatrice et pour l’encourager dans la réalisation des mou-
vements naturels (toilette, coiffage...). Cela évite le blocage de
l’épaule et la rééducation “en force”. La mobilisation doit être
fréquente (toutes les heures) et douce. Elle permet un retour
plus rapide à la vie normale. Lors de la consultation avant la
mise en route de la radiothérapie postopératoire, on retrouve
encore trop fréquemment des patientes qui n’ont pas récupéré
de façon complète la mobilité de leur épaule. Elles ont alors
beaucoup de mal à s’installer dans une position confortable
pour l’irradiation (bras vers l’arrière) et leur positionnement
s’améliore progressivement au cours des cinq semaines d’irradia-
tion, cette modification nuisant à la qualité du ciblage. ■
B. de Lafontan, Institut Claudius-Regaud, Toulouse.
IDENTIFICATION DU GANGLION SENTINELLE APRÈS UNE
CHIMIOTHÉRAPIE NÉOADJUVANTE CHEZ DES PATIENTES
ATTEINTES D’UN CANCER DU SEIN
Mamounas EP, Brown A, Anderson S et al. Sentinel Node
Biopsy after Neoadjuvant Chemotherapy in Breast Cancer:
Results from National Surgical Adjuvant Breast and Bowel
Project Protocol B-27. JCO 2005april;23(12):2694-702.
Résumé. Les auteurs présentent l’analyse d’une sous-popula-
tion de l’essai NSABP B-27 ayant bénéficié de la procédure du
ganglion sentinelle avec curage axillaire systématique après
une chimiothérapie néoadjuvante.
Parmi les 2411 patientes incluses dans l’étude, 428 (18,1%)
ont bénéficié de la biopsie du ganglion sentinelle, 76% sont
N0 clinique.
La détection du GS est réalisée par méthode combinée dans
seulement 54,7% des cas, par radioisotope dans 14,7% des cas
et par bleu seul chez 29,9% des patientes.
Le taux d’identification global est de 84,8% et augmente de
façon significative avec l’utilisation du radioisotope (78,1%
avec le bleu, 88,9% avec radioisotope seul, 87,6% avec la
méthode combinée).
Il n’y a pas de différence significative dans la détection en
fonction de la taille tumorale, du statut ganglionnaire, de l’âge
de la patiente et de la date d’inclusion dans l’essai. Le taux de
faux négatifs est de 10,7% dans cette étude.
Les réponses clinique et histologique tumorales n’influencent
pas, de façon significative, le risque de faux négatif, ainsi que
la méthode de détection du ganglion sentinelle.
Commentaire.
Il s’agit de la plus importante étude de faisabi-

29
La Lettre du Sénologue - n° 28 - avril/mai/juin 2005
lité de la technique du ganglion sentinelle après chimiothérapie
néo adjuvante avec un nombre de patientes comparable aux
études multicentriques du ganglion sentinelle lors d’une chi-
rurgie première.
Les résultats en termes de taux d’identification et de faux
négatif sont également superposables et éclairent sur la faisabi-
lité de la procédure après un traitement néoadjuvant. Il faut
tout de même noter l’hétérogénéité des pratiques de détection.
Le taux de faux négatifs est de 0 à 17% dans la littérature (la
dernière étude venant d’être publiée dans Annals of Surgery
retrouve, sur 4 117 patientes, 2,5 % de risque de FN avec 94%
de taux d’identification).
Pour conforter ces résultats, nous attendons les résultats de
l’essai GANEA du groupe des chirurgiens de CLCC qui éva-
lue de façon prospective, la fiabilité de la technique du gan-
glion sentinelle dans ce même groupe de patientes traitées par
chimiothérapie néoadjuvante, l’exérèse du ganglion sentinelle
étant toujours suivie d’un évidement.
Dans l’essai NSABP B-27, l’utilisation du docétaxel en néo-
adjuvant a permis une réduction du taux d’envahissement axil-
laire, avec seulement 15,5% de risque de N+ en cas de réponse
histologique complète. On peut alors se poser la question de la
perte d’information sur l’envahissement ganglionnaire du fait
du traitement néoadjuvant, et de l’utilité de l’expertise gan-
glionnaire avant le début du traitement, éventuellement avec la
procédure du ganglion sentinelle.
■
VIIIes Journées de l’hôpital Saint-Louis
22-23 septembre 2005
Les événements de l’année en sénologie clinique
Cercle républicain, 5, avenue de l’Opéra, 75001 Paris
Organisateurs : Marc Espié et André Gorins.
Renseignements et inscriptions : Secrétariat scientifique du
Dr Mars Espié, service oncologique et des maladies du sein, hôpital Saint-
Louis, 1, avenue Claude-Vellefaux, 75010 Paris.
Tél. : 01 42 49 92 93.
Nous faisons de vos spécialités
notre spécialité...
Nous faisons de vos spécialités
notre spécialité...
Société du groupe de presse et d'édition santé
1
/
3
100%