LA TYROSINEMIE TYPE I - Faculté de Médecine et de Pharmacie Fès

THESE
PRESENTEE ET SOUTENUE PUBLIQUEMENT LE 10/05/2016
PAR
Mr. GHARNATI KARIM
Né le 01 Décembre 1989 à Fès
POUR L'OBTENTION DU DOCTORAT EN MEDECINE
MOTS-CLES :
Tyrosinémie Type I - fumaryl acétoacétate hydrolase
Insuffisance hépatocellulaire -Nitisinone
JURY
M. HIDA MOUSTAPHA ...............................................................................
Professeur de Pédiatrie
Mme. CHAOUKI SANA ...............................................................................
Professeur de Pédiatrie
Mme. LAKHDAR IDRISSI MOUNIA............................................................
Professeur agrégé de Pédiatrie
Mme. ABOURAZZAK SANA……………………………….............................
Professeur agrégé de Pédiatrie
JUGES
PRESIDENT
LA TYROSINEMIE TYPE I
(à propos de 12 cas)
UNIVERSITE SIDI MOHAMMED BEN ABDELLAH
FACULTE DE MEDECINE ET DE PHARMACIE
FES
UNIVERSITE SIDI MOHAMMED
BEN ABDELLAH
FES
Année 2016 Thèse N° 099/16
ROYAUME DU MAROC
RAPPORTEUR

Tyrosinémie Type I Thèse N° : 099/16
Mr. Gharnati Karim 1
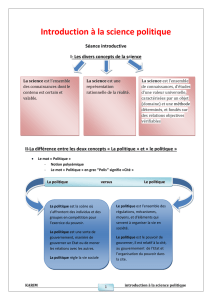
PLAN
INTRODUCTION ................................................................................................ 5
HISTORIQUE ..................................................................................................... 7
MATERIEL ET METHODE ..................................................................................... 9
1-Etude ........................................................................................................ 10
2-Observations ............................................................................................. 11
RESULTATS .....................................................................................................37
DISCUSSION .....................................................................................................39
I.GENETIQUE ....................................................................................................... 40
II.RAPPELS PHYSIOLOGIQUES ET PHYSIOPATHOLOGIQUES .................................... 45
1-Métabolisme de la Tyrosine ....................................................................... 45
2-Effet de la Tyrosine sur l’organisme ........................................................... 46
3-Intérêt du Fumaryl acétoacétate hydrolase (FAH ......................................... 47
4-Conséquences métaboliques ..................................................................... 48
a- L’hypertyrosinémie .......................................................................... 49
b- L’hyperméthioninémie ..................................................................... 49
c- L’hypertyrosylurie ........................................................................... 49
d- Présence de l’inhibiteur (succinyl acétone) ....................................... 50
e- Syndrome de tubulopathie complexe .............................................. 51
f- Autres perturbations ....................................................................... 52
III.ANATOMOPATHOLIGIE .................................................................................... 53
1- Examen Macroscopique ............................................................................ 53
a-Foie .................................................................................................. 53
b-Reins ................................................................................................ 53

Tyrosinémie Type I Thèse N° : 099/16
Mr. Gharnati Karim 2
2- Examen Microscopique ............................................................................ 54
a-Foie .................................................................................................. 54
b-Reins ................................................................................................ 54
IV. EPIDEMIOLOGIE ............................................................................................. 56
V.DIAGNOSTIC POSITIF ....................................................................................... 58
A-Signes cliniques ....................................................................................... 59
1-Signes cardinaux ............................................................................... 59
2-Autres signes .................................................................................... 60
B-Signes biologiques ................................................................................... 63
1-Moyens ............................................................................................. 63
2-Résultats ........................................................................................... 64
C- Signes radiologiques ................................................................................ 66
D-Formes cliniques ...................................................................................... 66
a-Forme aigue ...................................................................................... 66
b-Forme chronique ............................................................................... 67
VI.DIAGNOSTIC DIFFERRENTIEL ........................................................................... 68
VII.TRAITEMENT ................................................................................................. 72
A-Régime Alimentaire .................................................................................. 72
1-Intérêt du régime .............................................................................. 72
2-Principes du régime : ......................................................................... 72
3-Composition du régime ..................................................................... 74
4-Principe du système de part .............................................................. 75
5-Résultats du régime .......................................................................... 77
6-Conduite du régime .......................................................................... 79
B-Traitement Symptomatique ....................................................................... 81

Tyrosinémie Type I Thèse N° : 099/16
Mr. Gharnati Karim 3
C-Traitement par NTBC (2 Nitro-4-Trifluroromethyl-benzoyl) 1,3
cyclohexamédione .................................................................................. 82
D-Transplantation hépatique ....................................................................... 84
VIII.EVOLUTION .................................................................................................. 86
IX.DEPISTAGE ..................................................................................................... 92
CONCLUSION ...................................................................................................94
RESUME .....................................................................................................96
BIBLIOGRAPHIE ................................................................................................ 100

Tyrosinémie Type I Thèse N° : 099/16
Mr. Gharnati Karim 4
LISTE DES ABREVIATIONS
A.F.P : Alpha fœto protéine.
F.A.A : Fumaryl acétoacétate.
F.A.H : Fumaryl acétoacétate.
I.H.C : Insuffisance hépatocellulaire.
M.A.A : Maléyl acétoacétate.
M.H.M : Maladie héréditaire métabolique.
MET : Méthionine.
N.T.B.C : 2 Nitro-4-Trifluroromethyl-benzoyl 1,3 cyclohexamédione.
PHE : phénylalanine.
S.A : succinyl acétone.
T.H.T 1 : Tyrosinémie héréditaire Type I.
TYR : Tyrosine.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
1
/
110
100%