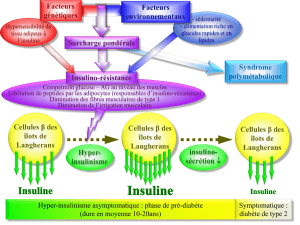
Vie et stress de la cellule bêta-pancréatique

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - nos 5-6 - mai-juin 2012
130
Échos des congrès
© dimension internet
Vie et stress de la cellule bêta-pancréatique
Congrès de la Société francophone du diabète
Nice, 20-23 mars 2012
Bertrand Duvillié*
Glucagon : un acteur souvent négligé
dans le contrôle glycémique
Le Pr Pierre Lefebvre (Liège, Belgique) a présenté un
symposium qui visait à définir la place du glucagon
dans le contrôle glycémique et dans le diabète.
Le glucagon, hormone hyperglycémiante, a été
découvert par Piero Foa. Ses effets sur le foie sont
les suivants : il augmente la glycogénolyse et la
gluconéogenèse, et diminue la glycolyse et la gly-
cogenèse. Le glucagon est responsable de 75 % de
la production hépatique de glucose. Chez un sujet
sain, le glucose entraîne une augmentation de la
sécrétion d’insuline et une baisse de la sécrétion de
glucagon. En revanche, chez les patients atteints de
diabète de type 2 (DT2), il induit une augmentation
modeste de la sécrétion d’insuline, associée à une
nette augmentation de la sécrétion de glucagon.
L’équilibre entre la sécrétion d’insuline et celle de
glucagon n’est donc plus respecté chez le patient
diabétique, et cela conduit à une hyperglycémie.
Lorsque des îlots de Langerhans humains sont culti-
vés en présence de concentrations croissantes de
glucose, on peut mesurer des sécrétions d’insuline
qui oscillent. Les sécrétions de glucagon oscillent
également, mais dans un sens opposé à celui de
l’insuline : quand l’insuline augmente, le glucagon
baisse, et vice versa. En résumé, les sécrétions d’insu-
line et de glucagon sont pulsatiles et antiparallèles.
Des expériences sur l’animal ont confirmé le rôle
important du glucagon dans l’apparition de l’hyper-
glycémie. Lorsqu’on injecte de l’alloxane – un agent
pharmacologique qui détruit les cellules β – à des
porcs, les niveaux d’insuline s’effondrent, mais, de
façon surprenante, ceux de glucagon restent trop
élevés et participent à l’hyperglycémie. De façon
intéressante, les patients DT2 ont des pulses d’insu-
line qui diminuent et des pulses de glucagon qui
augmentent. En fait, l’association entre les pulses
d’insuline et ceux de glucagon est perdue chez
ces patients. Enfin, la preuve d’un rôle majeur du
glucagon est apportée par les travaux de Unger
et Cherrington. Ces auteurs ont généré des souris
portant une mutation du récepteur au glucagon.
La destruction totale des cellules β chez ces souris
déficientes pour le récepteur au glucagon n’entraîne
pas de diabète. Cela prouve que la déficience de
signalisation par le glucagon protège ces souris
d’une hyperglycémie. Le Pr Lefèbvre conclut donc
que pendant des années, une théorie fondée sur
l’“insulinocentrisme” a été développée. Pourtant,
l’insuline ne serait que la partie émergée de l’ice-
berg, et nous avons désormais un grand nombre
d’arguments en faveur d’un rôle majeur du glucagon
dans le contrôle glycémique et dans l’apparition
du diabète.
* U845 Inserm,
faculté de médecine
Neker-Enfants-malades,
Paris.
Le congrès de la Société francophone du diabète s’est tenu à Nice, sous la prési-
dence du Pr Alexandre Fredenrich. Environ 4 500 participants s’y sont retrouvés
afin de présenter et de discuter les dernières données sur la prise en charge et
l’éducation thérapeutique des patients, ainsi que leur suivi quotidien. Ce congrès
a également fait état des derniers progrès en matière de recherche fondamentale.
En effet, des sujets concernant la biologie de la cellule β pancréatique, les méca-
nismes qui gouvernent la sécrétion d’insuline et de glucagon, et les possibilités
de remplacement des cellules β ont été traités.

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - nos 5-6 - mai-juin 2012
131
Vie et stress de la cellule bêta-pancréatique
Effets du chlorure de zinc sur la survie
des îlots de rat, face à des concentrations
extrêmes de glucose (PO18)
Une autre question majeure pour prévenir le diabète
est la préservation des cellules β. Le laboratoire du
Dr Jonas (Bruxelles, Belgique) s’intéresse aux effets de
concentrations élevées de glucose sur les cellules des
îlots de Langerhans. Son étudiante, J. Duprez, a présenté
ses derniers travaux.
La survie des îlots de rat en culture dépend de la
concentration de glucose dans le milieu. Elle est opti-
male à 10 mmol/l de glucose, mais l’apoptose des
cellules augmente lorsque la concentration de glucose
est très basse (5 mmol/l) ou très élevée (30 mmol/l).
L’addition de chlorure de zinc (ZnCl2) réduit l’apoptose
de 50 % à 5 mmol/l de glucose, et de 75 % lorsque le
milieu contient 30 mmol/l de glucose. On peut remar-
quer que le zinc réduit considérablement le stress oxy-
datif mitochondrial des cellules lorsque le milieu de
culture contient des concentrations extrêmes de glu-
cose. De plus, le ZnCl2 induit l’expression du gène de
la métallothionéine 1 (MT1), un facteur de réponse au
stress oxydant. En conclusion, ces données montrent
que le ZnCl2 améliore la survie des cellules des îlots
et réduit le stress oxydatif. Toutefois, les premières
données de ces auteurs n’indiquent pas que la fonc-
tionnalité des cellules β – sécrétion d’insuline – est
améliorée en présence de ZnCl2. Ce point important
devra donc être examiné plus en détail.
Sécrétion de VEGF
par les îlots de Langerhans :
quel est l’effet du liraglutide (PO19) ?
Le protocole d’Edmonton consiste à greffer des îlots
chez des patients atteints de diabète de type 1 (DT1).
Ces essais cliniques ont donné des résultats encou-
rageants à court terme, mais pas à long terme. En
effet, 1 an après la greffe, 90 % des patients étaient
insulino- indépendants et avaient une glycémie nor-
male. Toutefois, 5 ans après la greffe, seuls 10 % des
patients restaient normoglycémiques. L’un des élé-
ments responsables de la diminution dans le temps
de la survie et de la fonction du greffon pourrait
être la vascularisation des îlots. Le Dr A. Langlois
(Strasbourg, France) a évalué l’effet du liraglutide sur
la physiologie des îlots de rat et sur la production de
VEGF. A. Langlois a montré que le liraglutide stimule
la sécrétion d’insuline et la production de VEGF par
les îlots. Ces données suggèrent que le liraglutide
pourrait être utilisé pour améliorer les greffes d’îlots
chez l’homme. Néanmoins, des expériences menées
in vivo sur l’animal sont nécessaires pour valider et
préciser cette hypothèse avant de pouvoir envisager
des applications cliniques.
Architecture cellulaire
des îlots pancréatiques humains :
vers l’idée d’une organisation
fonctionnelle
Lors d’une présentation orale, le Dr D. Bosco a montré
que l’architecture des îlots de Langerhans n’était pas
seulement une affaire d’esthétique. Les îlots sont des
organoïdes très vascularisés, qui contiennent des cel-
lules endocrines reliées entre elles par des molécules
d’adhésion et par une lame basale. L’architecture des
îlots a d’abord été étudiée chez les rongeurs. On trouve
chez le rat et chez la souris des cellules β en position
centrale de l’îlot, et des cellules α en périphérie. Les
îlots sont le siège d’un flux sanguin important, et les
interactions entre les cellules α et β sont réalisées
par une voie endocrine. Dans les îlots humains, les
contacts intercellulaires hétérotypiques semblent
prédominants. Ils favorisent la communication entre
les cellules α et β. En effet, dans les îlots humains, les
cellules α ne sont pas situées uniquement en périphé-
rie des îlots. Les cellules β sont groupées à l’intérieur
des îlots en sous-unités, elles-mêmes entourées de
cellules α. Cette structure favorise le mélange et les
interactions entre les cellules α et β. Il a été montré
récemment que les cellules α produisent des protéines
de la lame basale qui agissent sur la fonction des cel-
lules β. Ces interactions cellulaires hétérotypiques
sont nécessaires pour la sécrétion d’insuline. En effet,
D. Bosco et al. ont montré que les cellules α produisent
de la laminine 332, qui va participer à la formation
de la lame basale. Les cellules β vont produire des
intégrines α6β1 et α3β1, qui vont interagir avec la
laminine 332. Lorsqu’on cultive des îlots dans une
matrice cellulaire 804G, qui contient de la laminine
332, la sécrétion d’insuline est stimulée. En revanche,
lorsque des anticorps anti-intégrine α6β1 ou antila-
minine 332 sont ajoutés, la sécrétion d’insuline est
réduite. D. Bosco et al. ont également souligné que
l’architecture des îlots joue un rôle important sur le
plan fonctionnel lorsque les îlots sont greffés. De façon
générale, ce nouveau concept d’un rôle fonctionnel
de l’architecture des îlots devra être mieux considéré à
l’avenir dans un cadre thérapeutique, afin d’améliorer
la greffe d’îlots chez les patients diabétiques.
■
1
/
2
100%