Extraction, séparation et identification d`espèces chimiques

La santé: Les médicaments
Extraction, séparation et identification d'espèces chimiques
Notions et contenus
Compétences attendues
Extraction, séparation et identification d’espèces chimiques.
Aspect historique et techniques expérimentales.
Caractéristiques physiques d'une espèce chimique : aspect,
température de fusion, température d’ébullition, solubilité, densité,
masse volumique.
Interpréter les informations provenant d’étiquettes et de divers
documents.
I) Extraction et séparation d'espèces chimiques
1) Nécessité de l'extraction
L'histoire des médicaments est indissociable de la botanique. Les remèdes les plus anciens étaient
constitués de cataplasmes emplâtres et décoctions à base de plantes.
Ce que nous appelons aujourd'hui les remèdes de grand-mère ont inspiré (et le mot est faible) toute la
pharmacologie actuelle.
La principale différence dans la prise de remède réside dans le fait qu'aujourd'hui nous ne sommes plus
obligés d'avaler de grands bols de potions au goût fort désagréable ou de nous frotter la peau avec des
substances très odorantes et pas toujours ragoutantes.
Il a donc fallu trouver des moyens d'extraire le principe actif des plantes.
2) Histoire de l'aspirine
Son histoire a plus de 4000 ans. C'est le médicament le plus consommé au monde. Aujourd'hui encore on lui découvre de
nouvelles propriétés.
Son parcours commence il y a plusieurs millénaires avec les Sumériens qui utilisaient les feuilles de saule comme antidouleur.
On retrouve les traces de l'utilisation de décoction de feuilles de saule blanc dans un papyrus égyptien datant de 1550 av.JC.
Vers l'an 400 avant JC, Hippocrate (-460,-377) préconisait une préparation à partir de l'écorce de saule blanc pour soulager
les douleurs de l'accouchement et faire baisser la fièvre. L'utilisation empirique des feuilles et de l'écorce de saule pour soigner
fièvres et douleurs se poursuit jusqu'au 19ème siècle. Les progrès réalisés en chimie d'extraction et d'analyse permettent alors
d'isoler et d'identifier les principes actifs, c'est à dire les molécules responsables des propriétés thérapeutiques de ces remèdes.
Ainsi en 1825, M.Fontana, un pharmacien Italien isole le principe actif du saule blanc et le nomme salicine. En 1829, un
pharmacien de Vitry le François, PJ. Leroux fait bouillir de la poudre d'écorce de saule de l'eau et concentre sa préparation. Il
obtient des cristaux blancs qu'il baptise salicyline. (Salix = Saule). La substance est expérimentée par Magendie (1783-1855),
neurologue à l'hôtel Dieu à Paris.
En 1835, K.Lowig isole et identifie l'acide Salicylique comme étant le principe actif d'une autre plante possédant des propriétés
antipyrétiques, la reine des près ou "spirée ulmaire". Peu après R.Piria de l'université de Pise (Italie) retrouve cette substance
à partir de la salicyline qu'il identifie comme étant le résultat de la condensation de l'alcool orthohydrobenzylique et du
glucose.
L'acide salicylique est utilisée pour les fièvres, les douleurs, les rhumatismes articulaires mais provoque des brûlures
d'estomac, une saveur très désagréable et l'irritation de la bouche.
En 1853, le Français C.Gerhardt à Montpellier réalise la synthèse de l'acide acétylsalicylique.
C'est finalement en 1887 que F.Hoffmann, chimiste Allemand employé chez Bayer trouve le moyen d'obtenir de l'acide
acétylsalicylique presque pur. Il faut dire que son père souffrait d'un rhumatisme chronique et il fut soigné à l'acide salicylique,
amer et gastro-toxique.
L'acide acétylsalicylique s'avère être beaucoup mieux toléré. En février 1899, Bayer dépose la marque Aspirin
: "A" pour
Acide et "Spir" pour l'acide spirique, identique à l'acide salicylique et extrait de la Reine des près. C'est en 1900 que les
premiers comprimés sont fabriqués.
Le brevet est déposé en 1900 aux USA et Bayer fait fortune. L'aspirine est commercialisée en France en 1908 par la société
chimique des usines du Rhône.
On en synthétise aujourd'hui plus de 10 000 tonnes par an, et ce médicament a même accompagné en 1969 les astronautes sur
la lune. En outre, il faut noter qu'une clause spéciale concernait l'aspirine lors du traité de Versailles en 1918: l’Allemagne
perd la propriété de tous ses brevets et l’aspirine de Bayer tombe ainsi dans le domaine public.
Source: http://www.benjamin-monteil.com/l_aspirine/aspirine_histoire.htm
Quelle est la première façon d'ingérer l'aspirine?
Qui réalise la première extraction du principe actif contenu dans les feuilles et l'écorce de saule?
Comment le nomme-t-il?

La santé: Les médicaments
Expliquer ce qui se passe lorsque P.J. Leroux fait bouillir de la poudre d'écorce de saule dans de
l'eau.
Quel inconvénient présente la salicyline? Comment y remédiera-t-on?
3) Techniques d'extraction
Elles sont diverses mais reposent toutes sur le même principe: la solubilité de la substance à extraire dans
un solvant.
a) Extraction par solvant
C'est la technique la plus utilisée pour la préparation des huiles essentielles utilisées en aromathérapie.
La plante contenant la substance à extraire est placée dans un liquide qui a la propriété de bien dissoudre le
principe actif. Petit à petit (et d'autant plus rapidement si le milieu est agité), le principe actif va "quitter" la
plante et se retrouver en solution dans le solvant.
Par évaporation ultérieure de ce solvant, on va récupérer le principe actif.
Inconvénient: le solvant ne dissout pas en général que le principe actif. Il y a donc beaucoup d'impuretés et
il faut souvent procéder à une seconde extraction liquide-liquide.
b) Extraction liquide-liquide
Elle est souvent la deuxième phase d'une extraction par chauffage à reflux.
La solution, en général aqueuse, contenant le principe actif mais aussi nombre d'impuretés est placée dans
une ampoule à décanter. On ajoute un solvant (solvant extracteur) qui doit posséder deux propriétés:
Etre un bon solvant pour le principe actif et un mauvais solvant pour les impuretés
Ne pas être miscible avec la première phase (en général la phase aqueuse).
Après agitation, le principe actif ayant une affinité pour le solvant extracteur se retrouve dans cette phase
alors que les impuretés restent dans la première phase.
Par évaporation ultérieure de ce solvant, on va récupérer le principe actif.
c) Hydrodistillation ou entraînement à la vapeur
Les plantes sont placées dans un récipient avec de l'eau. On porte le tout à ébullition.
Les principes actifs, peu solubles à froid dans l'eau le sont bien davantage à chaud.
Une ouverture permet aux vapeurs de s'échapper. Ces vapeurs sont majoritairement de la vapeur d'eau mais
contiennent aussi le principe actif. On dit donc que la vapeur d'eau entraîne les substances actives d'où le
nom de la technique.
Ces vapeurs sont ensuite refroidies et se condensent donc. Par gravité, on va les récupérer dans un
récipient.
Ce distillat contient donc de l'eau mais aussi les principes actifs qui se séparent puisqu'ils sont
généralement peu solubles dans l'eau à froid.
S'ils sont trop solubilisés dans l'eau, on peut procéder ensuite à une extraction liquide-liquide.

La santé: Les médicaments
Schéma d'un alambic pour l'extraction de
l'huile essentielle de lavande
Alambic en cuivre
Légender le schéma ci-contre:
1:
2:
3:
4:
5:
6:
7:
8:
9:
10:
Montage utilisé au laboratoire
II) Identification d'espèces chimiques
1) Corps purs et mélanges
Un corps pur est constitué d'une seule espèce chimique alors qu'un mélange en contient plusieurs.
Exemple: Identifier les corps purs et les mélanges dans la liste ci-dessous:
vin; glaçon; sucre en poudre; sel, sirop de menthe; encre; bicarbonate de soude; eau distillée; eau
minérale; fil électrique en cuivre; emballage en polystyrène; vinaigrette.
Un corps pur est caractérisé par certaines caractéristiques physiques qui lui sont propres. Elles constituent
en quelque sorte sa carte d'identité.

La santé: Les médicaments
2) Températures de changement d'état
Dans quels états physiques peuvent exister les corps purs?
A quelle température la glace fond elle?
On dira alors que la température de de
l'eau est θf = 0°C à pression atmosphérique
A quelle température l'eau bout elle?
On dira alors que la température de de
l'eau est θeb = 100°C à pression atmosphérique.
Tout corps pur est caractérisé par des températures de changement d'état. Celles-ci dépendent de la pression
(en montagne, l'eau bout en dessous de 100 °C), surtout pour la température d'ébullition.
Ces températures sont données dans des tables.
On mesure la température d'ébullition d'un corps grâce au thermomètre placé en haut de la colonne
de distillation.
On mesure la température de fusion d'un corps grâce au banc Kofler (voir TP).
Remarque: Il n'existe pas de corps pur parfait. Toute substance contient en quantité plus ou moins
importante des impuretés ce qui a une influence sur les températures de changement d'état.
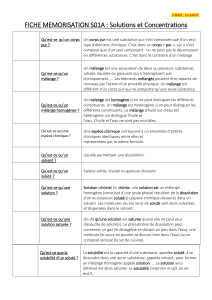
3) Solubilité
La solubilité est la quantité maximale de substance que l'on peut dissoudre dans un litre de solution.
Lorsque la limite est atteinte, on dira que la solution est saturée.
Exemple: la solubilité du chlorure de sodium dans l'eau est de 360 g.L-1 à 20°C.
Que devient cette solubilité à 60°C?
Quand la température augmente, la solubilité d'une substance .
On voit ici que la solubilité du chlorure de sodium dans l'eau est grande.
Mais ce n'est pas le cas pour toutes les substances.
La solubilité de l'aspirine dans l'eau "pure" (pH = 7) est, par exemple de 3,3 g.L-1 à 25°C.
La solubilité d'une substance dépend aussi du solvant.
Ainsi l'eugénol est peu soluble dans l'eau mais très soluble dans le cyclohexane.
4) Densité et masse volumique
La masse volumique d'un corps est la masse par unité de volume de ce corps.
Notation: ρ, unité SI: kg.m-3. On peut utiliser d'autres unités comme le g.L-1 ou g.mL-1 ou kg.L-1…
Quelle est la masse volumique de l'eau à 4°C? ρ = kg.L-1 = kg.m-3
La densité (d) d'un corps est le rapport de la mase volumique de ce corps par la masse volumique
d'un corps de référence qui est l'eau. La densité n'a pas d'unité car c'est un rapport de deux
grandeurs identiques.
Relations: soit un corps A de masse m et de volume V. Alors ρA =
et dA =
L'eucalyptol, liquide à température ambiante est utilisé pour ses propriétés décongestionnantes dans le
traitement des affections comme les rhumes ou bronchites.
Un volume V = 10 mL d'eucalyptol a une masse m = 9,24 g.
Calculer la masse volumique de l'eucalyptol ainsi que sa densité.
L'eucalyptol est très peu soluble dans l'eau. Lors de l'extraction de l'eucalyptol des feuilles d'eucalyptus,
l'huile essentielle obtenue est placée dans une ampoule à décanter.
Représenter l'ampoule en indiquant la nature et la composition des phases.
1
/
4
100%