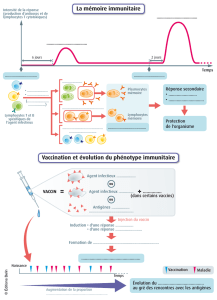
Dépôt Institutionnel de l`Université libre de Bruxelles
publicité

Dépôt Institutionnel de l’Université libre de Bruxelles / Université libre de Bruxelles Institutional Repository Thèse de doctorat/ PhD Thesis Citation APA: Vekemans, J. (2001). Etude des réponses immunes du nouveau-né humain vis-à-vis d'antigènes microbiens (Unpublished doctoral dissertation). Université libre de Bruxelles, Faculté de Médecine – Médecine, Bruxelles. Disponible à / Available at permalink : https://dipot.ulb.ac.be/dspace/bitstream/2013/211537/1/f3d79805-5999-4ee1-842d-276495cf7e1c.txt (English version below) Cette thèse de doctorat a été numérisée par l’Université libre de Bruxelles. L’auteur qui s’opposerait à sa mise en ligne dans DI-fusion est invité à prendre contact avec l’Université ([email protected]). Dans le cas où une version électronique native de la thèse existe, l’Université ne peut garantir que la présente version numérisée soit identique à la version électronique native, ni qu’elle soit la version officielle définitive de la thèse. DI-fusion, le Dépôt Institutionnel de l’Université libre de Bruxelles, recueille la production scientifique de l’Université, mise à disposition en libre accès autant que possible. Les œuvres accessibles dans DI-fusion sont protégées par la législation belge relative aux droits d'auteur et aux droits voisins. Toute personne peut, sans avoir à demander l’autorisation de l’auteur ou de l’ayant-droit, à des fins d’usage privé ou à des fins d’illustration de l’enseignement ou de recherche scientifique, dans la mesure justifiée par le but non lucratif poursuivi, lire, télécharger ou reproduire sur papier ou sur tout autre support, les articles ou des fragments d’autres œuvres, disponibles dans DI-fusion, pour autant que : - Le nom des auteurs, le titre et la référence bibliographique complète soient cités; - L’identifiant unique attribué aux métadonnées dans DI-fusion (permalink) soit indiqué; - Le contenu ne soit pas modifié. L’œuvre ne peut être stockée dans une autre base de données dans le but d’y donner accès ; l’identifiant unique (permalink) indiqué ci-dessus doit toujours être utilisé pour donner accès à l’œuvre. Toute autre utilisation non mentionnée ci-dessus nécessite l’autorisation de l’auteur de l’œuvre ou de l’ayant droit. ------------------------------------------------------ English Version ------------------------------------------------------------------This Ph.D. thesis has been digitized by Université libre de Bruxelles. The author who would disagree on its online availability in DI-fusion is invited to contact the University ([email protected]). If a native electronic version of the thesis exists, the University can guarantee neither that the present digitized version is identical to the native electronic version, nor that it is the definitive official version of the thesis. DI-fusion is the Institutional Repository of Université libre de Bruxelles; it collects the research output of the University, available on open access as much as possible. The works included in DI-fusion are protected by the Belgian legislation relating to authors’ rights and neighbouring rights. Any user may, without prior permission from the authors or copyright owners, for private usage or for educational or scientific research purposes, to the extent justified by the non-profit activity, read, download or reproduce on paper or on any other media, the articles or fragments of other works, available in DI-fusion, provided: - The authors, title and full bibliographic details are credited in any copy; - The unique identifier (permalink) for the original metadata page in DI-fusion is indicated; - The content is not changed in any way. It is not permitted to store the work in another database in order to provide access to it; the unique identifier (permalink) indicated above must always be used to provide access to the work. Any other use not mentioned above requires the authors’ or copyright owners’ permission. UNIVERSITE LIBRE DE BRUXELLES Faculté de Médecine ETUDE DES REPONSES IMMUNES DU NOUVEAU-NE HUMAIN VIS-A-VIS D’ANTIGENES MICROBIENS Johan Vekemans B _ Campus SrScÆlBât-E) ' B-1070 Bruxelles Laboratoire d’immunologie Expérimentale, ULB Laboratoire de Parasitologie, ULB Service d’Immuno-allergologie, Université de Florence, Italie Medical Research Council Laboratories, The Gambia Thèse présentée en vue de l’obtention du titre de Docteur en Sciences Médicales 2001 UNIVERSITE LIBRE DE BRUXELLES Faculté de Médecine ETUDE DES REPONSES IMMUNES DU NOUVEAU-NE HUMAIN VIS-A-VIS D’ANTIGENES MICROBIENS Johan Vekemans Laboratoire d’immunologie Expérimentale, ULB Laboratoire de Parasitologie, ULB Service d’Immuno-allergologie, Université de Florence, Italie Medical Research Council Laboratories, The Gambia Thèse présentée en vue de l’obtention du titre de Docteur en Sciences Médicales 2001 11 ■I fc=: ■-friTifn'W ■jl 11 ' Il Il II II '. ’ Si Johanne Il -■ Il h II II II II I Il II 11 I II Il I' II h II II Je remercie le Fonds National de la Recherche Scientifique pour le soutien financier dont j’ai disposé. Je remercie Arnaud Marchant pour deux années passionnantes en Gambie, et pour ses efforts à les rendre fructueuses. Merci à Tessa Goetghebuer pour son aide et sa porte ouverte. Merci à Michel Goldman, qui a généreusement accepté d’être mon promoteur de thèse. Merci à Jamila Ismaili pour toute son aide, et à mon papa Marcel pour ses conseils en écriture. Je remercie Dominique Bron, qui m’a guéri et fait faire mes premiers pas dans un laboratoire, m’offrant deux nouvelles vies dont je profite chaque jour. Je remercie Yves Carlier de m’avoir envoyé en Bolivie. Merci également à Carine Truyens, avec qui j’ai beaucoup apprécié travailler. Muchas gracias a Faustino Torrico, Marco Solano, Patricia Rodriguez y Mary-Cruz Torrico por los dias felices de Cochabamba. Grazie a Gianfranco Del Prete, Amadeo Amadei y Mario D’Elios que me hanno fatto scoprire la cultura dei lymfociti, Firenze e la vera pizza con passione. Many thanks to Martin Ota. Except on Sundays, our steps were never far apart in the field, the lab, the clinic or on the football pitch. Thanks also to Keith McAdam, Hilton Whittle, Tumani Corrah, Gareth Morgan and Mike Kidd for their support in the research and in the clinic. To Kebbe Bunja, Isatou Drammeh, Mamadi Siddibeh and Momodou Jobe, Abaracca! for your excellent field and lab work in The Gambia. Merci à Sowsan Atabani et Giorgio Sirugo. Avec les gâteaux de l’une et les poissons de l’autre, j’étais un homme comblé sous le soleil. Je remercie les infirmières de la maternité San Simon de Cochabamba, en Bolivie, et du centre de santé de Serrekunda, en Gambie, où nous avons enrôlé les nouveau-nés des différentes études présentées ici. Enfin, je remercie toutes les mères qui ont accepté de participer aux travaux présentés. Puisse cette étude leur rendre honneur. « Je dis que chaque homme, depuis le temps de sa naissance jusqu’au vieil âge, tend continuellement vers la sécheresse. Pour cette raison, le sang de l'enfant est bien plus humide que celui du jeune homme, et encore bien plus que celui du vieillard. La variole survient quand le sang fermente et putréfie. Les vapeurs superflues sont alors rejetées, et le sang moisi de l'enfant se transforme en sang mur de jeune homme. Le sang du vieillard est comme le vin qui a perdu sa force, qui tourne au vinaigre et perd tout intérêt. Pour cette raison, les enfants, surtout les garçons, échappent rarement à la variole, car il est impossible d’empêcher le sang, comme la moisissure, de changer. » Abu Bakr Muhammad ibn Zakariya al-Razi Médecin, philosophe et alchimiste perse décédé en 932 TABLE DES MA TIERES 1 4 RESUME INTRODUCTION............................................................................................................ GENERALITES 1. 7 8 8 Vaccination du nourrisson : succès et obstacles 2. Age de vaccination, âge d’exposition 9 PRESENTATION DE L’ANTIGENE EN DEBUT DE VIE 11 1. Fonctions des cellules présentatrices de l’antigène H 2. Induction de la réponse immune adaptative des lymphocytes T auxiliaires 12 3. Immaturité des cellules présentatrices de l’antigène chez le nouveau-né 14 IMMUNITE CELLULAIRE EN DEBUT DE VIE 16 1. Fonctions des lymphocytes T auxiliaires 16 2. Réponses des lymphocytes auxiliaires aux alloantigènes 18 3. Réponses des lymphocytes auxiliaires aux antigènesde rappel 19 4. Fonctions des lymphocytes T cytotoxiques 24 IMMUNITE HUMORALE EN DEBUT DE VIE 27 1. Principes de l’induction des réponses humorales 27 2. Particularités des lymphocytes B chez le nouveau-né 28 3. Réponses humorales aux vaccins et aux infections en début de vie 29 4. Transfert trans-placentaire d’immunoglobulines et immunisation maternelle 33 2 37 MODULATION PRE- ET POST-NATALE DU SYSTEME IMMUNITAIRE 1. Environnement immunologique de la grossesse 37 2. Modulation prénatale des réponses immunes du nourrisson 39 3. Modulation postnatale des réponses immunes du nourrisson 41 BUTS DU TRA VAIL................................................................................ 43 RESULTATS............................................................................................ 45 1. La vaccination néonatale par le bacille de Calmette-Guérin induit la production dTFN-y par les lymphocytes CD4 46 2. Réponse immune du nourrisson au vaccin oral contre la poliomyélite 47 3. Réponse immune du nourrisson au vaccin contre l’hépatite B 48 4. La vaccination par le bacille Calmette-Guérin promeut la réponse immune à 49 d’autres vaccins du nourrisson 5. L’infection maternelle à Trypanosoma cruzi module la capacité de nouveau- 51 nés non infectés à produire des cytokines pro- et anti-inflammatoires DISCUSSION GENERALE ET PERSPECTIVES................................. 52 1. Capacité des nouveau-nés et nourrissons à développer des réponses immunes vaccinales de type Thl et Th2 54 2. L’administration précoce du BCG peut moduler le développement de réponses immunes adaptatives à d’autres antigènes 60 3. Modulation du système immunitaire inné du nouveau-né par une infection chronique maternelle 62 4. Vers de nouvelles indications cliniques du BCG ? 63 5. Obstacles aux développements de la vaccinologie néonatale 64 BIBLIOGRAPHIE..................................................................................... 67 THESE ANNEXE..................................................................................... 87 3 RESUME Les décès liés à des causes infectieuses survenant au cours des premiers mois de la vie pourraient être en partie évités par la vaccination précoce. Pour être efficaces, les vaccins doivent induire une immunité protectrice chez le nourrisson avant qu’il ne soit exposé aux agents pathogènes infectieux. Or, l’immaturité du système immunitaire du nourrisson empêche dans certains cas le succès de la vaccination. Les lymphocytes T auxiliaires (Th) jouent un rôle important dans l’orchestration de la réponse immunitaire. On distingue les réponses de type Thl, caractérisées par la production d’IFN-y et essentielles au contrôle d’infections par des germes intracellulaires, et les réponses de type Th2 caractérisées par la production d’interleukine (IL)-4 et d’IL-5, impliquées dans l’aide à la synthèse d’immunoglobulines et le contrôle d’infections par des helminthes. Chez le souriceau nouveau-né, on observe une faible capacité à développer des réponses de type Thl et le développement préférentiel de réponses Th2. Chez l’homme, on sait peu de choses sur les caractéristiques des réponses immunes cellulaires initiées en début de vie. Peu de travaux se sont attelés à rechercher des facteurs in vivo susceptibles d’influencer le développement des réponses immunes du jeune nourrisson. Dans ce travail, nous présentons des résultats d’études prospectives qui portent sur la caractérisation des réponses immunes aux vaccins administrés dès la naissance, à savoir les vaccins anti-poliomyélite, anti-hépatite B et BCG. Nous avons comparé ces réponses à celles observées chez des adultes immuns. Nous nous sommes aussi intéressés à la modulation des réponses immunes du nourrisson par le vaccin BCG et par une infection maternelle durant la grossesse, l’infection à Trypanosoma cruzi. En réponse au vaccin contre la poliomyélite, on observe chez le nourrisson une production d’IFN-y et une réponse proliférative plus faible que chez l’adulte. Les nourrissons présentent également un déficit de production d’IFN-y en réponse au vaccin contre l’hépatite B. On ne détecte néanmoins pas plus de cytokines Th2 chez le nourrisson que chez l’adulte suite à la vaccination contre la poliomyélite et contre l’hépatite B. En réponse aux deux vaccins, les nourrissons produisent par contre des quantités d’anticorps supérieures aux adultes. 5 La vaccination du nouveau-né par le BCG induit la production d’IFN-y par des lymphocytes CD4. Chez le nourrisson vacciné et chez l’adulte immun, on mesure des taux similaires de cytokines Thl et Th2. Une analyse clonale démontre l’absence de biais Th2 chez le nourrisson après vaccination au BCG. Ayant démontré l’induction par le BCG d’une réponse à prédominance Thl dès la naissance, nous avons étudié l’effet de la vaccination par le BCG sur les réponses immunes aux autres vaccins administrés au nourrisson. Nous avons pu observer que la vaccination au BCG promeut les réponses humorales et cellulaires aux vaccins contre l’hépatite B, le tétanos et la poliomyélite. Le système immunitaire néonatal peut être influencé par des facteurs intra-utérins. Nous avons observé que l’infection maternelle à Trypanosoma cruzi {T. cruzi) induit chez le nouveau-né non infecté une capacité accrue à produire des facteurs pro- et anti-inflammatoires. Nos observations montrent qu’un déficit de production d’IFN-y après vaccination du nourrisson humain peut être observé dans certains cas, comme chez la souris. Ce déficit n’est néanmoins pas systématique, puisque le BCG néonatal induit la production de taux élevés d’IFN-y. Contrairement aux observations faites chez la souris, nous n’avons pas retrouvé d’élévation de la production de cytokines Th2 chez le nourrisson. Il n’existe donc pas de biais Th2 systématique en réponse à la vaccination néonatale chez l’homme. Chez la souris, une réponse de type Thl peut être initiée dans des conditions optimales de présentation de l’antigène. L’activation d’une réponse productrice d’IFN-y par le BCG néonatal dépend probablement de ses propriétés stimulatrices des cellules présentatrices de l’antigène. L’activation des cellules dendritiques représente probablement une voie d’avenir pour l’activation de réponses Thl chez le nourrisson. Les stratégies d’activation du système immunitaire en début de vie doivent prendre en considération l’influence d’événements prénatals comme l’infection maternelle à T. cruzi et d’expositions post-natales à des immunogènes tels que le BCG sur le développement des réponses immunes chez le nourrisson. 6 INTRODUCTION Rgure. 1 Progrès majeurs obtenus grâce à la vaccination. Aux Etats-Unis, le nombre de cas rapportés de diphtérie (A), de polio (B) et de rougeole (C) par 100.000 habitants a énormément diminué grâce aux stratégies de vaccination. En D, on peut voir le nombre de pays rapportant un ou plusieurs cas de variole par an, avant la déclaration officielle d'éradication, en 1979. Adapté de "Janeway, C. and P.Travers. Basic concepts in immunology. 1997. In: Immunobiology, the immune system in heaith and disease. P. Austin, E. Lawrence and M. Robertson, eds.Current Biology LtdVGarland Publishing Inc. London, UK". 100 10 A 1.0 0.1 1900 1910 1920 1930 1940 1950 1960 1970 1980 1990 40 30 10 0 1940 1950 1960 1970 1980 1990 600 500 400 C 300 200 100 0 1960 1965 1970 1975 1980 1985 1990 30 D 15 0 1965 1970 1975 1960 Figure 2. Bien que la vaccination permette d'en éviter un grand nombre, des cas de maladies et de décès dûs aux infections prévenables par la vaccination surviennent encore, surtout en pays en voie de développement. Estimation de 1995 (référence 3). Poliomyelitis I. GENERALITES 1. Vaccination du nourrisson : succès et obstacles L’éradication de la variole représente un succès historique des stratégies de contrôle des maladies infectieuses par la vaccination. La perspective d’éradication prochaine de la poliomyélite et les 3 millions de morts évités chaque année grâce à la vaccination contre la rougeole, le tétanos et la coqueluche récompensent les efforts de recherche rendant ces stratégies possibles (figure 1) De même, les vaccins contre l’hépatite B et contre VHaemophilius influenzae de type b ont permis une réduction massive des pathologies dues à ces germes là où ils ont été distribués largement ’. Malheureusement, ces succès sont tempérés par de nombreuses difficultés à contrôler les maladies infectieuses pédiatriques, surtout dans les régions du monde en voie de développement (figure 2). Bien qu’il ait été démontré que les coûts associés aux programmes de vaccination représentent une économie par rapport aux coûts de santé en l’absence de programmes de vaccination, l’instabilité économique représente un obstacle majeur à l’implantation de programmes de vaccination efficaces En Afrique sub-Saharienne, environ 15% des problèmes de santé en dessous de 5 ans sont encore attribués à des infections qui peuvent être prévenues par la vaccination Dans la table 1, nous présentons la liste des pathogènes responsables d’une grande morbidité et mortalité en pays développés et en pays en voie de développement. On peut noter que dans les pays en voie de développement, le nombre de pathogènes importants est plus grand. Aujourd’hui, malgré les succès enregistrés, on n’est pas parvenu à un contrôle satisfaisant de certaines infections dues à des germes contre lesquels un vaccin existe. En effet, dans de nombreux pays, des coûts élevés empêchent la décision d’inclure certains vaccins pourtant démontrés efficaces (comme les vaccins contre l’hépatite B ou VHaemophilius influenzae de type b) dans les programmes nationaux de vaccination de pays souvent les plus touchés (figure 3). Un vaccin contre la tuberculose existe, mais son efficacité est variable. De nouveaux vaccins (contre l’infection à pneumocoque et à méningocoque) ont été récemment développés, mais leur place dans les programmes nationaux de vaccinations n’ont pas encore été clairement définie. De nombreux vaccins restent à développer. On estime que la découverte d’un nombre limité de vaccins (contre le virus respiratoire syncitial. 8 Table 1. Agents pathogènes actuellement importants en période infantile. Bactéries Pays industrialisés Pays en voie de développement Streptococcus pneumoniae * Streptococcus pneumoniae * Haemophilius influenzae * Haemophilius influenzae * Staphylococcus Staphylococcus Streptocoque de groupe B Neisseria meningitidis * Listeria monocytogenes Clostridium tetani * Autres bactéries Gram négatives Clostridium diphteriae * Streptocoque de groupe A Bordetella pertussis * Autres bactéries Gram négatives Virus Virus Respiratoire Syncytial Virus Respiratoire Syncytial Rotavirus, Enterovirus Rotavirus, Enterovirus Cytomégalovirus Virus de la Rougeole * Virus Herpes Simplex Virus de l’Hépatite B * Virus d’immunodéficience Humaine Virus de la Poliomyélite * Autres Candida albicans Plasmodium falciparum Chlamydia trachomatis Chlamydia trachomatis Toxoplasma gondii * pathogènes contre lesquels un vaccin existe actuellement les virus responsables de gastro-entérites, la malaria et le virus d’immunodéficience humaine (VIH)), pourraient avoir des conséquences majeures sur la santé publique dans le monde. 2. Age de vaccination, âge d’exposition Un obstacle majeur au succès des stratégies de vaccination en pays en voie de développement provient de la précocité de l’exposition aux pathogènes. En conséquence, l’Organisation Mondials de la Santé recommande de vacciner plus tôt dans les pays en voie de développement. A titre d’exemple, nous reprenons les calendriers nationaux suivis en Belgique et en Gambie (table 2). Malgré la vaccination, on estime qu’entre les âges de 1 et 12 mois, environ 2,5 millions de décès de causes infectieuses sont à déplorer annuellement, pour la toute grande majorité en pays en voie de développement En effet, même dans les cas où un vaccin est disponible, des nourrissons qui n’ont pas encore atteint l’âge recommandé de vaccination peuvent être victimes de la maladie. L’exemple de la rougeole est illustratif : l’existence d’un réservoir de transmission constitué par les enfants qui ne sont pas encore en âge d’être vaccinés constitue un obstacle important au contrôle de cette maladie qui demeure une cause de mortalité extrêmement fréquente De même, des risques d’infections à Bordetella pertussis et à Haemophilius influenzae de type b existent chez des nourrissons partiellement vaccinés Les pays en voie de développement ne sont pas seuls concernés par la nécessité de vacciner précocement. Le virus respiratoire syncitial est responsable de bronchiolites chez les nourrissons, partout dans le monde. L’âge médian d’hospitalisation est de trois mois. Un vaccin qui serait efficace après trois doses administrées dans le cadre du calendrier de vaccination actuel ne permettrait de prévenir que 50 à 75% des cas de bronchiolite Le cas de la diarrhée â rotavirus est similaire La vaccination précoce est aussi souhaitable pour obtenir des taux élevés de couverture vaccinale Le contact avec les centres de santés est en effet plus fi'équent au cours des premiers mois de vie, alors que le suivi médical diminue après quelques mois. Ainsi, le bacille de Calmette-Guérin (BCG) administré à la naissance est le vaccin le plus administré au monde, alors que les taux de couverture par le vaccin contre la rougeole, administré plus tard, atteignent rarement 80% en pays en voie de 9 Figure 3. Les pays où la prévalence du portage chronique de l'antigène HBs est la plus élevée (A) ne sont pas toujours ceux où l'on vaccine contre l'hépatite B (B, carte de 1997). En C, on peut voir les niveaux de couverture vaccinle contre la diphtérie, le tétanos, le pertussis, en 1996 (référence 3). C Couverture vaccinale contre la diphtérie, le tétanos et la coqueluche I I No report I I Above 80% Q 50%-80% Q Below50% développement Il a aussi été démontré que l’administration à la naissance de la première dose de vaccin anti-hépatite B est favorable au suivi complet du calendrier vaccinal Le développement de vaccins pouvant être administrés rapidement après la naissance est donc souhaitable. Malheureusement, l’immaturité du système immunitaire dans les premiers mois de vie est non seulement responsable d’une grande susceptibilité aux infections, mais également d’une incapacité à générer des réponses immunes protectrices après administration de certains vaccins. Dans la suite de cette introduction, nous ferons le point sur l’état actuel des connaissances sur le système immunitaire du nouveau-né et du nourrisson, en nous intéressant particulièrement aux fonctions présentatrices de l’antigène ainsi qu’au développement de réponses humorales et cellulaires. Nous discuterons des facteurs prénatals et postnatals susceptibles d’influencer l’ontogénie du système immunitaire. Nous essayerons de définir les compartiments du système immunitaire les plus marqués d’immaturité en début de vie, et dont l’activation pourrait être la cible des vaccins permettant de générer des réponses immunes protectrices précocement. Ces informations nous permettront d’introduire les questions abordées au cours de notre travail de recherche. 10 Table 2. A. Calendrier vaccinal en Gambie jusqu’à 15 mois. 1 2 3 + -1- + Di Te Per + + + + H. Influenzae b + + + + Age (mois) 0 BCG + Poliomyélite* + 4 9 13-15 + -1- Rougeole Oreillons-Rubéole + Hépatite B + + B. Calendrier vaccinal en Belgique jusqu’à 15 mois. 2 3 4 Poliomyélite* -1- + -h Di Te Per -1- -1- + H. Influenzae b + + -f- Age (mois) 0 1 9 13-15 BCG Hépatite B -1-1- Rougeole Oreillons-Rubéole + -1- -t- + -1- -1- + -1- * En Gambie, le vaccin vivant atténué est administré, alors qu’en Belgique, on utilise le vaccin inactivé. IL PRESENTATION DE L’ANTIGENE EN DEBUT DE VIE 1. Fonctions des cellules présentatrices de l’antigène. Les cellules présentatrices de l’antigène sont les cellules capables de présenter un antigène à des lymphocytes T. Les cellules présentatrices de l’antigène professionnelles, qui expriment constitutivement les molécules du complexe majeur d’histocompatibilité (CMH) de classe II, sont les cellules dendritiques, les monocytes et les lymphocytes B. Seules les cellules dendritiques sont capables de stimuler des lymphocytes T naïfs et d’initier une réponse immune primaire. Lors de l’entrée dans l’organisme d’un pathogène ou d’un antigène vaccinal, des antigènes vont être internalisés par des cellules dendritiques présentes dans le tissu ou attirées par la libération de facteurs chimiotactiques et pro-inflammatoires. L’antigène sera dégradé dans les voies lysosomiales, et des peptides antigéniques seront présentés à la surface cellulaire en association avec des molécules du CMH de classe IL La cellule dendritique va entamer une migration vers l’organe lymphoïde secondaire régional, tout en acquérant un phénotype de maturité caractérisé par l’augmentation de l’expression de molécules du CMH, l’expression de molécules de co-stimulation (B7-1, B7-2, CD40) à la surface cellulaire, et la capacité de produire des quantités importantes de cytokines qui joueront un rôle important dans l’orientation de la réponse immune. Arrivée dans la zone T des organes lymphoïdes secondaires, la cellule dendritique activée va interagir avec un lymphocyte T naïf spécifique d’un peptide présenté. On distingue classiquement deux signaux nécessaires à l’activation d’im lymphocyte T naïf. Le premier signal est caractérisé par l’engagement du récepteur de cellule T. Le second signal est caractérisé par la liaison de diverses molécules de co-stimulation de part et d’autre des cellules en présence et par la production de cytokines par la cellule dendritique. Les caractéristiques de l’interaction entre le lymphocyte T naïf et la cellule dendritique détermineront l’orientation de la réponse immune effectrice générée. 11 Figure 4. Les conditions d'interaction entre la cellule présentatrice de l'antigène et le lymphocyte! auxiliaire déterminent le profil de différenciation lymphocytaire. Des facteurs favorisant le développement d'un profilThl (à gauche) et!h2 {à droite) sont présentés. Mycobactéries Vaccins au DNA, motifs CpG Adjuvants Th 1 Allergènes Helminthes Alum IL-12 IL-4 IFN-y CD40 ligand IL-5 IL-10 lL-13 TNF-a IFN-y Aide à la synthèse des immunoglobulines Protection contre les helminthes Protection contre les germes intra-cellulaires Cellule présentatrice de l'antigène C5) Lymphocyte! auxilliaire A Cytokine ü Récepteur de cytokine CD40 ^ CMH Cl II 9 Peptide antigénique Récepteur de cellule T CD40 ligand ( Jj CD28 1 2. Induction de la réponse immune adaptative des lymphocytes T auxiliaires (flgure 4) Si la cellule dendritique n’a pas connu de processus de maturation, l’engagement du récepteur de cellules T ne s’accompagnera pas du second signal, et une rencontre ultérieure avec l’antigène n’induira pas l’activation du lymphocyte. En présence du deuxième signal, le lymphocyte T naïf est activé et se différencie en lymphocyte effecteur et/ou en lymphocyte mémoire. Les lymphocytes T auxiliaires activés orchestrent la réaction immunitaire par la production de cytokines au rôle effecteur essentiel de par leur action sur les autres types cellulaires. On distingue divers types de lymphocytes T auxiliaires activés. Les lymphocytes Thl, au caractère pro-inflammatoire, secrétent de l’interféron (IFN)Y, du facteur de nécrose tumorale (TNF)-a et de l’interleukine (IL)-2, mais pas d’IL-4 ni d’IL-5. Ils supportent les fonctions cytotoxiques des lymphocytes CD8 et des lymphocytes Natural Killers (NK). Les lymphocytes Thl jouent un rôle essentiel dans la défense contre les pathogènes intracellulaires, mais ils contribuent au développement de certaines maladies auto-immunes comme par exemple l’arthrite rhumatoïde. La production d’IL-12 par les cellules dendritiques lors de l’activation du lymphocyte T naïf est essentielle à la différenciation Thl. La stimulation du CD40 à la surface de la cellule dendritique par le CD40 ligand exprimé à la surface des lymphocytes T activés favorise la production d’IL-12 et donc la différenciation Thl. Il en va de même de l’interaction entre le B7-1 et le CD28. Les lymphocytes Th2 produisent de l’IL-4, de l’IL-5, de l’IL-10 et de l’IL-13 mais ni riFN-y, ni l’IL-2, ni le TNF-a. Les lymphocytes Th2 jouent un rôle essentiel dans le support de la production d’anticorps et de la défense contre les helminthes. Leur activation contribue néanmoins aux manifestations atopiques et au développement d’autres maladies auto-immunes comme le lupus érythémateux. L’IL-4, produite par des lymphocytes naïfs activés ou par d’autres sources cellulaires, stimule la différentiation Th2. La présence d’IL-4 et d’IFN-y produits par d’autres cellules (mastocytes, lymphocytes Natural Killers, lymphocytes T yô) peut également influencer la polarisation des lymphocytes auxiliaires. 12 Les lymphocytes ThO produisent à la fois des cytokines de type Thl et de type Th2. Une régulation réciproque des différents types de lymphocytes auxiliaires existe, via l’action inhibitrice de l’IL-10 sur la différenciation Thl et de TIFN-y sur la différenciation Th2. Plus récemment, des lymphocytes T régulateurs producteurs de cytokines inhibitrices ont été décrits, mais leur rôle dans des systèmes spécifiques de l’antigène n’a pas encore été démontré. De nombreux facteurs peuvent influencer le processus de maturation de la cellule dendritique et donc le type de réponse immime développée. Outre la génétique de l’hôte, la nature de l’antigène, sa dose et sa formulation sont des facteurs essentiels. Ainsi, de nombreux microbes induisent la maturation fonctionnelle de la cellule dendritique et sa production d’IL-12. C’est le cas des bactéries gram négatives (le lipopolysaccharide bactérien joue un rôle important), gram positives {Staphylococcus aureus), des mycobactéries, du toxoplasme et des leishmanies. D’autres, comme le virus de la rougeole ou le VIH, ainsi que le Trypanosoma cruzi (T. cruzi), inhibent la maturation des cellules dendritiques. Les adjuvants ont la propriété d’augmenter l’immunogénicité des antigènes avec lesquels ils sont injectés. Ils agissent en augmentant la réaction inflammatoire au site d’injection et en modulant l’activité et la maturation des cellules dendritiques. Ils affectent la solubilité de l’antigène et donc la façon dont celui-ci est internalisé par les cellules présentatrices de l’antigène. L’hydroxyde d’aluminium (Alum) est le seul adjuvant autorisé en pratique vaccinale pédiatrique. Il favorise le développement des réponses humorales et des réponses Th2. L’adjuvant complet de Freund comporte des extraits mycobactériens et favorise chez l’animal le développement de réactions immunes de type Thl. L’ADN bactérien, grâce à son contenu en motifs répétitifs de dinucléotides non méthylés CpG a aussi la propriété de stimuler la maturation des cellules dendritiques et leur production d’IL12, et dès lors de favoriser le développement de réponses Thl. De nombreux autres adjuvants existent. Certains ont été essayés en essais cliniques chez l’adulte avec des succès variables. 13 3. Immaturité des cellules présentatrices de l’antigène chez le nouveau-né On sait peu de choses des fonctions de présentation de l’antigène en début de vie. Chez la sotuis, il a été montré qu’au cours des premières semaines de vie, les cellules dendritiques présentent im défaut de capacité à présenter im antigène purifié à des clones T spécifiques matures Chez l’homme, par contre, des expériences de présentations d’antigènes de cytomégalovirus, de virus herpétique et de virus de la varicelle par des monocytes de sang de cordon à des lymphocytes maternels suggèrent que le nouveau-né est capable de présenter l’antigène La capacité du nourrisson à présenter des antigènes purifiés n’a néanmoins pas été comparée à celle d’individus plus âgés. Par ailleurs, on sait que les cellules présentatrices de l’antigène du nouveau-né sont de faibles inducteurs de la prolifération de cellules T adultes en culture cellulaire allogénique La réaction allogénique dépend de l’expression d’antigènes d’histocompatibilité. Il a effectivement été démontré, chez la souris et chez l’homme, que les cellules dendritiques de nouveau-né expriment des quantités réduites de molécules du CMH de classe I et de classe II, comme de molécules de co-stimulations 13,16,17 Récemment, un défaut d’expression de molécules co-stimulatrices à la surface de cellules dendritiques différenciées à partir de monocytes du sang de cordon a été mis en évidence. Il fut montré que le déficit d’expression des molécules du CMH de classe II et des molécules co-stimulatrices B7-1 et CD40 est particulièrement marqué. En réponse à des stimuli inflammatoires, les cellules dendritiques de nouveau-nés produisent des quantités de TNF-a, d’IL-8 et d’IL-6 comparables à l’adulte. Par contre, leur capacité à produire de l’IL-12 est profondément réduite, ceci étant secondaire à un défaut de transcription du gène de la sous-vmité p35 de l’IL12 Des facteurs post-transcriptioimels semblent également à prendre en compte, comme le suggère l’instabilité de l’ARN messager de l’IL-12 et de l’IL-15 observée chez le nouveau-ne' 19,20 . 14 In vivo, les fonctions de présentation de l’antigène sont moins bien connues. Au cours de la grossesse, le nombre de cellules de Langerhans épidermiques et de cellules dendritiques dermiques s’accroît progressivement On ne cormaît pas les différences de ce réseau cellulaire en début de vie et chez l’adulte. Chez le rat, la colonisation des muqueuses respiratoires par les populations de cellules dendritiques résidentes se fait au cours des premières semaines de vie post-natale. Elles ne sont alors capables que d’une activation sub-optimale en réponse à des stimuli inflammatoires Les souriceaux nouveau-nés présentent une susceptibilité particulière à l’infection intranasale par Pneumocystis carinii. Suite à cette infection, on retrouve, en comparaison à l’adulte, des nombres réduits de cellules dendritiques au niveau du poumon, une faible capacité migratoire vers l’organe lymphoïde régional, et un défaut de production de facteurs chimiotactiques et d’attraction de lymphocytes T matures La susceptibilité à l’infection par Listeria monocytogenes corréle également chez l’animal à un défaut de fonction présentatrice de l’antigène . Plus loin dans cette introduction, nous ferons référence à des travaux utilisant le modèle murin qui suggèrent que la génération de réponses immunes cellulaires matures par la vaccination néonatale dépend de la capacité du vaccin à activer les cellules présentatrices de l’antigène. Nous présenterons ensuite des résultats d’études d’immunogénicité vaccinale chez le nouveau-né humain appuyant cette hypothèse. 15 III. IMMUNITE CELLULAIRE EN DEBUT DE VIE Contrairement à l’immunisation passive que représente le transfert transplacentaire d’immunoglobulines et qui confère une protection essentielle contre certaines infections au cours des premiers mois de vie, la transmission materno-foetale d’immunité cellulaire n’est pas possible, étant donné la barrière mécanique placentaire qui limite les échanges de cellules, et la restriction des réponses lymphocytaires T par un système du CMH hautement polymorphique, dont les haplotypes diffèrent pour moitié entre une mère et son fœtus. La seule façon de générer des réponses cellulaires dont le fœtus dispose est de les développer lui-même. Chez le fœtus et le nourrisson, on observe une susceptibilité particulière aux pathogènes intracellulaires tels que le virus de l'herpès, le cytomégalovirus, le VIH, Listeria monocytogenes, Toxoplasma gondii et Mycobacterium tuberculosis 26 . Etant donné le rôle essentiel des lymphocytes T dans le contrôle des infections intracellulaires, ces observations suggèrent qu’il existe un déficit de fonction de ces cellules en début de vie. Ce déficit a pu être investigué chez l’animal et sur des lymphocytes de sang de cordon isolés et stimulés in vitro. Peu de doiuiées sont disponibles concernant les réponses T auxiliaires induites par l’exposition antigénique in vivo en début de vie, chez l’homme. 1. Réponses des lymphocytes T auxiliaires aux activateurs polyclonaux a. Les lymphocytes T de nouveau-nés présentent un déficit de réponse au premier signal, mais sont sensibles à l’intensité du deuxième signal d’activation Un grand nombre des travaux de caractérisation des fonctions des lymphocytes T ont porté sur l’activation mitogénique des lymphocytes du sang de cordon. Les mitogènes sont des activateurs lymphocytaires polyclonaux. La réponse est donc indépendante de la spécificité antigénique des lymphocytes. En réponse à divers mitogènes, il a été démontré que la capacité d’expression du gène de l’IFN-y par les lymphocytes du sang de cordon était réduite Le déficit de production d’IFN-y est particulièrement 16 observé dans un contexte de stimulation exclusive du récepteur des cellules T, du CD3 ou du CD2 Chez le souriceau nouveau-né, alors qu’on trouve peu d’IFN-y en réponse à la stimulation du récepteur de cellules T, on observe une production accrue d’IL-4, en comparaison à l’adulte Chez l’homme, il apparaît par contre que l’expression du gène et la production de l’IL-4 sont également diminuées à la naissance Le défaut de production d’IFN-y à la naissance est, au moins partiellement, secondaire aux faibles conditions de co-stimulation lors de l’induction de la réaction primaire En effet, la synthèse d’IFN-y en réponse à l’anti-CD2 augmente en présence de cellules allogéniques adultes, capables d’apporter un signal de co-stimulation essentiel En présence d’un anticorps anti-CD28 ou d’autres mitogènes capables d’activer les signaux de co-stimulation, le déficit de production d’IFN-y disparaît La présence de cytokines dans le milieu d’activation peut également jouer un rôle important. Alors que la production endogène d’IL-4 par les lymphocytes du sang de cordon est responsable d’une différenciation clonale Th2 par défaut qui n’est pas retrouvée chez l’adulte, la présence d’IL-12 exogène favorise la production d’IFN-y b. Naïveté ou immaturité lymphocytaire ? La faible capacité du nouveau-né à produire de l’IFN-y paraît au moins partiellement liée au caractère naïf de la population lymphocytaire. Alors que la toute grande majorité des lymphocytes de sang de cordon expriment le marqueur de phénotype naïf CD45 RA en début de vie, la proportion de lymphocytes mémoires porteurs du marqueur CD45 RO augmente avec l’âge Certains chercheurs affirment dès lors que la seule particularité des lymphocytes de nouveau-nés est de manquer de l’expérience d’exposition à l’antigène d’IFN-y comme l’expression En effet, la capacité de production in vitro du CD40L (molécule essentielle à l’interaction du lymphocytes T avec les cellules dendritiques et les lymphocytes B) s’acquièrent avec la division clonale induite par la stimulation répétée du récepteur de cellules T, qui induit aussi l’expression de marqueurs de mémoire lymphocytaire 17 Il y a cependant des raisons de penser qu’à la naïveté antigénique des lymphocytes T de nouveau-nés s’ajoutent des caractéristiques d’immaturité. En effet, une proportion importante de lymphocytes circulants à la naissance sont des émigrants thymiques récents, comme l’attestent l’expression de marqueurs de différenciation et les remaniements histologiques intrathymiques observés à la naissance De plus, les lymphocytes naïfs adultes et de nouveau-nés diffèrent dans leur sensibilité à l’effet de l’IL-12, qui induit chez l’adulte la génération d’effecteurs produisant exclusivement de riFN-y mais chez le nouveau-né de TIEN-y et de l’IL-4 Une sensibilité augmentée des lymphocytes de nouveau-nés à l’action inhibitrice de la prostaglandine E2 sur la production d’IFN-y a également été rapportée 2. Réponses des lymphocytes T auxiliaires aux alloantigènes Une grande partie des cormaissances sur les réponses immunes spécifiques en début de vie proviennent du modèle murin. En 1953, il fut démontré que le transfert de cellules spléniques allogéniques au souriceau nouveau-né induit une tolérance aux greffes cutanées du même donneur à l’âge adulte Il fut interprété que la période néo-natale est critique pour le développement de la recormaissance immunologique du soi, et que les lymphocytes de nouveau-nés ont ime susceptibilité unique et intrinsèque à l’induction de tolérance. Différents mécanismes ont été impliqués. Certains chercheurs ont suggéré que les cellules circulantes du donneur se retrouvent dans le thymus où le processus de sélection négative aboutit à la délétion clonale des lymphocytes réactifs d’antigènes du dormeur D’autres expériences suggèrent que la tolérance néonatale est le résultat d’un développement préférentiel de réponse Th2 Cette déviation immune et la tolérance de greffe ne sont pas observées lorsque des inducteurs de réponse Thl tels que l’IL-12, l’IFN-y, des anticorps neutralisants antiIL-4 ou stimulants anti-CD40 sont administrées au nouveau-né en même temps que les cellules allogéniques H a aussi été démontré que l’induction de tolérance dépend des conditions de présentation des alloantigènes. Alors qu’une tolérance est induite par injection néonatale de cellules spléniques, ime réponse cytotoxique vigoureuse peut être induite à la naissance par l’injection de cellules dendritiques adultes La dose de l’antigène a également un rôle important. En effet, une tolérance aux alloantigènes peut être induite chez l’adulte par l’injection d’un grand 18 nombre de cellules spléniques allogéniques Enfin, la tolérance néonatale peut aussi dépendre de phénomènes se produisant au niveau des tissus périphériques. En effet, les lymphocytes T naïfs du souriceau nouveau-né circulent à travers les tissus périphériques non lymphoïdes, et des processus de tolérisation vis-à-vis d’auto­ antigènes s’y déroulent. Chez l’animal adulte, seuls les lymphocytes ayant déjà rencontré l’antigène se retrouvent dans les tissus périphériques non lymphoïdes . Chez l’humain, la susceptibilité des lymphocytes de nouveau-nés à l’induction de tolérance aux alloantigènes contribue à la faible incidence de réactions du greffon contre l’hôte, lorsque les cellules du sang de cordon servent de source de cellules souches hématopoïétiques chez des patients leucémiques immuno-supprimés 63 L’induction de tolérance aux alloantigènes n’est néanmoins pas un phénomène systématique à la naissance. Une réponse cellulaire vis-à-vis d’alloantigènes peut effectivement être observée après transfusion in utero de globules rouges irradiés provenant d’un donneur hétérologue, ce qui cause également une augmentation de la proportion de lymphocytes exprimant le marqueur de mémoire CD45RO 3. Réponses des lymphocytes T auxiliaires aux antigènes de rappel a. Réponses immunes des lymphocytes T auxiliaires chez la souris Chez la souris, la capacité de générer une réponse immune productrice d’IFN-y en réponse à la vaccination augmente graduellement au cours des premières semaines de vie. Parallèlement, la production de cytokines Th2 diminue. Ceci a été démontré en réponse à une série d’antigènes vaccinaux en présence d’Alum ou en l’absence d’adjuvants, en utilisant des souches de souris qui, à l’âge adulte, ont tendance à développer des réponses Th2 (BALB/C) comme Thl (C57/B6) Des réponses Th2 ont été décrites au niveau des ganglions d’animaux tolérisés vis-à-vis de certains peptides à la naissance ’ . Dans certains modèles expérimentaux, la vaccination néonatale induit précocement des effecteurs lymphocytaires de type Thl et Th2, mais les lymphocytes mémoires sont de type Th2 Lorsqu’une réponse de type Th2 est initiée à la naissance, il semble difficile de la réorienter : des inducteurs puissants de 19 réponses Thl peuvent réorienter vers un profil Thl une réponse Th2 initiée à l’âge adulte, mais pas à la naissance La génération de réponses vaccinales en début de vie proches de celles observées à l’âge adulte a pu être obtenue grâce à l’utilisation de vaccins à l’ADN contre toute ime série de pathogènes Des résultats prometteurs ont également été obtenus chez des primates non humains vaccinés à la naissance contre le virus de l’influenza, de l’hépatite B et contre le VIH ou après vaccination orale intra-amniotique chez le veau Les mécanismes par lesquels les vaccins à l’ADN permettent d’induire des réponses immunes vigoureuses en début de vie ne sont pas entièrement élucidés. Comme dans le cas d’autres vaccins qui ont la propriété de permettre à l’antigène de persister durant un certain temps dans l’organisme, il se pourrait que l’activation de lymphocytes naïfs continue au-delà de la période néonatale, en dehors de la période d’immaturité néonatale Les motifs CpG non méthylés présents dans les vaccins à l’ADN produits par des bactéries recombinantes jouent un rôle important en effet la propriété d’attirer et d’activer les cellules dendritiques ’ . Ils ont . Ces motifs peuvent également augmenter l’immimogénicité de vaccins protéiques ^'*’*'*, et permettent d’éviter l’anergie et l’apoptose des lymphocytes B de nouveau-nés en réponse la vaccination par des antigènes T-indépendants Bien que les vaccins à T ADN aient permis l’activation de réponses productrices d’IFN-y, de lymphocytes cytotoxiques et de taux importants d’immunoglobulines à la naissance, il faut préciser que des différences avec l’adulte ont été observées. La génération de lymphocytes cytotoxiques est effectivement plus lente et de plus brève amplitude lors de la vaccination néonatale. Les titres d’anticorps sont inférieurs et la composante Th2 plus marquée Dans un cas particulier de vaccin à T ADN codant pour un antigène de Plasmodium yoelii, l’induction de tolérance par la vaccination néonatale a été rapportée sans que le mécanisme n’en ait été élucidé L’amplification de réponses initiées lors d’une primo-immimisation par un vaccin à l’ADN pourrait être obtenue grâce à l’administration ultérieure d’un même vaccin sous sa forme protéique 20 Figure 5. Facteurs susceptibles d'expliquer la susceptibilité des nourrissons aux infections intra-cellulaires. Immaturité des cellules présentatrices de l'antigène Défaut de différenciation Thi,développement préférentiel de réponsesTh2 Cellule présentatrice de l'antigène CS) Lymphocyte! auxilliaire A Cytokine ca Récepteur de cytokine ^ 9 CMH Cl II 1 Peptide antigénique Récepteur de cellule T CD40 CD40 ligand ( 1 rncD28 Il existe d’autres stratégies permettant d’induire, chez la souris, des réponses de type Thl à la naissance. La co-administration d’IL-12 avec l’antigène vaccinal promeut la production d’IFN-y, ainsi que la production de cytokines Th2 et d’anticorps protecteurs Malheureusement, l’effet nécessite souvent plusieurs administrations, à des doses proches de la toxicité De même que l’administration de CD40L peut prévenir le développement de tolérance néonatale aux alloantigènes, la co­ administration d’un plasmide codant pour le CD40L avec un vaccin à l’ADN contre la rougeole permet de générer une réponse de type Thl identique à celle observée chez l’adulte Une réponse Thl a également pu être induite en présence d’adjuvants, et notamment l’adjuvant complet de Freund dérivé des mycobactéries l’aide de vaccins capables de réplication in vivo ainsi qu’à Quant au BCG, il est capable d’induire une réponse de type Thl chez la souris âgée d’une semaine mais pas à la naissance Comme pour les expériences d’induction de tolérance néonatale, il a été démontré que la dose utilisée au cours de l’immunisation peut déterminer le type de réponse générée. Ainsi, une réponse Thl et cytotoxique est induite par la vaccination néonatale à faible dose par un rétrovirus murin alors qu’une réponse non protectrice de type Th2 est observée lors de l’utilisation de hautes doses Ceci pourrait s’expliquer par un déséquilibre quantitatif entre lymphocytes T, lymphocytes B et cellules dendritiques dans les organes lymphoïdes périphériques, surtout au niveau splénique La présence de hautes concentrations d’antigènes pourrait effectivement permettre d’impliquer des cellules autres que les cellules dendritiques pour la présentation de l’antigène, de manière défavorable à l’établissement de réponses de type Thl. Le rétablissement d’une orientation Thl par réduction de la dose n’a néanmoins pas été observé dans les cas de la toxine tétanique et d’un vaccin pox recombinant L’ensemble des données expérimentales disponibles, provenant d’expériences animales ou d’analyses cellulaires in vitro, suggèrent que différents facteurs peuvent expliquer l’immaturité des fonctions des lymphocytes T en début de vie (figure 5). Toutes ces observations ne sont cependant pas extrapolables à l’homme. Le degré 21 d’immaturité des lymphocytes périphériques semble moins profond chez l’homme que chez la souris. Alors qu’une thymectomie néonatale aboutit chez la souris au développement de maladies auto-immunes, chez l’homme elle se conséquences majeures en cours de chirurgie cardiaque fait sans La sélection thymique post-natale se poursuit de manière plus intense chez le souriceau nouveau-né. La susceptibilité à l’induction de tolérance est moins apparente chez l’homme. Il a été suggéré que les réponses immunes chez la souris âgée d’une semaine reflètent bien les réponses immunes néonatales chez l’homme. La maturation du système immunitaire murin au cours des 4 premières semaines de vie ressemble à celle observée au cours de la première année de la vie humaine b. Réponses immunes des lymphocytes T auxiliaires chez l’homme L’exposition in utero à divers antigènes peut induire des réponses immunes cellulaires détectables à la naissance. Dans un certain nombre de cas d’infections congénitales, des réponses immunes cellulaires peuvent être détectées à la naissance, mais ces réponses sont souvent de faible amplitude. Suite à l’infection congénitale ou néonatale par le virus de l’herpès, les nouveau-nés développent une réponse immune cellulaire productrice d’IFN-y, mais de manière plus lente que lors d’une primo-infection chez l’adulte. Ce délai, en partie attribué à ime faible activité NK, semble expliquer la gravité de cette infection chez le nouveau-né Des réponses prolifératives plus faibles chez le nourrisson que chez des enfants plus âgés ont également été observées en cas d’infection congénitale et néonatales par le cytomégalovirus, le virus de la varicelle et de la rubéole, la toxoplasmose et la syphilis, sans que ces réponses n’aient été caractérisées dans le détail En absence d’infection fœtale, on peut dans certains cas détecter après la naissance des réponses cellulaires vis-à-vis d’antigènes transmis par voie transplacentaire. Une réponse cellulaire de type Th2 vis-à-vis d’antigènes d’helminthes (filariose, schistosomiase) peut être détectée à la naissance et durant plusieurs années chez des enfants nés de mères infectées durant leur grossesse 109,110 réponses de type Th2 vis-à-vis d’allergènes ont été détectées dans le sang de cordon aussi bien chez des enfants qui développent par la suite des manifestations allergiques que chez des 22 enfants non atopiques Sous l’influence de facteurs génétiques et environnementaux, le profil de réponses vis-à-vis d’allergènes dévieront vers le type Thl chez les enfants non atopiques alors qu’un profil pathogène de type Th2 persiste chez les enfants atopiques Etant donné que des réponses Th2 sont également observées chez des adultes allergiques ou infectés par des helminthes, ces observations ne suffisent pas à conclure que les réponses immunes prénatales sont universellement biaisées vers le profil Th2. D’ailleurs, l’exposition in utero à des antigènes mycobactériens semble également pouvoir induire une réponse productrice d’IFN-y à la naissance Les qualités des réponses immunes cellulaires induites par l’exposition du nourrisson à des antigènes vaccinaux ou à des infections naturelles sont peu connues. Le vaccin contre la variole a été administré durant de longues années à des nouveau-nés et à des nourrissons, mais à notre connaissance, la réponse cellulaire n’a jamais été investiguée. La vaccination contre le tétanos à 2, 4 et 6 mois induit initialement la production de cytokines Thl et Th2. Néanmoins, à l’âge d’un an, la production d’IFN-y a diminué, alors que la production de cytokines Th2 s’est amplifiée Les auteurs interprètent leur résultat comme l’indication d’une tendance à développer préférentiellement des réponses mémoires Th2 en début de vie. Une étude d’immunogénicité et d’efficacité clinique d’un vaccin inactivé contre le virus respiratoire syncitial a démontré l’induction d’une réponse de type Th2 accompagnée d’une augmentation de mortalité suite à l’infection naturelle Les nourrissons vaccinés par le vaccin acellulaire contre la coqueluche développent une réponse mixte Thl/Th2, alors qu’en réponse au vaccin cellulaire, une réponse de type Thl ressemblant à celle induite par l’infection naturelle apparaît Une réponse proliférative à un vaccin contenant la gpl20 du VIH a pu être induite chez environ 50% de nourrissons vaccinés à la naissance et à l’âge de deux semaines ou à l’âge d’un mois, mais le profil de production de cytokines n’a pas été évalué. Le rôle immunogène d’une émulsion lipidique comme adjuvant présent dans le vaccin a été mis en évidence De rares études d’immunogénicité cellulaire en début de vie ont inclus des individus plus âgés. Une réduction quantitative de réponses aussi bien Thl que Th2 a été 23 rapportée chez des nourrissons infectés par Plasmodium falciparum, par rapport à des adultes infectés La réponse Thl détectée après méningite à Neisseria meningitidis était plus marquée chez les enfants en bas âge que chez les enfants plus âgés . Le vaccin contre la rougeole induit une production d’IFN-y équivalente chez des adultes et des nourrissons de 6 à 12 mois, alors que la réponse proliférative et la production d’IL-12 sont plus faibles chez le nourrisson Le vaccin BCG contre la tuberculose est administré à la naissance dans la plupart des pays en voie de développement. Une augmentation de la réponse proliférative lorsque le vaccin est administré à 3 ou 6 mois plutôt qu’à la naissance a été rapportée Le vaccin BCG est connu pour induire une réaction immune de type Thl chez l’adulte Etant donné l’importance du profil de production de cytokines dans le contrôle des infections à germes intracellulaires, la production de cytokines en réponse à la vaccination par le BCG en début de vie a été étudiée en Gambie. La réponse cellulaire a été caractérisée jusqu’à l’âge de 1 an chez des nourrissons vaccinés à la naissance, à l’âge de 2 ou de 4 mois. Ces études ont montré que le BCG induit à la naissance une réponse immune similaire à celle mesurée chez des enfants plus âgés, caractérisée par la production de quantités importantes d’IFN-y, et de quantités très faibles de cytokines Th2 IL-13 et IL-5 La source de ces cytokines n’a pas été caractérisée. Par ailleurs, aucune de ces études n’a inclus de comparaison avec des adultes. Ces travaux ne permettent pas de conclure quant à l’existence ou non d’ime capacité diminuée des nouveau-nés humains à développer des réponses de type Thl, et quant à l’existence d’un biais Th2 systématique en réponse à la vaccination infantile. Des travaux supplémentaires sont nécessaires pour caractériser la maturité des fonctions des lymphocytes T auxiliaires chez l’homme en début de vie. Plus loin, nous apporterons des éléments de réponse à ces questions importantes en présentant des résultats d’études que nous avons menées en Gambie. 4. Fonctions des lymphocytes T cytotoxiques Les lymphocytes CD8 cytotoxiques (CTL) jouent un rôle essentiel dans la défense contre les pathogènes intracellulaires. Ils reconnaissent des peptides présentés par les 24 molécules de classe I du CMH à la surface des cellules de l’organisme. Les antigènes présents dans le cytoplasme de cellules infectées sont transportés dans le réticulum endoplasmique. Les peptides issus de la dégradation de l’antigène seront associés à des antigènes du CMH de classe I avant d’être exprimés à la surface cellulaire, où ils pourront être reconnus par des CTL qui exerceront leur rôle protecteur via la production de facteurs cytotoxiques tels la perforine, le granzyme ou des cytokines comme le TNF-a et l’IFN-y. Bien que les CTL puissent exercer leur activité cytotoxique directement sur n’importe quelle cellule de l’organisme exprimant les molécules du CMH de classe I, leur activation dépend de l’aide fournie par les lymphocytes T auxiliaires de type Thl. Cette assistance s’organise dans les organes lymphoïdes autour des cellules dendritiques qui co-expriment les molécules du CMH de classe I et II, produisent de l’IL-12 et expriment des molécules de co-stimulation. Ces interactions sont essentielles à l’activation des lymphocytes CD8. Chez la souris, un parallèle peut être fait entre la capacité de développer des réponses immimes de type Thl et de type cytotoxique. Ainsi, de sévères limitations des réponses cytotoxiques ont été décrites dans divers modèles de vaccination néonatale 66,68,74,127 expériences classiques de transfert néonatal de cellules allogéniques induit la tolérisation de lymphocytes CD8 . Des CTL spécifiques ont néanmoins pu être activés grâce à l’utilisation de vaccins à l’ADN, de vaccins vivants, d’adjuvants ou de cellules dendritiques matures Peu de données sont disponibles concernant les fonctions des lymphocytes CD8 des nouveau-nés humains. Des travaux in vitro sur le sang de cordon indiquent que, contrairement aux lymphocytes T CD4, les lymphocytes T CD8 ne se différencient pas en effecteurs producteurs d’IL-4 et d’IL-5 sous des conditions neutres de stimulation La capacité des lymphocytes CD8 du sang de cordon à se différencier en CTL alloréactifs producteurs d’IFN-y est néanmoins diminuée en comparaison à l’adulte In vivo, on observe précocement la capacité de développer des réponses cytotoxiques. Des réponses cytotoxiques ont été observées chez des enfants atteints d’infections congénitales au cytomégalovirus ou à la rubéole ’ . Dans le cas de l’infection 25 congénitale à VIH, des CTL sont observés chez certains enfants Les fréquences des CTL dans le sang circulant sont néanmoins plus faibles que chez l’adulte Comme chez l’adulte, l’activité CTL anti-VIH joue un rôle protecteur et est corrélée à l’évolution clinique *^’’*^*. L’existence de CTL anti-VIH chez des enfants non infectés nés de mère VIH positive a été rapportée H est possible que ces enfants aient été infectés par le VIH et soient parvenus à se débarrasser du virus grâce au développement d’une réponse immime protectrice. Des CTL spécifiques du virus respiratoire syncitial ont été décrits chez des enfants ayant fait une bronchiolite. L’intensité des réponses était plus importante en cas de bronchiolite peu sévère, suggérant un rôle protecteur L’intensité des réponses cytotoxiques dirigées contre le virus respiratoire syncitial est dépendante de l’âge, ce qui suggère une maturation de la capacité à développer ce type de réponse au cours de la première année de vie Les réponses cytotoxiques induites par le vaccin anti­ rougeoleux administré à l’âge de 9 mois sont semblables à celles induites par l’infection naturelle chez des enfants plus âgés Des réponses cytotoxiques anti- influenza ont aussi été décrites chez des nourrissons, quelques semaines après infection par le virus de la grippe Il serait intéressant d’étudier les conditions d’immunisation permettant l’induction de réponses CTL à la naissance. En effet, plusieurs vaccins en cours de développement visent à activer ce type de réponses immunes, dont des vaccins contre la malaria, le VIH et la tuberculose. Certains ont été administrés expérimentalement à des individus adultes, mais pas en début de vie. 26 Figure 6. Importance des intéractions inter-cellulaires dans le développement de la réponse humorale. 3. Au niveau de la zone T d'un ganglion, un lymphocyte! auxiliaire spécifique va reconnaître le peptide présenté par A ^ Y □ Récepteur de cytokine CD40 Anticorps Peptide antigénique Récepteur de cellule! Antigène I CD40 ligand III. IMMUNITE HUMORALE EN DEBUT DE VIE Les anticorps jouent un rôle de défense essentiel contre les bactéries extracellulaires grâce à leur propriétés d’opsonisation, de fixation du complément et de cytotoxicité médiée par les anticorps. Ils peuvent bloquer l’action de toxines ou neutraliser des virus avant leur pénétration intracellulaire. 1. Principes de l’induction des réponses humorales (fîgure 6) Un lymphocyte B naïf, issu de la moelle osseuse, peut être activé par la liaison de ses immunoglobulines membranaires à un antigène. S’il s’agit d’un antigène protéique, celui-ci sera internalisé, dégradé et présenté à la surface du lymphocyte B en association avec une molécule du CMH de classe IL Dans la zone T d’un organe lymphoïde secondaire, un lymphocyte T spécifique du peptide présenté pourra alors lier le lymphocyte B, et lui délivrer des signaux de stimulation. La prolifération du lymphocyte B ainsi stimulé aboutira à la formation d’un centre germinal. La stimulation du lymphocyte B se maintient grâce à la présence de l’antigène, capturé à la surface d’une cellule dendritique folliculaire, et par l’interaction avec le lymphocyte T. Les lymphocytes B pourront se différencier en lymphocytes mémoires à la longue durée de vie ou en plasmocytes, qui migreront vers d’autres organes lymphoïdes, surtout la moelle osseuse, où seront synthétisées des quantités importantes d’immunoglobulines. Les lymphocytes B naïfs expriment à leur surface des IgM, qui reconnaissent l’antigène avec une faible affinité. Au niveau du centre germinal, la commutation isotypique a lieu, grâce au réarrangement des gènes des chaînes lourdes des immunoglobulines, ce qui permet l’expression de différents isotypes d’immunoglobulines, aux fonctions diverses. Les mutations somatiques survenant au niveau des régions variables des gènes d’immunoglobulines permettent une maturation d’affinité des anticorps pour l’antigène. L’interaction entre la cellule dendritique folliculaire, le lymphocyte T et le lymphocyte B joue un rôle essentiel dans l’induction de la réponse humorale. La liaison du CD40 ligand exprimé à la surface des lymphocytes T au CD40 exprimé par les lymphocytes B est particulièrement importante pour l’induction de la commutation isotypique, de même que la production de cytokines par le lymphocyte T auxiliaire. 27 L’IL-4 promeut la production d’IgGl et d’IgE, alors que TIEN-y inhibe la production d’IgE. Chez la souris, l’IL-2 promeut la production d’IgM, et TIEN-y celle d’IgG2a. On estime que chez la souris, un rapport IgGl/IgG2 élevé ou bas reflète, respectivement, une forte activité Th2 ou Thl. Chez l’homme, une relation claire entre polarisation Thl ou Th2 et production d’isotypes particuliers n’a pas été mise en évidence. 2. Particularités des lymphocytes B à la naissance a. Immaturité et induction de tolérance On trouve, à la naissance, ime plus grande proportion par rapport à l’adulte de cellules B appelées Bl, capables d’auto-renouvellement, qui ne produisent que des IgM de faible affinité, à la spécificité dégénérée (capables de polyspécificité), et dont le rôle est peu clair immature On trouve aussi davantage de lymphocytes B naïfs au phénotype Les lymphocytes B du nouveau-né sont particulièrement sensibles à l’induction d’anergie lors de la stimulation de l’immunoglobuline de surface sans l’apport de signaux de co-stimulation b. Diversité du répertoire des immunoglobulines Le répertoire d’immunoglobulines est l’ensemble des anticorps de spécificités antigéniques distinctes présents chez un individu. La diversité du répertoire dépend de la recombinaison des gènes des immunoglobulines, et de l’activité de la deoxytransférase terminale qui peut enlever des nucléotides aux sites de jonction des différents segments de l’immunoglobuline. Bien que le répertoire des immunoglobulines s’élargisse fortement au cours de la deuxième moitié de la grossesse, celui-ci n’atteint le degré de diversité observé chez l’adulte que vers plusieurs mois, voire plusieurs années de vie 28 Figure 7. Facteurs susceptibles d'expliquer le défaut de fonction humorale associé au début de vie. A Peptide antigénique Y □ Récepteur de cytokine CD40 Anticorps Récepteur de cellule T 2^ Antigène I CD40 ligand 3. Réponses humorales aux vaccins et aux infections en début de vie (flgure 7) a. Réponses humorales in utero La capacité à produire des anticorps spécifiques s’acquiert in utero, comme on peut l’observer chez des nouveau-nés prématurés atteints d’infection congénitale à CMV, à virus de la rubéole ou à toxoplasmose L’apparition d’immimoglobulines spécifiques d’origine fœtale a aussi été démontrée suite à l’exposition intra-utérine à des antigènes parasitaires ou après vaccination maternelle contre le tétanos, la méningite ou l’infection streptococcique Les réponses humorales en début de vie diffèrent néanmoins fortement de celles observées plus tardivement. b. Amplitude des réponses humorales et fonction plasmocytaire En réponse à une dose vaccinale unique, on retrouve généralement une augmentation progressive avec l’âge des titres sériques d’anticorps induits. Entre 2 et 12 mois, on observe une augmentation des taux d’anticorps en réponse à une dose d’un vaccin conjugué contre VHaemophilius influenzae de type b . Lfne augmentation progressive de la réponse humorale à une dose de vaccin anti-rougeole est également retrouvée entre 6 et 15 mois Des observations similaires sont faites lors de l’administrations de plusieurs doses vaccinales. Un schéma précoce de vaccination combinée contre la diphtérie, le tétanos et la coqueluche à 2, 3 et 4 mois induisent des taux d’anticorps sériques inférieurs à ceux trouvés après vaccinations aux âges de 3, 5 et 9 mois Le vaccin contre l’hépatite B peut induire dès la première dose une réponse humorale chez certains nouveau-nés, mais les taux d’anticorps obtenus à long terme après un schéma de vaccination à 0, 1 et 2 mois sont plus faibles qu’après un schéma à 0, 1 et 6 mois 162,163 L’âge iQj.g jje la dernière dose vaccinale semble être le principal déterminant des titres induits à long terme. Ainsi, le risque de coqueluche ou de rougeole est plus faible lorsque le schéma de vaccination comporte une dose au cours de la deuxième annee de vie ’ . 29 Ces observations démontrent que l’amplitude et la durée des réponses humorales initiées en début de vie sont diminuées, ce qui suggère im déficit de différenciation ou de fonction des plasmocytes. La capacité de cellules B naïves à se différencier en plasmocytes secrétant des IgA et des IgG ne devient mature que vers les âges de 2 et 5 ans respectivement Il a été démontré chez la souris que la capacité d’accueil de plasmocytes dans la moelle osseuse est faible au cours des premières semaines de vie Cet aspect de la fonction humorale n’a pas été investiguée chez l’homme. c. Génération de lymphocytes B mémoires Administrés à la naissance, VHaemophilius spécifiques les vaccins contre la diphtérie, le tétanos influenza b n’induisent qu’une faible production et d’anticorps Néanmoins, l’administration de la première dose de vaccin à la naissance favorise dans certains cas la réponse aux doses ultérieures, et permet l’application de schémas rapprochés au cours des premiers mois de vie, comme ce fut démontré dans les cas de la vaccination à la naissance contre la poliomyélite, contre l’hépatite B et contre VHaemophilius injîuenzae de type b '*^3,169,170 suggère qu’en l’absence de génération de plasmocytes, l’induction de lymphocytes B mémoires est possible. Ce n’est pas vrai pour tous les vaccins : l’administration néonatale d’une dose contre le tétanos n’a pas d’effet favorable sur les doses ultérieures Il a même été montré que l’administration à la naissance d’une dose de vaccin cellulaire anti-pertussis peut diminuer légèrement les taux d’anticorps circulants induits par une vaccination ultérieure, faisant craindre la survenue d’un processus de tolérisation . Une observation similaire a été faite au sujet d’un vaccin polysaccharidique du méningocoque de groupe C d. Maturation d’affinité Une augmentation progressive de l’activité de mutation somatique, responsable de la maturation d’affinité des anticorps, est observée au cours de la première année de vie 175,176 Qç processus se déroule dans les centres germinaux, qui n’apparaissent dans les organes lymphoïdes secondaires qu’après quelques mois de vie . Ainsi, la diversité des régions variables d’immunoglobulines spécifiques d’un antigène vaccinal é'Haemophilius influenzae de type b augmente avec l’âge de la vaccination A 30 l’âge de trois ans, la diversité des segments variables des immunoglobulines de surface de cellules B trouvées dans les centres germinaux d’amygdales est toujours moindre que celle trouvée chez des adultes e. Importance de la coopération cellulaire et commutation isotypique Lorsque des lymphocytes B purifiés de nouveau-nés sont stimulés par la liaison de leurs immunoglobulines de surface, leur prolifération et leur capacité à produire des immunoglobulines est diminuée, en comparaison à l’adulte En présence de lymphocytes T activés, ce défaut de prolifération et de synthèse d’immunoglobulines ne se retrouve pas. Les lymphocytes T d’adultes sont plus à même de fournir cette 1 on aide à la synthèse d’immunoglobulines que les lymphocytes T de nouveau-nés . La capacité réduite d’expression du CD40 ligand à la surface des lymphocytes T activés est susceptible de contribuer à la faible capacité des lymphocytes B de nouveau-nés à entreprendre la commutation isotypique En réponse à divers vaccins administrés en période néonatale chez la souris, on observe en effet une production préférentielle d’IgGl par rapport aux IgG2a Le rapport IgG2a / IgGl élevé semble être secondaire au développement préférentiel de réponses Th2. Lorsque des vaccins capables de générer une réponse de type Thl sont utilisés, le rapport IgGl / IgG2a est rétabli. Ceci a été observé avec l’utilisation d’adjuvants d’IL-12 en même temps que l’antigène vaccinal avec l’administration ou grâce à la vaccination à l’ADN QA . Chez l’homme, le rapport entre les isotypes d’anticorps et la polarisation de la réponse T auxiliaire n’est pas établi. On observe néanmoins chez le nourrisson une prédominance de la production d’IgM, d’IgGl, et d’IgE, alors que la production d’IgG2 est faible jusqu’à 12 à 18 mois Les rapports quantitatifs des cellules en présence peuvent limiter les possibilités de coopération intercellulaire. Chez la souris, à la naissance, la rate ne contient que peu de lymphocytes T par rapport au nombre de lymphocytes B . Dans les ganglions, c’est l’apparition de cellules dendritiques folliculaires qui se fait tardivement f. Réponses humorales du nourrisson aux antigènes T-indépendants 31 Figure 8. La conjugaison d'antigènes polysaccharidiques T-indépendants à des motifs protéiques permet de recruter l'aide des lymphocytes! pour la synthèse des anticorps. Des antigènes polysaccharidiques peuvent induire la synthèse d'anticorps de faible affinité par le lymphocyte B Lorsque l'antigène polysaccharidique est conjugué à une protéine, celle-ci peut être internalisée et dégradée. Un peptide antigénique peut être présenté à un lymphocyte T auxiliaire. L'aide apportée par le lymphocyte! permet la production d'anticorps de haute affinité. CS) Anticorps Lymphocyte A Cytokine □ Récepteur de cytokine Antigène protéique ^ Peptide antigénique Y Récepteur de cellule! Antigène polysaccharidique CD40 CD40 ligand Certains antigènes polysaccharidiques présents dans la paroi des bactéries encapsulées contiennent des motifs répétitifs capables d’activer des lymphocytes B naïfs en liant simultanément plusieurs immunoglobulines de surface. La production d’anticorps peut alors se faire sans l’aide des lymphocytes T. Ces antigènes sont dits Tindépendants. Les anticorps produits seront surtout des IgM. On observe peu de commutation isotypique, peu de maturation d’affinité et peu d’immunité mémoire. Une protection contre ces pathogènes encapsulés peut néanmoins être obtenue grâce à l’utilisation de tels vaccins après l’âge d’environ 18 mois. Les vaccins aux motifs antigéniques polysaccharidiques de bactéries encapsulées ne sont pas immunogènes en dessous de l’âge d’environ 18 mois. La raison n’en est pas entièrement élucidée. Une immaturité des zones marginales de la rate, où sont générés les anticorps dirigés contre les antigènes polysaccharidiques a été incriminée, de même que la faible capacité à produire des IgG2, qui sont les isotypes habituellement produits en réponse aux antigènes polysaccharidiques On a également invoqué l’activité réduite du complément en début de vie, et la faiblesse d’expression du récepteur du fragment C3d du complément (le CD21) à la surface des lymphocytes B jusqu’à l’âge de 2 ans. En effet, le dépôt de fragments du complément sur les antigènes polysaccharidiques est nécessaire à la stimulation simultanée du CD21 et de l’immunoglobuline de surface des lymphocytes B, étape déterminante dans l’induction de la réponse humorale aux antigènes T-indépendants Lorsqu’on conjugue ces motifs polysaccharidiques à des protéines, on permet le recrutement par les lymphocytes B de l’aide des lymphocytes T (figure 8). En effet, la même cellule B peut lier les motifs polysaccharidiques par ses immunoglobulines de smface, dégrader la partie protéique du vaccin et présenter des peptides dans des molécules du CMH de classe II exprimées à la surface cellulaire, qui seront reconnus par des lymphocytes T. De tels vaccins sont maintenant disponibles en routine contre le pneumocoque, VHaemophilius Influenzae de type b et le méningocoque, et sont capables d’induire une réponse immune protectrice dès l’âge de quelques mois . La persistance d’immunité mémoire 5 ans après la vaccination de nourrissons contre la méningite A et C avec un vaccin conjugué a été démontrée récemment La vaccination systématique du nourrisson par le vaccin anti-Haemophilius influenzae de type b a permis de réduire de manière drastique les infections dues à ce germe dans 32 n*g /KX)n>l Figure 9.Taux d'immunoglobulines sériques en début de vie. des pays industrialisés et en Gambie D’autres vaccins conjugués sont en cours de développement. 4. Transfert trans-placentaire d’immunoglobulines et immunisation maternelle Le nouveau-né bénéficie à la naissance d’tme protection vis-à-vis de certains pathogènes grâce au transfert d’immunoglobulines maternelles au travers du placenta. Le passage transplacentaire des IgG se fait via l’interaction avec le récepteur Fc de type III à la surface des cellules trophoblastiques, suivi d’un transport actif à travers la cellule Les autres isotypes d’immunoglobulines ne passent pas la barrière placentaire. La concentration d’IgG dans le sérum de nouveau-né dépasse généralement de 5 à 10% la concentration maternelle. Les IgG2 et IgG4 étant moins aisément transportées à travers la barrière placentaire que les IgGl et IgG3, et la demi-vie des IgG3 étant bien plus courte (7 jours) que celles des autres sous-classes (27 jours), les proportions d’IgGl, IgG2, IgG3 et IgG4 diffèrent de celles du sérum maternel En période post-natale, alors que les taux d’anticorps reçus de la mère chutent, le nourrisson commence à produire ses propres immunoglobulines. Vers l’âge de 3-4 mois, les taux d’IgG circulantes chez le nourrisson atteignent un nadir qui correspond à un moment de grande sensibilité aux infections. Vers l’âge d’un an, les taux d’IgM, IgG et IgA atteignent respectivement 75%, 60% et 20% de ceux trouvés chez l’adulte (figure 9). a. Vaccination maternelle Le transfert transplacentaire d’anticorps a permis de développer des stratégies de vaccination maternelle en cours de grossesse pour tenter de protéger le nourrisson contre des infections acquises très tôt après la naissance. On estime que 70% des décès par tétanos néonatal sont ainsi prévenus mondialement grâce à la vaccination maternelle Des vaccinations maternelle contre VHaemophilius injlunzae de type b, le Neisseria meningitidis des groupes A et C, divers sérotypes de pneumocoques, des vaccins polysaccharidiques et conjugués contre le streptocoque de groupe B, des vaccins contre le virus influenza, le virus de la poliomyélite et le virus respiratoire syncitial ont été tentées *56’>57,i93-i98 qu’une augmentation des taux d’anticorps spécifiques aient été montrés à la naissance, l’efficacité clinique de ces vaccins n’a 33 Table 3. Avantages et inconvénients des stratégies de vaccination maternelle. Avantages Inconvénients Protection précoce du nourrisson Faible transfert transplacentaire dans certains systémique (anticorps sériques) et cas, surtout en cas de prématurité ou de mucosale (anticorps du lait maternel) malaria placentaire Protection maternelle Effets secondaires potentiels sur la grossesse Couverture vaccinale : grand accès Possible tolérisation fœtale, inhibition de la médical des femmes enceintes réponse au vaccin du nourrisson pas été démontrée. Dans le cas de la malaria, il semble que les anticorps provenant de la mère ne jouent pas de rôle protecteur majeur chez le nourrisson Bien que la vaccination maternelle soit théoriquement tentante pour la prévention de transmission verticale du VIH ou de l’hépatite B, d’infections à streptocoque de groupe B, à pneumocoque, de bronchiolite ou lors d’épidémies de grippe, certaines limitations s’opposent au développement de cette stratégie (table 3). b. Influence des anticorps maternels sur les réponses humorales du nourrisson La présence d’anticorps maternels dans la circulation du noiurisson peut être responsable d’une inhibition de la capacité de ce dernier à produire ses propres anticorps en réponse à une vaccination ou à une infection. L’inhibition de réponses humorales par des anticorps maternels a été démontrée dans des contextes divers, dont des vaccins peptidiques et protéiques, des vaccins vivants atténués et des vecteurs vivants recombinants, chez l’animal et chez l’homme D’importance clinique, elle a été démontrée pour les vaccins à la toxine diphtérique et tétanique, aux virus vivants et inactivés de la polio, aux vaccins contre la rougeole, les oreillons, la rubéole et l’hépatite A . Par contre, on n’observe pas d’inhibition de la production d’anticorps en réponse au vaccin contre l’hépatite B en présence d’anticorps maternels L’importance clinique de cette inhibition est variable. La faible immimogénicité du vaccin anti-rougeoleux en présence de quantités même faibles d’anticorps maternels impose de retarder l’âge de vaccination à 12-15 mois en pays industrialisés et à 9 mois en pays en voie de développement. Malheureusement, un grand nombre de décès par rougeole surviennent avant l’âge de 9 mois La transmission du virus de la rougeole chez les nourrissons non vaccinés est im des facteurs susceptibles de faire échouer la stratégie actuelle d’éradication de cette maladie élaborée par l’Organisation Mondiale de la Santé Les mécanismes de l’influence des anticorps maternels sur la réponse du nourrisson à l’infection naturelle ou à la vaccination ne sont pas élucidés. Plusieurs mécanismes 34 sont possibles : masquage épitopique et élimination des complexes antigènesanticorps, destruction du vecteur vaccinal par activation du complément ou cytotoxicité dépendante des anticorps, influence complexe de réseaux idiotypiques 200,201 tentative d’élucider l’influence de divers facteurs, il a été démontré que le rôle inhibiteur des anticorps maternels est spécifique de l’épitope. Les stratégies d’immunisation maternelle pourraient donc inclure des épitopes distincts de ceux utilisés pour la vaccination des nourrissons. Par ailleurs, l’effet inhibiteur des anticorps maternels dépend du rapport de concentration entre ceux-ci et les antigènes vaccinaux Malgré cela, des stratégies visant à augmenter la dose du vaccin anti­ rougeoleux se sont avérées dangereuses. En Guinée-Bissau, la vaccination à haute dose contre la rougeole s’est accompagnée d’un excès inexpliqué de mortalité 212 c. Influence des anticorps maternels sur les réponses T du nourrisson Il semble que les réponses cellulaires des lymphocytes T soient moins sujettes à l’inhibition par les anticorps maternels que les réponses humorales. La formation de complexes immuns lors de la liaison de l’anticorps maternel à l’antigène pourrait favoriser la capture de l’antigène par les cellules phagocytaires grâce à l’expression par celles-ci de récepteurs de portion constante des immunoglobulines. Les cellules phagocytaires pourront dès lors présenter l’antigène aux lymphocytes T. Ainsi, l’injection expérimentale de hauts taux d’anticorps maternels à des souriceaux inhibe complètement la génération d’anticorps en réponse à des vaccins contre la rougeole et le tétanos mais n’affecte pas les réponses prolifératives et la production de cytokines 911 . L’absence d’effet des anticorps maternels sm la génération de CTL a également été rapportée dans divers modèles expérimentaux Chez l’homme, on n’observe pas d’effet des anticorps maternels sur la réponse T au vaccin anti-rougeoleux administré à 6, 10 ou 12 mois L’existence de la génération d’une réponse T sans réponse humorale après vaccination en présence d’anticorps maternels pourrait contribuer à accélérer la production d’anticorps au cours d’immunisations subséquentes, et conférer déjà un certain degré de protection en cas d’exposition au pathogène. En effet, malgré l’absence de production d’anticorps par le nourrisson après une première vaccination anti-rougeoleuse en présence d’anticorps maternels, on observe une production rapide d’IgG en réponse à 35 une seconde vaccination * 5^-2''♦■2 *5 j^g même, une protection clinique contre la rougeole sévère est observée chez des enfants qui n’ont pas développé de réponse humorale après vaccination précoce Il sera peut-être possible de contourner l’effet inhibiteur des anticorps maternels grâce à de nouvelles technologies. Le principe recherché est de limiter l’accès de l’anticorps maternel à l’antigène vaccinal et de permettre \me libération lente de l’antigène afin que la réaction primaire se prolonge jusqu’à ce que l’effet des anticorps maternels s’estompe. Des résultats prometteurs ont été observés chez l’animal lorsque l’antigène est délivré à l’intérieur d’une matrice lipidique 78,79,201 ou avec les vaccins à l’ADN jgg réponses T aux vaccins à l’ADN semblent peu affectées par les anticorps maternels, les réponses humorales semblent l’être . Ensemble, ces résultats suggèrent que la vaccination précoce est associée à des réponses humorales de faible amplitude, de courte durée, de faible affinité. Les possibilités de commutation isotypique sont réduites. Néanmoins, l’administration précoce d’une dose de vaccin peut induire des réponses secondaires amples et rapides lors de doses ultérieures. L’intervalle entre les doses et l’âge d’administration de la dernière dose sont des facteurs important dans la génération de la protection souhaitée. Le recmtement de l’aide des lymphocytes T auxiliaires au cours de la réaction immune primaire est essentiel à l’activation optimale de la réponse humorale. Le transfert transplacentaire d’anticorps permet des stratégies d’immvmisation maternelle pour la protection du jeune nourrisson, mais est responsable d’une inhibition de ses réponses humorales. De nouvelles stratégies devraient être développées pour accroître l’immunogénicité des vaccins administrés au nourrisson malgré la présence d’anticorps maternels. Nous présentons, plus loin dans ce travail, une comparaison des taux d’anticorps induits par les vaccins contre la poliomyélite et l’hépatite B chez des nourrissons et des adultes. Nous avons également étudié l’effet du BCG sur ces réponses. 36 IV. MODULATION PRE- ET POSTNATALE DU SYSTEME IMMUNITAIRE 1. Environnement immunologique de la grossesse La situation intra-utérine du fœtus en gestation est tout à fait pEirticulière au niveau immunologique puisqu'il constitue une greffe physiologique semi-allogénique pour la mère. En effet, la moitié des molécules exprimées à la surface des cellules fœtales sont d’origine paternelle, ce qui, en d’autres circonstances, aboutirait à une réaction immunologique de rejet de greffe. De nombreux mécanismes empêchent cette réaction. La barrière placentaire limite les échanges de cellules immunes de part et d’autre de la circulation sanguine. Cette barrière n’est toutefois pas totale, des cellules d’origine fœtale ayant été retrouvées dans la circulation maternelle et vice versa . A la jonction entre les cellules maternelles (cellules de la decidua) et fœtales (cellules du syncitiotrophoblaste), les cellules du fœtus n’expriment pas de molécules du CMH autres que quelques molécules HLA-C et des molécules HLA-G très peu polymorphiques, qui n’activent pas les cellules cytotoxiques CD8 maternelles. L’action cytotoxique des cellules Natural Killers, présentes en grand nombre dans la décidua, est inhibée grâce à l’expression à leur surface de récepteurs inhibiteurs de la cytotoxicité qui lient spécifiquement l’HLA-G. De même, les cellules trophoblastiques semblent exprimer Fas-ligand, une molécule capable d’induire la mort cellulaire programmée des cellules lymphoïdes susceptibles d’attaquer la greffe fœtale Outre ces éléments qui tendent à isoler le fœtus des cellules cytotoxiques maternelles, un environnement immunologique particulier est maintenu autour de l’unité utéroplacentaire grâce à la production de facteurs solubles (hormones stéroïdiennes, Leukemia Inhibitory Factor, IL-10 et PGE2) par des cellules lymphoïdes mais également par l’épithélium utérin et le tissu trophoblastique La production de facteurs pro-inflammatoires comme le TNF-a et l’IFN-y, qui ont un rôle toxique sur l’implantation et la croissance fœtale, y est inhibée La grossesse est donc accompagnée d’une modulation des réponses immunes maternelles caractérisée par une inhibition des réponses Thl et une expansion des réponses Th2 Quelque peu schématique, cette analyse est compatible avec bien des observations cliniques chez 37 les femmes enceintes, qui présentent une susceptibilité augmentée vis-à-vis d’infections intracellulaires habituellement contrôlées par une réaction de type Thl, telles la malaria, la tuberculose, les poussées lépromateuses, la toxoplasmose . On observe aussi, au cours de la grossesse, une aggravation de maladies auto-immimes médiées par une réaction inflammatoire de type Th2 comme le lupus érythémateux, alors que d’autres maladies auto-immunes médiées par une réaction de type Thl, comme l’arthrite rhumatoïde, ont tendance à s’améliorer Malgré la nécessité de contrôler les réponses immunes inflammatoires autour de l’unité fœtoplacentaire, la femme enceinte n’est pas profondément immunodéprimée. Ceci pourrait être lié à une activation compensatoire de l’immimité naturelle au cours de la grossesse. En effet, de nombreux marqueurs d’activation monocytaire s’élèvent dans la circulation de la femme enceinte. On observe une augmentation du nombre de monocytes et neutrophiles, qui expriment des marqueurs de phénotype activé. L’activité phagocytaire, oxydative, et l’expression du récepteur de l’endotoxine par les monocytes augmentent. Les taux de protéines de phase aiguë augmentent. L’origine de cette activation monocytaire n’est pas connue, mais pourrait dériver de la libération de vésicules trophoblastiques dans la circulation maternelle ’ . Une évolution pathologique de la grossesse peut résulter de la rupture du fragile équilibre immunologique développé autour de fœtus et de ses annexes. C’est le cas dans certaines fausses couches d’origine inexpliquée, de l’éclampsie, du choc endotoxémique ou de la chorio-amniotite, où l’on observe une libération de facteurs pro-inflammatoires s’apparentant à un rejet de greffe Des infections peuvent se développer autour de l’imité utéro-placentaire à la faveur du climat immunitaire qui y règne, y induisant une activation immunitaire, des lésions histologiques, et dans certains cas, l’interruption de la grossesse. Des globules rouges infectés par Plasmodium falciparum peuvent être séquestrés au niveau du placenta et y induire le production de cytokines Thl associées à un risque élevé de retard de croissance, d’accouchement prématuré, de mortalité fœtale et maternelle Le VIH peut infecter les cellules du syncitiotrophoblaste, causer des lésions placentaires et s’accompagner d’une production locale accrue de TNF-a L’infection maternelle par Trypanosoma cruzi (T. cruzi) peut s’accompagner d’infiltrats inflammatoires du 38 placenta, au sein desquels on retrouve des lymphocytes CD8 en grand nombre. Ici aussi, la croissance fœtale est menacée Des travaux menés chez la souris ont permis de démontrer le rôle toxique du TNF-a sur la survie de fœtus de mère infectée par T. cnizi De nombreuses autres infections peuvent s’accompagner d’infection et d’inflammation du placenta, prélude possible au retard de croissance, à l’interruption de la grossesse et à l’infection congénitale. 2. Modulation prénatale du système immunitaire du nourrisson Nous avons vu plus haut que le fœtus exposé à des antigènes in utero peut développer des réponses humorales et cellulaires. Celles-ci sont susceptibles d’affecter la réponse immune post-natale au même antigène. Ainsi, l’exposition intra-utérine à des allergènes allergiques semble promouvoir le développement ultérieur de manifestations De même, l’exposition prénatale à des antigènes d’helminthes peut influencer le décours d’une helminthiase post-natale. Etant donné la complexité de la physiopathologie des lésions induites par les filaires et le rôle toxique des phénomènes inflammatoires, les mécanismes de cette modulation de la pathologie sont inconnus. Délétion clonale (mort des lymphocytes spécifiques de l’antigène), anergie (les lymphocytes spécifiques existent mais ne sont pas activés par l’antigène) et déviation immune (modulation du profil de production de cytokines) ont été suggérées Comme nous l’avons vu plus haut, les anticorps maternels peuvent également interférer avec la capacité du nourrisson à développer ses propres réponses immunes 200 Le développement du système immunitaire du nouveau-né et du nourrisson peut également être influencé de manière non spécifique par l’environnement immunologique intra-utérin. Chez la souris, on considère que l’environnement hormonal et immunologique autour de l’unité utéroplacentaire est un des facteurs responsables de la tendance des nouveau-nés à développer des réponses immunes de type Th2 On peut s’interroger sur les conséquences pour le développement du système immunitaire fœtal et pour la santé de l’individu à naître de l’infection placentaire ou de tout autre événement intra-utérin capable de perturber l’équilibre immunologique fi-agile qui y règne. De nombreux travaux épidémiologiques ont 39 suggéré le rôle de divers stress nutritionnels ou infectieux au cours de grossesse et en début de vie dans la susceptibilité au développement de pathologies aussi diverses que les maladies cardio-vasculaires, le cancer, le diabète, les infections, les maladies respiratoires et auto-immimes Certains chercheurs pensent que le système immunitaire subit une programmation en début de vie susceptible d’influencer les fonctions immunes tout au long de l’existence. Chez l’animal adulte, la fonction thymique et les réponses humorales peuvent être affectées par des antécédents de malnutrition in utero générations dont les conséquences peuvent s’étaler sur plusieurs Chez l’homme, le poids de naissance serait corrélé aux taux d’IGE sériques chez l’adulte Une étude menée en Gambie, où la malnutrition est saisonnière, suggère que la mortalité liée aux infections chez l’adulte est liée à la saison de naissance Néanmoins, cette hypothèse repose sur l’analyse de données épidémiologiques rétrospectives et les liens de causalité entre les variables étudiées sont difficiles à établir. Peu d’études fondamentales se sont intéressées à la modulation du système immunitaire adaptatif par un stress intra-utérin. Au Kenya, il a été montré que naître de mère infectée par des helminthes inhibe l’amplitude de la réponse Thl induite par le vaccin BCG au cours des premiers mois de la vie . On peut émettre l’hypothèse que pour parvenir à une modulation du système immunitaire adaptatif, une modulation de système immunitaire inné, dont dépend l’activation du système immunitaire adaptatif, est initialement requise. Peu de travaux se sont intéressés aux fonctions du système immunitaire inné néonatal dans le cadre de pathologies intrautérines. Une inhibition de la capacité à produire de l’IL-12 chez des nouveau-nés non infectés nés de mère infectée par le VIH a été démontrée On pourrait trouver là une explication à l’observation faite en Gambie de cicatrices de vaccin BCG plus petites chez des enfants non infectés nés de mère séropositives pour le VIH que chez des enfants nés de mères non infectées Dans ce travail, nous présenterons les résultats d’ime étude de l’influence de l’infection maternelle à T. cruzi sur la capacité de cellules de sang de cordon de nouveau-nés non infectés à produire des cytokines pro- et anti-inflammatoires en réponse à des antigènes de T. cruzi ou à une stimulation non antigénique. Nous avons 40 recherché l’activation du système immunitaire fœtal iimé et adaptatif par l’infection maternelle. 3. Modulation postnatale des réponses immunes du nourrisson La naissance s’accompagne du passage d’un environnement stérile à un environnement septique, avec la nécessité de développer une balance homéostasique caractérisée par une tolérance à des agents inoffensifs (flore bactérienne commensale, antigènes alimentaires, pollens, poussières) et une immunité protectrice vis-à-vis d’agents pathogènes (virus, bactéries, parasites) qui visitent les voies muqueuses. Une rupture des mécanismes de tolérance peut signifier le développement d’allergie, d’auto-immunité ou de maladies inflammatoires, alors qu’ime déficience des mécanismes de protection peut être responsable de maladies infectieuses invasives. Les mécanismes régulant cette balance entre tolérance et immunisation sont peu connus. Plusieurs investigateurs ont formulé une hypothèse « hygiénique », attribuant un rôle important de l’exposition à divers pathogènes et germes commensaux an cours des premières années de vie sur le développement du système immunitaire Selon cette hypothèse, la différence de prévalence de l’atopie et de l’asthme en pays développés et en pays tropicaux s’explique par des différences dans l’exposition aux agents pathogènes et germes commensaux au cours de la petite enfance ’ . Il a été démontré que l’entrée précoce dans un environnement partagé avec d’autres enfants, où diverses infections sont fréquemment acquises, ainsi que la présence dans la famille d’un nombre élevé de fi-ères et de sœurs, un mode de vie rural dans un environnement fermier, et la présence d’un chien dans la maison diminuent le risque de développer de l’asthme et d’autres manifestations atopiques 255.257.258 constitution de la flore bactérienne digestive pourrait jouer un rôle important. Les animaux de laboratoire élevés en milieu stérile présentent effectivement de nombreuses perturbations de l’homéostasie mucosale et systémique 254.259 bactéries pathogènes peuvent induire dans les cellules épithéliales l’activation de la voie NF-kB responsable de la synthèse de cytokines, chémokines et autres molécules activant et/ou recrutant les lymphocytes T, alors que des bactéries non pathogènes peuvent inhiber la voie NF-kB Ces observations sont sur le point de trouver des 41 applications cliniques : il a été démontré récemment que l’administration entérique de lactobacille à des nourrissons peut contribuer à la prévention de manifestations atopiques De même, l’administration fréquente de traitements antibiotiques affectant la flore commensale semble favoriser le développement de manifestations allergiques Supportant l’hypothèse hygiénique, plusieurs études épidémiologiques rétrospectives ont montré rme association entre un risque réduit d’allergie et la présence d’une réaction cutanée positive à la tuberculine, ou des antécédents de vaccination précoce par le BCG et d’infections telles la rougeole et l’hépatite A, Pour expliquer ces observations, on a proposé qu’une stimulation répétée de la production d’IFN-y suite à l’exposition à des facteius pro-inflammatoires réduirait la tendance à développer des réaction immunes de type Th2 favorables au développement de l’asthme et de l’atopie L’hypothèse hygiénique a néanmoins été abondamment contestée, certains biais fréquents dans les études rétrospectives ne pouvant être écartés Des études prospectives et contrôlées sont nécessaires pour déterminer les effets potentiels de vaccins et pathogènes infectieux sur le développement des réponses immunes au cours de la prime enfance. Dans ce travail, nous avons étudié de manière prospective l’effet du vaccin BCG sur les réponses immunitaires autres vaccins administrés au nourrisson. 42 BUTS DU TRAVAIL La protection précoce des nourrissons contre les maladies infectieuses est un enjeu essentiel des stratégies de vaccinations. Un approfondissement des connaissances concernant les réponses immunes néonatales est nécessaire. En particulier, les fonctions des lymphocytes T activés in vivo en début de vie humaine sont peu connues. L’objectif de notre travail était d’abord d’évaluer les propriétés des lymphocytes T auxiliaires activés par la vaccination néonatale, chez l’homme. Dans ce but, nous avons comparé les réponses lymphocytaires de nourrissons vaccinés dès la naissance contre la tuberculose, la poliomyélite et l’hépatite B à celles observées chez des adultes immuns. Ayant démontré le caractère fortement inummogène du BCG, nous avons voulu évaluer sa capacité à moduler les réponses immunes cellulaires et humorales aux autres vaccins du nourrisson. De même que le BCG est responsable d’une stimulation immune susceptible de moduler le développement d’autres réponses vaccinales, une infection maternelle durant la grossesse est susceptible de moduler les fonctions immunes en début de vie. Nous avons donc étudié l’influence de l’infection maternelle à T. Cruzi sur la production de cytokines par des cellules de sang de cordon ombilical. 44 RESULTATS 45 1. La vaccination néonatale par le bacille de Calmette-Guérin induit la production d’IFN-y par les lymphocytes CD4 Résumé • Objectif Nous avons étudié la fonction des lymphocytes T CD4 activés par la vaccination néonatale au BCG. La production de cytokines par des cellules sanguines de nourrissons vaccinés à la naissance par le BCG et d’adultes immuns a été comparée, afin de déterminer si les nouveau-nés sont capables de produire une réponse immune T auxiliaire de type mature. • Résultats On observe chez des nourrissons vaccinés au BCG mais pas chez des nourrissons non vaccinés une production importante d’IFN-y par les cellules sanguines mononucléées (PBMC) stimulés à la tuberculine (PPD), et très peu de cytokines Th2 (IL-4 et IL-5). Des expériences de purifications cellulaires et de marquage de cytokines intracellulaires démontre que les CD4 sont la principale source d’IFN-y. Les taux de cytokines tant Thl que Th2 produits par des nourrissons vaccinés sont similaires à ceux trouvés chez l’adulte immun. L’analyse de clones spécifiques de la PPD de nourrissons vaccinés et d’adultes immuns démontre que l’IFN-y est produit majoritairement par des clones Thl et ThO, chez le nourrisson comme chez l’adulte. On n’observe pas plus de clones Th2 chez le nourrisson. • Conclusions Les nouveau-nés humains sont capables de produire une réponse immune T auxiliaire caractérisée par la production de quantités importantes d’IFN-y en réponse au vaccin BCG. Lfne analyse de la polarisation Thl/Th2 démontre qu’on ne retrouve pas de biais Th2 chez le nourrisson, en comparaison à l’adulte. 46 Eur. J. Immunol. 2001.37; 1531-1535 Helper T cell response to néonatal BCG vaccination 1531 Néonatal bacillus Calmette-Guérin vaccination induces adult-like IFN-y production by CD4^ T lymphocytes Johan Vekemans' ^, Amedeo Amedei^ Martin O. Ota\ Mario M. D’Elios^ Tessa Goetghebuer', Jamila lsmaili^ Meianie J. Newport'Gianfranco Dei Prete^ Michei Goidman^, Keith P. W. J. McAdam* and Arnaud Marchant' ' Medical Research Council Laboratories, The Gambia ^ Immunologie Expérimentale, Université Libre de Bruxelies, Brussels, Belgium ® Department of internai Medicine, University of Florence, Florence, Italy ' Wellcome Trust Center for Molecular Mechanisms in Disease, Addenbrooke’s Hospital, Hills Road, Cambridge, GB The immaturity of the néonatal immune System in mice is associated \«ith defective IFN-y production and Th2-biased immune responses. In this study, infants vaccinated at birth with BCG produced similar concentrations of IFN-y in response to PPD and showed similar frequencies of IFN-y-producing lymphocytes as compared to immune adults. Infants and adults produced only lo\« concentrations of IL-4 and IL-5. CD4* T lymphocytes were the main source of IFN-y. Similar proportions of Thi and ThO PPD-specific T cell clones were observed in infants and adults. This study demonstrates that the human néonatal immune response to BCG is not biased towards Th2 and is characterized by the prédominant pro­ duction of IFN-y by CD4* T lymphocytes. Key words: Néonatal immunology / Vaccination / Thi /Th2 1 Introduction The immaturity of the immune System during early life is responsibie for the susceptibility of young infants to pathogens and limits the induction of protective immune responses by vaccines [1]. Studies performed in animais indicate that newborn mice are defective in Thi and biased towards Th2 type immune responses. Such a bias towards Th2 responses would reduce the efficacy of vaccines against intracellular pathogens [2-4]. In humans, the presence of a Th2 bias in early life remains controversial [4-6]. Reduced production of IFN-y, IL-4 and IL-5 has been observed following in vitro polyclonal activation of cord blood as compared to adult lymphocytes [7]. However, under optimal conditions of co-stimulation the maturation of cord blood and adult naive T cells into Th1 or Th2 effector cells appears to be similar [8]. Little is known about in vivo T cell immune responses in human newborns. Trans-placental exposure to allergens or helminth antigens leads to prédomi­ nant Th2 type responses [9, 10]. We hâve recently observed that néonatal Mycobacterium bovis BCG vac[I 21544] Abbreviation: PPD: Protein purified dérivative © WILEY-VCH Verlag GmbH, D-69451 Weinheim, 2001 Received Revised Accepted 14/12/00 25/1/01 14/2/01 cination activâtes IFN-y-producing T cells [11]. The pré­ sent study was undertaken to characterize the fonction of CD4* T cells activated by néonatal BCG vaccination and to compare it to that observed in immune adults. 2 Results and discussion 2.1 Cytokine production by PPD-stimuiated PBMC from BCG-vaccinated infants and immune adults The production of IFN-y and IL-5 by PBMC stimulated in vitro with PPD or PHA was studied in 26 2-month-old infants vaccinated at birth with BCG and compared to 21 immune adults. Preliminary experiments indicated that no IL-4 production could be detected in response to PPD in BCG-vaccinated infants and immune adults (data not shown). As shown in Fig. 1, IFN-y was the prédomi­ nant cytokine produced by PPD-stimulated PBMC both in infants and adults. BCG-vaccinated infants produced similar concentrations of IFN-y in response to PPD as compared to immune adults whereas only low concen­ trations of IL-5 were detected in both groupe, in keeping with our previous observations [11], In contrast, higher concentrations of IFN-y and IL-5 were induced by PHA in adults than in infants, indicating that the defective pro0014-2980/01/0505-1531 $17.50 + .50/0 1532 Eur. J. Immunol. 2001.37; 1531-1535 J. Vekemans et al. PPD PHA I------ \ Infants AdultS Fig. 1. IFN-y and lL-5 concentrations were measured in supernatants of PPD and PHA-stimulated PBMC from BCGvaccinated infants (empty boxes, n = 26) and immune adults (hatched boxes, n = 21). Géométrie means and confidence intervals are shown. *: p < 0.001. duction of type 1 and type 2 cytokines in response to mitogens observed at birth is still présent at 2 months of life. PBMC from 2-month-old infants who had not been vaccinated with BCG produced no détectable concen­ trations of IFN-y or IL-5 in response to PPD (data not shown). The frequency of lymphocytes producing IFN-y after short-term stimulation with PPD was determined in 6 BCG-vaccinated infants and 6 immune adults. As presented in Table 1, similar frequencies were observed in infants and adults. In contrast, the frequency of cells pro­ ducing IFN-y in response to PHA was lower in infants than in adults. I------1 PBMC rpTpm CD4 depleted PBMC Purified CD4 and monocytes Fig. 2. PBMC. CD4-depleted PBMC and purified CD4 with monocytes obtained from four BCG-vaccinated infants were stimulated with PPD or PMA-ionomycin. Médian IFN-y con­ centrations (pg/ml) and ranges are presented. (1): undetectable. P <0.05. trois (Fig. 3, left panel). Together, these results indicate that after néonatal BCG vaccination CD4* T lymphocytes represent the major source of IFN-y following PPD stimu­ lation, as previousiy observed in BCG-vaccinated adults [12]. PPD is a mixture of soluble protein antigens and was selected to investigate the fonction of CD4* T lympho­ cytes. Other antigens and APC should be used to study the response of other cell types such as CD8* T lympho­ cytes, yô T cells and CD4/CD8 double-negative T cells to néonatal BCG vaccination. 2.2 CD4* T cells produce IFN-y after néonatal BCG vaccination The rôle of CD4* lymphocytes in the production of IFN-y was determined by cell déplétion and purification expéri­ menta. As shown in Fig. 2, déplétion of CD4^ T cells abrogated the production of IFN-y by PPD-stimulated PBMC whereas it had no influence on the production of IFN-y induced by ionomycin and PMA. Co-incubation of purified CD4* T cells and monocytes in the presence of PPD or ionomycin/PMA induced the production of high con­ centrations of IFN-y. To evaluate directiy the rôle of CD4* cells, the intracytoplasmic content of IFN-y was studied in PPD-stimulated PBMC. Fig. 3 shows that in BCGvaccinated infants (right panel), virtually ail CD3* lympocytes expressing IFN-y were CD4 positive. No IFN-y was detected in PBMC obtained from non-vaccinated con- CD4 Fig. 3. Intra-cytoplasmic IFN-y staining in PPD-stimulated PBMC. CD3* gated cells are shown. Left panel: unvaccinated infant. Right panel: infant vaccinated at birth with BCG. The figure shows one experiment représentative of six. Staining by isotype control mAb was negligible in ail samples. Eur. J. Immunol. 2001.3J; 1531-1535 2.3 Proportion of Th1, ThO, and Th2 T cell clones in infants and adults The prédominant IFN-y production by CD4* T cells, associated with low production of IL-4 and IL-5, suggests that néonatal BCG vaccination activâtes a Thi response. In order to test this hypothesis further, the quality of the cytokine response was evaluated at the clonal level. A total number of 180 CD4* T cell clones were obtained from PPD-induced T cell Unes derived from five BCG-vaccinated infants. These clones \were compared to 219 CD4* T cell clones derived from five immune adults. Among the clones derived from vaccinated infants, 17 (9 %) were spécifie for PPD whereas 92 (42 %) of the adult clones were PPD spécifie. As shown in Fig. 4 (left panel), 41 % of PPD-specific clones from BCG-vaccinated infants were Thi clones and 59 % were ThO clones producing both IFN-y and IL-4 and/or IL-5. A similar profile was observed in adults. Most adult PPDspecific clones were Thi or ThO clones (47 and 40 %, respectively) and 13 % of them were Th2 clones produc­ ing IL-4 and/or IL-5 but not IFN-y. The high frequency of clones producing IL-4 and/or IL-5 in infants and adults suggests a more sensitive détection of Th2 cytokines by clonal analysis as compared to bulk cultures. Among the clones of undefined specificity, the profile of cytokines poduced was aiso similar in infants and adults (Fig. 4, right panel), indicating that during the différentiation of PPD-specific T cell Unes, bystander lymphocytes had similar patterns of différentiation in infants and adults. PPD-specific clones Clones of undefined specificity HelperT cell response to néonatal BCG vaccination 1533 Table 1. Frequency of IFN-y-producing lymphocytes in BCG-vaccinated infants (r? = 6) and immune adults (n = 6) as defined by ELISPOT assay. Infant Adult P PPD 245 (35-1820) 330(275- 980) 0.5 PHA 2725 (285-3850) 4710 (3060-5685) 0.01 a) Médian number of spots per 10“ PBMC (ranges) are presented. In newborn mice, adult-like CD4* lymphocyte responses can be induced under optimal conditions of antigen pré­ sentation [6,13-15]. In vitro studies indicate that human cord blood monocytes and dendritic cells hâve lower costimulatory properties than adult cells [16,17). Mycobac­ teria, including BCG, are potent stimulators of adult APC [18). The effect of BCG on APC obtained from newborns has not been reported. We hypothesize that the prédom­ inant IFN-y response induced by BCG in newborn is dépendent on its ability to increase the co-stimulatory properties of néonatal APC. We conclude that néonatal BCG vaccination induces adult-like IFN-y production by CD4* T lymphocytes. Studies of the immune response to other néonatal vac­ cines should allow us to evaluate further whether the function of CD4* T lymphocytes differs qualitatively in human newborns and adults. 3 Materials and methods 3.1 Study subjects This study was approved by the Gambian Government/ MRC joint Ethics Committee. Healthy newborns were enrolled at Serrekunda Health Centre after maternai con­ sent. Newborns were randomly assigned to receive intradermal BCG (0.1 ml, Statens Sérum Institute, Denmark) vac­ cination at birth or at the âge of 2 months. At 2 months a blood sample was collected. Healthy Gambian adult volunteers (âge range: 17-42) who had been vaccinated with BCG in chiidhood and had a BCG scar were enrolled as Con­ trols. I------1 Th1 V7777^ ThO Th2 F/g. 4. Cytokine profile of CD4* T cell clones spécifie for PPD or of undefined specificity obtained from BCGvaccinated infants and immune adults. No significant différ­ ence was observed between infants and adults. 3.2 In vitro lymphocyte stimulation with PPD PBMC, isolated by density gradient centrifugation, were suspended in complété culture medium supplemented with 10 % heat-inactivated human AB sérum (Sigma Chemicals, St Louis, MO). Total PBMC, CD4-depleted PBMC or CD4- 1534 J. Vekemans et al. enriched lymphocytes were incubated in medium alone or in the presence of PPD (2 to 10 ng/ml, RT48, Statens Sérum Institute, Denmark), PHA-L (5 ng/ml, Sigma Chemicals) or the combination of PMA (0.01 jig/ml, Sigma Chemicais) and ionomycin (0.5 ng/ml, Sigma Chemicals) at 37 °C in 5 % COj. Concentrations of IFN-y, IL-4 and IL-5 were determined in supernatants collected on day 2 (mitogens) or day 6 (PPD) using commercially available ELISA kits (BioSource Europe, Fleurus, Beigium). 3.3 PPD-specific IFN-y-producing lymphocyte frequencies The frequency of IFN-y-producing lymphocytes was determined by ELISPOT using commercially available reagents according to the recommendations of the manufacturer (Mabtech, Stockholm, Sweden). PBMC (2 x 10^/well) were incubated in 96-well ELISPOT plates (MAIPS45, Millipore, Bedford, MA) in the presence of PPD or PHA for 16 h. The number of spot-forming cells were counted using an automated Eiispot reader (AID Autoimmun Diagnostic GmbH, Strassberg, Germany). 3.4 CD4 lymphocyte déplétion and purification PBMC were depieted of CD4* lymphocytes using anti-CD4coated magnetic beads (Miltenyi Biotec, Bergisch Giadbach, Germany). CD4"^ lymphocytes and monocytes were purified by négative seiection (Miltenyi Biotec). The purity of the isolated celi populations was over 95 % as assessed by flow cytometry. 3.5 IFN-y intracytoplasmic staining Brefeldin A (10|xg/ml, Sigma Chemicals) was added to PPD-stimulated wells for the last 16 h of the 6-day culture. Cells were then stained with anti-CD3 and anti-CD4 fluores­ cent mAb (Becton Dickinson, San-Jose, CA), permeabilized (Cytofix/Cytoperm, Pharmingen, San Diego, CA), and stained with anti-IFN-y or isotype control fluorescent mAb (Pharmingen). Cell fluorescence was measured by flow cytometry (FACSCalibur, Becton Dickinson). Eur. J. Immunol. 2001.37; 1531-1535 phenotype of T cell clones was examined by flow cytometry. For the détermination of cytokine production, 10® T cell blasts were incubated with 1.2% PHA for 36 h. PHAstimuiated feeder celis aione produced <100 pg/ml IFN-y, <10 pg/ml IL-4 and < 60 pg/ml IL-5. T cell clones producing only IFN-y were considered as Thi, clones producing IFN-y and IL-4 and/or IL-5 were considered as ThO; clones producing IL-4 and/or IL-5 were considered as Th2. To assess their reactivity to PPD, 4 x 10'* T ceil blasts were cocultured for 60 h with irradiated autologous PBMC (8 x 10*) and medium aione or PPD (1 ng/ml). Prolifération was mea­ sured by [®H] thymidine incorporation during the last 16 h of culture. A clone was defined as PPD spécifie when stimula­ tion index was > 5. 3.7 Statistics Cytokines concentration means in infants and adufts were compared with the Student’s f-test on log transformed data after subtraction of concentrations measured in unstimulated sampies. Frequencies of IFN-y-producing lympho­ cytes were compared using the Mann-Whitney U test after subtraction of the number of spots measured in unstimulated sampies. IFN-y production by total PBMC, CD4depleted PBMC and purified CD4 lymphocytes were com­ pared using the Kruskal-Wallis test. Proportions of Thi, ThO and Th2 clones were compared with a global Fisher exact test for spécifie clones and with a global chi-square test for clones of undefined specificity. Acknowledgements; We appreciate the expert assistance of Mrs. Isatou Drammeh, Mr. Bunja Kebbe, Mr. Mamadi Sidibeh and Mr. Samba Sowe who conducted the field work of the study. We thank the nurses of the Serrekunda Heaith Centre where babies were enrolled. Most of ail, we are grateful to the mothers who agreed to participate in this study. This research project received financial support from the Medical Research Council and the WHO Vaccines and Other Biologicals. Johan Vekemans is supported by a grant from the Belgian “Fonds National de la Recherche Scientifique”. References 3.6 Génération of T ceii ciones 1 Lambert, P. H. and Siegrist, C. A., Science, medicine, and the future: Vaccine and vaccination. Br. Med. J. 315:1595-1598, PPD-specific T cell Unes were generated as described previously [19]. Briefly, 2x10® PBMC were incubated in the pres­ ence of 2.5 ng/ml PPD for 12 days. Human rlL-2 (25 U/ml, Chiron BV, Amsterdam, Holland) was added for the last 6 days of culture. T cell blasts were seeded under limiting dilution conditions (0.3 cells/well) with irradiated allogeneic PBMC (lOVwell; feeder cells), PHA (1 % vol/vol, Gibco Lab­ oratories, Grand Island, NY) and rlL-2 (25 U/ml). rlL-2 (25 U/ ml) and 10® feeder cells were added at weekiy intervals. The 2 Forsthuber, T., Yip, H. H. C. and Lehmann, P. V., Induction of Thi and Th2 immunity in early life. Science 1996. 271: 1728-1730. 3 Barrios, C., Brawand, P., Berney, M., Brandt, C., Lambert, P. H. and Siegrist, C. A., Néonatal and early life immune responses to various forms of vaccine antigens differ from adutt responses: prédominance of a Th2-biased pattern which persiste after adult boosting. Eur. J. Immunol. 1996. 26: 1489-1496, 4 Kovarik, J., Bozzotti, P., Love-Homan, L., PihIgren, M., Davis, H. L., Lambert, P. H., Krieg, A. M. and Siegrist, C. A., CpG Oli- Eur. J. Immunol. 2001.31; 1531-1535 Helper T cell response to néonatal BCG vaccination 1535 gonucleotides can circumvent the Th2 polarization of néonatal responses to vaccines but may fail to fully redirect Th2 responses established by néonatal priming. J. Immunol. 1999. 162: 1611-1617. 13 Ridge, J. P., Fuchs, E. J. and Matzinger, P., Néonatal tolérance revisited: turning on newborn T cells with dendritic cells. Science 1996.271:1723-1726. 5 Siegrist, C. A., Vaccination in the néonatal period and early infancy. Int. Rev. Immunol. 2000. 19:195-219. 14 Flamand, V., Donkier, V., Demoor, F. X., Le Moine, A., Matthys, P., Vanderhaegen, M. L., Tagawa, Y., Iwakura, Y., Billiau, A., Abramowicz, D. and Goldman, M., CD40 ligation prevents néo­ natal tolérance. J. Immunol. 1998. 160: 4666-4669. 6 Adkins, B., T cell function in newbom mice and humans. Immu­ nol. Today 1999. 20: 330-335. 7 Lewis, D. B., Yu, C. C., Meyer, J., English, B. K., Kahn, S. J. and Wilson, C. B., Cellular and molecular mechanisms for reduced interleukin 4 and interferon-y production by néonatal T cells. J. Clin. Invest. 1991. 87: 194-202. 8 Delespesse, G., Yang, L. P., Ohshima, Y., Demeure, C., Sho, U., Byun, D. G. and Sarfati, M., Maturation of human néonatal CD4* and CD8* T lymphocytes into Th1/Th2 effectors. Vaccine 1998.16: 1415-1419. 9 Prescott, S. L., Macaubas, C., Holt, B. J., Smallacombe, T. B., Loh, R., Sly, P. D. and Holt, P., Transplacental priming of the human immune System to environmental allergens: universal skewing of initial T cell responses towards the Th2 cytokine pro­ file. J. Immunol. 1998. 160: 4730-4737. 10 Malhotra, I., Mungai, P., Wamachi, A., Kioko, J., Ouma, J. H., Kazura, J. W. and King, C. L., Helminth- and baclllus CalmetteGuérin-induced immunity in children sensitized in utero to filariasis and schistosomiasis. J. Immunol. 1999. 162: 6843-6848. 11 Marchant, A., Goetghebuer, T., Ota, M. O., Wolfe, I., Ceesay, S. J. , De Groote, D., Corrah, T., Bennet, S., Wheeler, J., Huygen, K. , Aaby, P., McAdam, K. P. W. J. and Newport, M. J., Newborns develop a Thi-type immune response to Mycobacterium bovis baclllus Calmette-Guérin vaccination. J. Immunol. 1999. 163: 2249-2255. 12 Ravn, P., Boesen, H., Pedersen, B. K. and Andersen, P., Human T cell responses induced by vaccination with Mycobacte­ rium bovis baclllus Calmette-Guérin. J. Immunoi. 1997. 158: 1949-1955. 15 Bairios, C., BrancH, C., Barney, M., Lambert, P. H. and SiegrisL C. A., Partial correction of the Th1/Th2 imbalance in néona­ tal Immune responses through sélective adjuvant effects. Eur. J. Immunol. 1996. 26: 2666-2670. 16 HunL D. W., Huppertz, H. I., Jiang, H. J. and Petty, R. E., Studies of human cord blood dendritic cells: evidence for functional immaturity. Blood 1994. 84: 4333-4343. 17 Gorielli, S., Vincart, B., Stordeur, P., Vekemans, J., Willems, F., Goldman, M. and De WiL D., Déficient interleukln-12 (p35) gene expression by dendritic cells derived from néonatal monocytes. J. Immurtol. In Press. 18 Henderson, R. A., Watkins, A. S. C. and Flynn, A., Activation of human dendritic cells following infection with Mycobacterium tuberculosis. J. Immunol. 1997.159: 635-643. 19 Del Prêts, G., De Carli, M., Mastomauro, C., Biagiotti, R., Macchia, D., Falagiani, P., Ricci, M. and Romagnani, S., Purlfied protein dérivative of Mycobacterium tuberculosis and excretoty-secretory antigen(s) of Toxocara canis expand in vitro human T cells with stable and opposite (type 1 T helper or type 2 T helper) profile of cytokine production. J. Clin. Invest. 1991. 88: 346-350. Correspondence: Johan Vekemans, Immunologie Expéri­ mentale, Université Libre de Bruxelles, Belgium Fax: +32-2-555-69-14 e-mail: Johan.Vekemans(@ulb.ac.be 2. Réponse immune du nourrisson au vaccin oral contre la poliomyélite Résumé • Objectif Caractériser la réponse immune cellulaire au vaccin oral contre la poliomyélite administré au nourrisson, et comparer cette réponse à celle observée chez des adultes immuns. • Résultats Après quatre doses de vaccin oral contre la poliomyélite, on trouve de hautes concentrations sériques d’anticorps neutralisants dirigés contre les trois sérotypes de virus polio atténués présents dans le vaccin. Les taux d’anticorps post-vaccinaux sont significativement plus élevés que ceux trouvés dans le sérum du sang de cordon des mêmes individus. Ils sont également plus élevés que chez des adultes ayant été immunisé dans l’enfance et ayant reçu récement une dose de rappel. En comparaison à l’adulte, on trouve chez les nourrissons, en réponse à la stimulation de PBMC par des antigènes viraux, des réponses prolifératives et une production d’IFN-y plus faibles. La fréquence de lymphocytes circulants producteurs d’IFN-y en réponse à des antigènes polio est plus faible chez le nourrisson que chez l’adulte. On ne détecte de cytokines Th2 (IL-5 et IL-13) ni chez le nourrisson, ni chez l’adulte. • Conclusions En réponse au vaccin contre la poliomyélite, les nourrissons sont capables de produire une réponse humorale vigoureuse. Par contre, la réponse lymphocytaire proliférative et la production d’IFN-y en réponse à des antigènes polio est plus faible que celle observée chez des adultes immuns. On n’observe néanmoins pas de biais Th2 associé à la vaccination précoce contre la poliomyélite. 47 Manuscript submitted for publication T-cell responses to vaccines in infants: Reduced IFN-y production after oral polio vaccination Johan Vekemans Borysiewicz Martin Ota Hilton Whittle Eddie C. Y. Wang Mike Kidd Leszek K. Keith P. W. J. McAdam *, Gareth Morgan and Arnaud Marchant '. Medical Research Council Laboratories, Fajara, The Gambia Immunologie 'y Expérimentale, Université Libre de Bruxelles, Brussels, Belgium ; and Department of Medicine, section of Infection and Immunity, University of Wales College of Medicine, Cardiff, Wales ^. Informed consent was obtained from adults or mothers of infants enrolled in this study. The Medical Research Council guidelines for good research practices were followed in the conduct of the study. Johan Vekemans is supported by a grant from the Belgian “Fonds National de la Recherche Scientifique”. Corresponding author; Johan Vekemans Immunologie Expérimentale Université Libre de Bruxelles Route de Lennick 808 1070, Brussels, Belgium. Fax: ++ 32.2.675.78.78 E-mail: [email protected] ABSTRACT The immaturity of the néonatal immune System is associated with an increased susceptibility to infections and déficient immune responses to vaccines. Studies in mice indicate that néonatal immune responses are biased towards the T helper 2 type but little is known about helper T cell responses in human newboms. In this study, we show that néonatal immunization with oral polio vaccine induces the production of high titers of neutralizing antibodies but reduced proliférative and IFN-y responses to polio antigens as compared to immune adults. These data suggest that spécifie strategies will be required to immunize newboms against pathogens controlled by Thl type immune responses. INTRODUCTION Néonatal immunization is required to protect against infectious pathogens affecting young infants but is impaired by the immaturity of the immune System [1]. Experiments performed in mice indicate that néonatal immune responses to vaccines are defective in the T helper 1 (Thl) type and biased towards Th2 type responses. Thl lymphocytes are specialized in the production of IFN-y and are essential to the control of intracellular pathogens whereas Tti2 lymphocytes produce interleukin (IL)-4, IL-5 and IL-13 and are involved in allergie disorders [2-4]. An impairment in Thl responses could reduce the efficacy of vaccines against intracellular pathogens affecting young infants such as the respiratory syncytial virus, measles, malaria and the human immunodeficiency virus [1]. Spécifie vaccination strategies may therefore hâve to be developed to immunize young infants against these pathogens. In newbora mice, adult-like Thl type responses can be induced by the administration of Thlpromoting adjuvants, IL-12, CpG-containing oligonucleotides, DNA vaccines or replicating vimses [5]. Relatively little is known about human helper T cell responses in early life. Recent data showing that human cord blood-derived dendritic cells hâve a profound defect in the production of IL-12 suggest that type 1 responses could also be defective in human newboms [6]. Transplacental priming of the fêtai immune System by allergens is associated with Th2 type responses [7]. In contrast, we hâve previously reported that néonatal M bovis Bacillus Calmette-Guérin (BCG) vaccination induces a Thl type response similar to that measured in immune adults [8, 9]. The oral polio vaccine (OPV) is another vaccine given to newboms in developing countries, as part of the strategy to eradicate poliomyelitis. Immunization with multiple doses of OPV in early life induces the production of large amounts of neutralizing antibodies that are essential to protection against poliomyelitis [10]. Although this antibody response is likely to be dépendent on helper T lymphocytes, the T cell response to OPV has not been characterized. This study was undertaken to further characterize helper T cell responses to vaccines in young infants using OPV as a model of oral immunization. T cell prolifération as well as Thl and Th2 cytokine production induced by polio antigens were measured in infants vaccinated at birth, 1, 2 and 3 months of âge and compared to that of immune adults following booster immunization. MATERIAL AND METHODS Study subjects This study was approved by the Gambia Govemment/MRC joint Ethics Committee. Babies were enrolled at birth at Serrekunda Health Center after maternai consent. A sample of cord blood was collected. The infants were vaccinated as recommended by the National Immunization Program, including a dose of OPV (Sabin, Glaxo SmithKline, Rixensart, Belgium) at birth and at the âge of 1, 2 and 3 months. BCG and the first dose of hepatitis B vaccine were also administered at birth. A blood sample was collected 3 weeks after the last dose of OPV. Adult volunteers (âge range: 15-20 years) were recruited from a population living in the rural area of Keneba that has been under epidemiological surveillance by the MRC for over 50 years. According to our records, ail these individuals had received at least three doses of OPV in infancy. For the purpose of the study, they were given a booster dose of OPV and were then bled 3 weeks later. Préparation of polio virus antigens Poliovirus Sabin types 1, 2 and 3 (NIBSC, Hertfordshire, UK), at a stock concentration of 7 TCID50 / 0.1 ml were diluted 1:700 in MEM media supplemented with penicillin (100 lU/ml), streptomycin (100 pg/ml) and /-glutamine (2 mM) (ail from Gibco Laboratories, Grand Islan, NY), and 12 ml were used to seed each of 8 confluent Tl75 flasks of HEp2C cells (European Collection of Cell Cultures, Salisbury, UK). Cytopathic effect was observed after 12-24 h of incubation at 37°C. Virus-containing supematant was harvested, frozen and thawed 3 times, beat inactivated at 56°C for 1 h and frozen for storage. Supematant from non-infected cells was used as control. Cellular immune responses to polio antigens PBMC were isolated from fresh heparinized blood samples from vaccinated infants and adults by density gradient centrifugation. Cells were resuspended in cell culture medium containing 10% heat-inactivated pooled human AB sérum (Sigma Chemicals, St Louis, MO). 200.000 cells per well were incubated in quadruplicates in the presence of PHA, PVl, PV2 and PV3 antigens (concentration of 1: 8, vol: vol), PHAL (5 pg/ml. Sigma Chemicals) or medium alone in U-bottomed 96-well plates at 37°C, 5% C02. Supematants were collected on day 2 from PHA-stimulated wells and on day 6 from unstimulated and polio-stimulated wells. On day 6, 1 pCi [Methyl-^H] tritiated Thymidine per well was added to the cell cultures for an additional 17 hours to assess cell prolifération. Thymidine incorporation was measured by liquid scintillation using a Betaplate reader (LKB1205, Turku, Finland). Commercially available ELISA kits were used to détermine cytokine concentrations in supematants (IFN-y and IL-5: Biosource Europe, Fleums, Belgium; IL-13: Diaclone, Besançon, France). IFN-y, IL-5 and IL-13 détection limits were 8 pg/ml. Frequencies of IFN-y producing lymphocytes The frequency of IFN-y-producing lymphocytes was determined by ELISPOT using commercially available reagents according to the recommendations of the manufacturer (Mabtech, Stockholm, Sweden). 2x10^ PBMC / well were incubated in 96 well ELISPOT plates (MAIPS45, Millipore, Bedford, MA) in quadriplicates in the presence of PVl, PV2, PV3 antigens or PHA for 16 h. The numbers of spot forming cells were counted using an automated Elispot reader (AID Autoimmun Diagnostic GmbH, Strassberg, Germany). Anti-polio virus neutralizing antibody concentrations Sérum neutralizing antibodies to poliovirus types 1,2, and 3 were measured according to the methodology recommended by the World Health Organization [11]. Briefly, sera were heat-inactivated and serial 2-fold dilutions prepared in a microtitre-format plate. Standard volumes of poliovirus types at 100 TCID50 were added to the diluted sera, and the plate incubated at 37°C for 3 hours in 5% CO2. Next, 1-2x10"* HEp-2 cells / well were added. The HEp-2 cell line is particularly sensitive to polioviruses. The plate was fiirther incubated for 6 days at 37°C in 5% CO2 and the monolayers were assessed for viral cytopathic effect. The sérum antibody titer was reported as the highest dilution of sérum that protected 50% of the cultures against virus challenge, expressed as the reciprocal of the titer, and converted into international units. Statistics Comparisons of sérum neutralizing antibody levels were done on log-transformed data using the Mest on paired (comparison of cord blood and infant sera) and unpaired data (comparison of adult and infant sera). Prolifération results were calculated as stimulation indexes (SI, counts in wells stimulated with polio-infected HEp-2 supematant / counts in wells stimulated with uninfected HEp-2 supematants), logtransformed, and compared using the /-test. A positive proliférative response was defmed as a SI of more than 3. Cytokine concentrations and IFN-y producing lymphocyte frequencies were compared using the Mann-Whitney-Wilcoxon test. A positive cytokine response was defmed as a concentration in antigen-stimulated wells above twice the concentration measured in wells containing the control supematant from non-infected cell Unes. Figure 1. Anti-PVl, 2 and 3 neutralizing antibody concentrations (International Units / ml) in sérum from cord blood (open bars), vaccinated infants (hatched bars) and immune adults (crossed bars). Géométrie means and 95 % CI are presented. *: P < 0.05 **: p < 0.005 ***: p < 0.0005 Neutralising antibodies (GM, 95% Cl) I I V//////A Cord sérum Infant sérum Adult sérum RESULTS AND DISCUSSION As shown in figure 1, low concentrations of maternai anti-PVl, PV2 and PV3 antibodies were detected in cord sérum. The administration of four doses of OPV at birth, 1, 2 and 3 months of âge induced the production of large concentrations of antiPVl, PV2 and PV3 neutralizing antibodies. The antibody concentrations measured in infants were higher than that measured in immune adults following a booster OPV immunization. Adults enrolled in this study had been vaccinated with OPV in infancy and had probably been exposed to the virus shed from vaccinated infants in their environment. The différence in antibody concentrations in adults and infants indicates that the administration of multiple doses of OPV in naïve infants induces a higher antibody response than the administration of a single dose of OPV in previously immune individuals. In keeping with previously reported data [12], incubation of PBMC in the presence of PVl, 2 and 3 antigens induced a proliférative response in 36, 5 and 30 of the 36 adults studied, respectively (Figure 2, upper panel). In contrast, proliférative responses to PV 1, 2 and 3 were detected in only 5, 0 and 3 of the 27 infants studied, respectively. Médian proliférative responses to the 3 viral préparations were significantly lower in infants than in adults whereas background prolifération values were similar in both groups (data not shown). In adults, the strong proliférative responses were associated with a détectable IFN-y production to PVl, PV2 and PV3 antigens in 14, 15 and 11 of 36 adults, respectively (Figure 2, middle panel). In contrast, only 1, 0 and 1 of the 27 infants produced détectable concentrations of IFN-y in response to PV 1, 2 and 3 antigens, respectively. Médian IFN-y responses to the 3 polio antigen préparations were significantly lower in infants than in adults. Infants also produced lower concentrations of IFN-y in response to PHA. No IL-5 or IL-13 could be detected in the supematants of polio antigen stimulated cells, neither in infants nor in adults. The number of IFN-y producing lymphocytes in response to polio antigens was studied in 6 adults and 6 infants using the ELISPOT technique (Figure 2, lower panel). Infants showed significantly lower frequencies of IFN-y producing lymphocytes following stimulation with PVl and PV2 antigens as compared to adults. Figure 2. Cellular responses to PVl, 2 and 3 antigens in vaccinated infants (filled circles) and immune adults (open triangles). Individual values are shown. Upper panel: proliférative responses. Stimulation indexes (counts in wells stimulated with polio antigen-containing supematant / counts in wells stimulated with control supematant) are presented. Middle panel: IFN-y concentrations (pg/ml) in supematants from antigen-stimulated cell cultures. Lower panel: Number of IFT'J-y producing cells / 200x10^ PBMC. *: p < 0.05; **: p < 0.005; ***: p < 0.0005 Cell prolifération 100-| ‘■1“ 10 W A 3 iisâi Üi ••• Jt. * PVl PV2' PV3' IFN-y production 10» lO» E 2 2 U. : ^ 4^ 10» Ut 10» 4 A 10' V V* A SB eeceù PV1*‘* ^ A mm âccea PV2*** fti SB • PV3** ELISPOT analysis O PHA* Taken together, our results indicate that, despite a potent antibody response, infants hâve a defective IFN-y response to OPV as compared to immune adults but no détectable bias towards a Th2 type response. The IFN-y dominant response to OPV observed in adults is in keeping with results obtained in mice transgenic for the human poliovirus receptor [13]. In this experimental System, OPV induced a Thl response that provided help to B lymphocytes and protected animais against a léthal poliovirus infection. Juhela et al. reported that 9-months old infants vaccinated with OPV in infancy express IFN-y mRNA upon in vitro restimulation with PVl antigens but these responses were not compared to an older population [14]. In this study, OPV was used as a model to study T cell responses in early life. As protection against poliomyelitis is dépendent on the induction of an antibody response, our observations do not challenge the recommendations of WHO to immunize newboms in developing countries [10]. The reduced IFN-y response to OPV in infants contrasts with the adult-like IFN-y response induced at birth by BCG [9]. We hypothesize that the differential ability of OPV and BCG to promote IFN-y production in young infants is related to a different capacity of the vaccines to activate antigen-presenting cells. Indeed, BCG activâtes adult dendritic cells, increasing their production of lL-12 and their expression of costimulatory molécules [15]. BCG is likely to be a more potent activator of dendritic cells than OPV and could overcome the inhérent defect of néonatal dendritic cells in the expression of IL-12 and co-stimulatory molécules [6]. Alteraatively, the route of immunization could be involved. While the immune response following intradermal BCG immunization takes place in the régional lymph node, the spleen could play a more important rôle in the response to OPV. Adkins et al. reported that Th2 type responses are preferentially induced in the spleen of newbom mice [4]. As we measured cytokine responses in peripheral blood, we cannot rule out the possibility that OPV vaccinated infants had increased Th2 cytokine production at the spleen level. In conclusion, our study shows that young infants hâve defective IFN-y response to OPV. Defective IFN-y production could play an important rôle in the susceptibility of young infants to intracellular pathogens. Spécifie strategies may hâve to be developed to protect young infants against pathogens controlled by Thl responses. ACKNOWLEDGEMENTS We would like to thank ail mothers for allowing their child to join the study, and ail adult volunteers to participate. We acknowledge the excellent fieldwork of Mr. Bunja Kebbe and Mr. Kebba Bajo, the assistance of Mariamma Sanneh in the laboratory and the help of the staff ffom the Serrekunda Health Center. REFERENCES 1. Siegrist CA. Néonatal Vaccinology. Vaccine 2001; 19: 3331-46. 2. Forsthuber T, Yip HHC, Lehmann PV. Induction of Thl and Th2 immunity in early life. Science 1996; 271:1728-30. 3. Barrios C, Brawand P, Bemey M, et al. Néonatal and early life immune response to varions forms of vaccine antigens differ from adult immune responses: prédominance of a Th2-biased pattern which persists after adult boosting. Eur J Immunol 1996; 26:1489-96. 4. Adkins B, Bu Y, Guevara P. The génération of Th memory in neonates versus adults: prolonged primary Th2 effector function and impaired development of Thl memory effector function in murine neonates. J Immunol 2001; 166:918-25. 5. Adkins B. T-cell function in newbom mice and humans. Imm Today 1999; 20: 330-5. 6. Goriely S, Vincart B, Stordeur P et al. Déficient IL-12(p35) gene expression by dendritic cells derived ffom néonatal monocytes. J Immunol 2001; 166:2141-6. 7. Prescott SL, Macaubas C, Holt BJ, et al. Transplacental priming of the human immune System to environmental allergens: universal skewing if initial T cell responses towards the Th2 cytokine profile. J Immunol 1998; 160:4730-37. 8. Marchant A, Goetghebuer T, Ota M, et al. Newboms develop a Thl-type immune response to Mycobacterium bovis bacillus Calmette-Guérin vaccination. J Immunol 1999; 163:2249-55. 9. Vekemans J, Amedei A, Ota MO, et al. Néonatal bacillus Calmette-Guérin vaccination induces adult-like IFN-y production by 004"^ T lymphocytes. Eur J Immunol 2001;31:1531-35. 10. Sutter RW, Cochi SL, Melnick JL. Live attenuated poliovirus vaccines. In: Plotkin SA, Orenstein WA, eds. Vaccines. 3rd ed. Philadelphia: WB Saunders, 1999; 16:364-408. 11. Manual for the virological investigation of polio. World Health Organization, Geneva, 1997. 12. Graham S, Wang ECY, Jenkins O, Borysiewicz LK. Analysis of the human T-cell response to picomaviruses: identification of T-cell epitopes close to B-cell epitopes in poliovirus. J Virol 1993; 67:1627-37. 13. Mahon BP, Katrak K, Nomoto A, Macadam AJ, Minor PD, Mills KH. Poliovirusspecific CD4+ Thl clones with both cytotoxic and helper activity médiate protective humoral immunity against a léthal poliovirus infection in transgenic mice expressing the human poliovirus receptor. J Exp Med 1995; 181:1285-92. 14. Juhela S, Hyôty H, Uibo R, et al. Comparison of enterovirus-specific cellular immunity in two populations of young children vaccinated with inactivated or live poliovirus vaccines. Clin and Exp Imm 1999; 117:100-5. 15. Inaba K, Inaba M, Naito M, Steinman RM. Dendritic cell progenitors phagocytose particulates, including bacillus Calmette-Guérin organisms, and sensitize mice to mycobacterial antigens in vivo. J. Exp. Med. 1993; 178:479-88. 3. Réponse immune du nourrisson au vaccin contre l’hépatite B Résumé • Objectif Comparer la réponse immime cellulaire au vaccin contre l’hépatite B chez des notirrissons et des adultes. • Résultats La réponse immune cellulaire et humorale au vaccin contre l’hépatite B a été étudiée à l’âge de quatre mois et demi chez 24 nourrissons vaccinés à 0, 2 et 4 mois de vie, et chez 24 adultes préalablement non vaccinés et non porteurs d’anticorps anti-HBc deux semaines après la dernière de trois doses administrées à deux mois d’intervalle. Chez les nourrissons, on trouve une production d’IFN-y en réponse à la stimulation de PBMC par l’antigène vaccinal HBs plus faible que chez l’adulte. La vaccination contre l’hépatite B induit la production de taux significatifs et comparables de cytokines Th2 (IL-5, IL-13) chez le nourrisson et chez l’adulte. Les concentrations sériques d’anticorps anti-HBs retrouvés chez le nourrisson dépassent ceux chez l’adulte. • Conclusions Cette étude confirme l’existance d’un déficit de production d’IFN-y associé à l’administration de certains vaccins en début de vie, chez l’homme. On n’observe néanmoins pas de biais Th2 associé à la vaccination précoce contre l’hépatite B. Comme en réponse au vaccin contre la poliomyélite, les nourrissons sont capables de produire une réponse humorale vigoureuse après vaccination contre l’hépatite B. 48 Unpublished study T cell immune response to vaccines in infants: Reduced IFN-y production following Hepatitis B immunization Medical Research Council Laboratories, Fajara, The Gambia Immunologie Expérimentale, Université Libre de Bruxelles, Belgium WHO Centre of Vaccinology and Néonatal Immunology, Switzerland ABSTRACT Little is known about the capacity of newboms and infants to generate T cell responses in vivo. Experiments in mice indicate that néonatal vaccination is associated with reduced Thl immune responses and a preferential development of Th2 type responses. Impairment in Thl immune responses in humans would reduce the efficacy of vaccines against intracellular pathogens affecting young infants. In this study, we show that néonatal immunization with hepatitis B vaccine induces the production of high titers of antibodies but reduced IFN-y responses to HBs antigen as compared to immune adults. These data suggest that spécifie strategies will be required to immunize newboms against pathogens controlled by Thl type immune responses. INTRODUCTION The néonatal hepatitis B vaccine (HBV) is the first vaccine shown to be effective in preventing vertical transmission of infection ffom mother to offspring, thereby interrupting trans-generational transmission of infection Mass néonatal and infant hepatitis B immunization has also been shown to successfully prevent hepatitis B infection, the development of liver cirrhosis and hepatocarcinoma in highly exposed populations ’ . Furthermore, early vaccination policy favours achievement of high vaccination coverage These characteristics illustrate the potential benefits of early immunization strategies. It is estimated that 4 million infants still die annually ffom infections worldwide The immaturity of the immune System of newboms and infants is associated with an increased susceptibility to intracellular pathogens in early life Hepatitis B infection is no exception, and an inverse relationship between âge at infection and likelihood of chronic viral réplication has been demonstrated As in the case of hepatitis B, néonatal vaccination could prevent infections with other early pathogens such as the Respiratory Syncitial Virus, the Human Immunodeficiency Virus, Plasmodium falciparum and the measles virus . Protective immunity against intracellular pathogens mainly relies on Thl IFN-y producing cellular immune responses Little is known about the capacity of newbom and infants to generate T cell responses in vivo. Experiments in mice indicate that néonatal immune responses to vaccines are defective in T helper 1 (Thl) IFN-y producing immune responses and preferentially develop Th2 type responses, characterized by IL-4, IL-5 and IL-13 production Impairment in Thl and a bias towards Th2 responses would reduce the efficacy of vaccines against intracellular pathogens affecting young infants. Further characterization of in vivo antigen-specific cellular immune fimction in human infants is needed for the rationale development of early life vaccination strategies. In this study, we hâve analyzed the cellular and humoral immune response to hepatitis vaccination in 4.5 months old infants vaccinated at birth, 2 and 4 months, and compared it to previously unvaccinated and unexposed adults, séronégative for anti-hepatitis B core (antiHBc) antibodies, two weeks afiter the last of three doses given at 2 months of interval. MATERIAL AND METHODS Study design and population This study was a prospective trial approved by the Gambia Govemment/Medical Research Council (MRC) Ethics Committee. Informed consent was obtained from adults and mothers of infants included in this study. The Medical Research Council guidelines for good research practices were followed in its conduct. Healthy newboms were enrolled at birth at Royal Victoria Hospital, Banjul, The Gambia. Babies included in this analysis were part of a cohort study of the effect of BCG vaccination on the immune response to other vaccine antigens. In order to avoid any confounding effect of BCG on the immune response to hepatitis B vaccine in infants, infants not vaccinated with BCG were selected for comparison with adult responses. Vaccines given to infants recruited in the study thus included HBV at birth, 2 and 4 months, oral polio vaccine (OPV) at birth, 1, 2 and 3 months, diphtheria / whole cell pertussis / tetanus vaccine (DPT) at 2, 3 and 4 months. BCG was given at 5 months of âge, after the study period. HBV (0.5 ml, Engerix B, Glaxo SmithKline, Rixensart, Belgium) was given intramuscularly in the left arm. Blood samples were collected at 4.5 months of âge. Adults (mean âge: 23, range: 15-26) séronégative for anti-hepatitis B core antibodies that had not previously been immunized with the hepatitis B vaccine were identified during a study of epidemiological surveillance of sexually transmitted diseases in a rural community in Sibanor, The Gambia. Individuals that accepted to join the study received three doses of hepatitis B vaccine (1 ml, Engerix B) two months apart, intramuscularly in the left arm. A blood sample was collected 2 weeks after the third vaccine dose. Antibody assays Pre-enrolment screening of anti-HBc antibodies in adult sera was done using a commercially available radioimmunoassay (Ab-Corek RIA, Sorin Biomedica, Saluggia Italy) according to the manufacturer’s instructions. Anti-hepatitis B surface antigen (HbsAg) antibody concentrations were determined by ELISA on plates coated with HBsAg antigen (GlaxoSmithKline). Incubation of sérum samples was followed by successive addition of biotinylated goat anti human IgG (Sigma) and peroxidase-coupled goat anti human IgG (Cappell-ICN, Costa Mesa, CA, for HBsAg antibodies) and ABTS substrate. Antibody concentrations were calculated with the Sofimax*^ PRO software (Molecular Devices) by comparison with standard curves (4-parameter fitting) using international standards of reference. Values below the assay cut-off (150 mlU/ml) were arbitrarily given a value of half the cut-off for détermination of mean géométrie titers. Cell-mediated immunity Peripheral blood mononuclear cells (PBMC) were isolated by density gradient centrifugation and resuspended in complété RPMI medium supplemented with 10% human AB sérum (Sigma, St. Louis, MO). PBMC (IOV2OO pl) were incubated with hepatitis B surface antigen (HBsAg, 2 pg/ml, Glaxo SmithKline) or PHA (PHA-L, 10 pg/ml. Sigma Chemicals, UK) or medium alone. [Methyl-^H] Thymidine (1 pCi/well, Amersham Life Science, UK) was added for the final 17 h of culture to assess cell prolifération. Thymidine incorporation was measured by liquid scintillation using a Betaplate reader (LKB1205, Turku, Finland). Cytokine concentrations were measured in supematants collected on day 2 (PHA) or day 6 (medium and antigens) using commercially available reagents (IFN-y and IL-5: BioSource Europe, Fleurus, Belgium; IL-13: Diaclone, Besancon, France). Statistical analysis Background production of cytokines measured in control wells was subtracted ffom that measured in antigen-stimulated wells. Cell prolifération responses were expressed as stimulation indexes (SI) (counts per minute in stimulated wells / counts per minute in control wells). Adults and infant cytokine and prolifération responses were compared using the nonparametric Wilcoxon test. Infant and adult sérum anti-HBs antibody concentrations were logtransformed, and compared using the standard student test. Ail statistical analysis was donc using Stata software (version 6; Stata Corporation, College Station, TX). Table. Cellular immune response to hepatitis B vaccine in vaccinated infants and adults. Cytokine production (pg/ml) and cell prolifération (SI) were determined in 24 infants and 24 adults vaccinated with three doses of anti-hepatitis B vaccine and compared using a nonparametric Wilcoxon test. Médians (interquartile ranges) are shown. HBs Antigen Adults Infants P 232 (26-816) 25 (10-177) 0.047 IL-5 15(1-34) 18(1-39) 0.31 IL-13 52(11-134) 23 (5-85) 0.17 6(2-11) 5(3-12) 0.39 3214(2459-3750) 1715 (1093-2109) 0.03 IL-5 118 (84-306) 59 (10-174) 0.02 IL-13 3080(1861-4518) 1357 (866-1794) 0.2 17(7-42) 3 (1-9) 0.02 IFN-y Prolifération PHA IFN-y Prolifération RESULTS AND DISCUSSION Post-vaccination blood samples were obtained from 24 adults and 24 infants vaccinated with three doses of anti-hepatitis B vaccine. Antibody levels (géométrie mean, 95 % confidence interval) found in vaccinated infants (6816, 4951-9384 mlU/ml) \vere higher than those found in adults (3081, 2183-4348 mlU/ml, p=0.001). These data contrast with the generally accepted idea that early life antibody responses are of lower magnitude than in later life, but supports previous studies showing that the hepatitis B vaccine is highly immunogenic in infants A différence in antibody isotypes production, in antibody affmity for the antigen and in the persistence of the antibody levels between hepatitis B-vaccinated infants and adults should be investigated. As shown in the table, a reduced IFN-y production by PBMC stimulated with HBs antigen was found in vaccinated infants, as compared to adults. Similar concentrations of IL-5 and IL13 in response to the HBs antigen were found in babies and adults. No différences in proliférative responses to HBs were found between adults and infants. In response to PHA, infants produced lower concentrations of IFN-y and IL-5, and reduced proliférative responses as compared to adults, confirming previous studies showing depressed IFN-y, IL-5 and IL-4 lymphocyte in response to mitogenic stimulation in infancy, probably reflecting a lower proportion of antigen-experienced cells among circulating lymphocytes . Production of IL- 13 in response to PHA in infants as compared to adults was also low, although this différence was not statistically significant. These data are in keeping with previous results obtained in a study of the immune response to oral polio vaccination in infants, where we found a decreased IFN-y response to antigens from the three attenuated poliovirus vaccine serotypes, as compared to immune adults (Vekemans et al, unpublished study). In contrast, we previously reported that the immune response to M. bovis bacillus Calmette-Guérin (BCG) vaccination in newboms is characterized by a potent IFN-y response similar to that of immune adults These studies support fmdings in mice showing defective IFN-y producing immune responses to subunit vaccines during early life. In contrast with the mice, we found no evidence of a Th2 bias in human infants in response to hepatitis B, polio and BCG vaccines. Impaired Thl immunity in infancy may be related to the described immaturity of néonatal antigenpresenting cell function. A defective production of the p35 subunit of IL-12 and reduced expression of co-stimulatory molécules by néonatal dendritic cells bas indeed been reported recently The antigen-presenting cell activating properties of BCG, described in adults, may explain adult-like IFN-y responses to BCG and not to polio and hepatitis B vaccines in infants Adult-like Thl type responses can indeed be induced in newbom mice in optimal conditions of antigen présentation with strong adjuvants, IL-12, CpG-containing oligonucleotides, DNA vaccines, replicating viruses or mature dendritic cells In humans too, spécifie strategies are needed to immunize newboms against pathogens controlled by Thl type immune responses. REFERENCES 1. Beasley, R. P., L. Y. Hwang, G. C. Lee, C. C. Lan, C. H. Roan, F. Y. Huang, and C. L. Chen. 1983. Prévention of perinatally transmitted hepatitis B virus infections with hepatitis B virus infections with hepatitis B immune globulin and hepatitis B vaccine. Lancet 2:1099-1102. 2. Chang, M. H., C. J. Chen, M. S. Lai, H. M. Hsu, T. C. Wu, M. S. Kong, D. C. Liang, W. Y. Shau, and D. S. Chen. 1997. Universal hepatitis B vaccination in Taiwan and the incidence of hepatocellular carcinoma in children. Taiwan Childhood Hepatoma Study Group. N.Engl.J.Med. 336:1855-1859. 3. Chen, H. L., M. H. Chang, Y. H. Ni, H. Y. Hsu, P. 1. Lee, C. Y. Lee, and D. S. Chen. 1996. Seroepidemiology of hepatitis B virus infection in children: Ten years of mass vaccination in Taiwan. JAMA 276:906-908. 4. Yusuf, H. R., D. Daniels, P. Smith, V. Coronado, and L. Rodewald. 2000. Association between administration of hepatitis B vaccine at birth and completion of the hepatitis B and 4:3:1:3 vaccine sériés. JAMA 284:978-983. 5. Siegrist, C. 2001. Néonatal and early life vaccinology. Vaccine 19:3331-3346. 6. Wilson, C. B. 1986. Immunologie basis for increased susceptibility of the neonate to infection. J.Pediatr. 108:1-12. 7. Edmunds, W. J., G. F. Medley, D. J. Nokes, A. J. Hall, and H. C. Whittle. 1993. The influence of âge on the development of the hepatitis B carrier State. Proc.R.Soc.Lond B Biol.Sci. 253:197-201. 8. Vekemans, J., M. O. Ota, T. Goetghebuer, M. J. Newport, and A. Marchant. 2000. "Immunization of newboms in the tropics." The Gambia, 25-27 November 1999. Vaccine 19:387-392. 9. Guidotti, L. G. and F. V. Chisari. 2001. Noncytolytic control of viral infections by the innate and adaptive immune response. Annu.RevJmmunol. 19:65-91.:65-91. 10. Barrios, C., P. Brawand, M. Bemey, C. Brandt, P. H. Lambert, and C. A. Siegrist. 1996. Néonatal and early life immune responses to various forms of vaccine antigens qualitatively differ from adult responses: prédominance of a Th2-biased pattern which persists after adult boosting. EurJ.Immunol. 26:1489-1496. 11. Adkins, B., Y. Bu, and P. Guevara. 2001. The génération ofTh memory in neonates versus adults: prolonged primary Th2 effector function and impaired development of Thl memory effector fimetion in murine neonates. y./wwwno/. 166:918-925. 12. Adkins, B. 1999. T-cell function in newbom mice and humans. Immunol.Today 20:330-335. 13. Marchant, A., T. Goetghebuer, M. O. Ota, I. Wolfe, S. J. Ceesay, D. De Groote, T. Corrah, S. Bennett, J. Wheeler, K. Huygen, P. Aaby, K. P. McAdam, and M. J. Newport. 1999. Newboms develop a Thl-type immune response to Mycobacterium bovis bacillus Calmette-Guerin vaccination. J.Immunol. 163:22492255. 14. Vekemans, J., A. Amadei, M. O. Ota, M. M. D'Elios, T. Goetghebuer, J. Ismaili, M. J. Newport, G. Del Prete, M. Goldman, K. P. McAdam, and A. Marchant. 2001. Néonatal bacillus Calmette-Guérin vaccination induces adult-like IFN-g production by CD4-I- T lymphocytes. EurJ.Immunol. 31:00. 15. Goriely, S., B. Vincart, P. Stordeur, J. Vekemans, F. Willems, M. Goldman, and D. De Wit. 2001. Déficient 1L-I2(p35) gene expression by dendritic cells derived from néonatal monocytes. J.Immunol. 166:2141-2146. 16. Henderson, R. A., S. C. Watkins, and J. L. Flynn. 1997. Activation of human dendritic cells following infection with Mycobacterium tuberculosis. J.Immunol. 159:635-643. 4. La vaccination par le bacille Calmette-Guérin promeut la réponse immune à d’autres vaccins du nourrisson Résumé • Objectifs 1 & Déterminer l’influence de la vaccination par le BCG sur le développement de la réponse immune humorale et cellulaire aux autres vaccins du nourrisson. • Méthodes Trois groupes de nourrissons ont été suivis prospectivement: un groupe était vacciné par le BCG à la naissance, un groupe à l’âge de deux mois et un troisième groupe à l’âge de quatre mois et demi. Tous les nourrissons ont reçu les autres vaccins au même âge, selon les recommandations du programme national de vaccination. Un échantillon de sang a été collecté à la naissance, à l’âge de deux et de quatre mois et demi. Les réponses humorales aux vaccins anti-hépatite B, diphtérie, tétanos et poliomyélite, et les réponses cellulaires vis-à-vis de l’antigène de surface de l’hépatite B et de la toxine tétanique chez des nourrissons non vaccinés par le BCG ont été comparées à celles observées chez des nourrissons vaccinés par le BCG à la naissance ou à Tâge de deux mois. • Résultats L’administration du vaccin BCG à la naissance promeut la réponse humorale et cellulaire au vaccin contre l’hépatite B. Un effet limité sur la réponse aux vaccins anti-tétanos et anti-diphtérie est observé. Bien que le BCG induise une réponse de type Thl vis-à-vis des antigènes mycobactériens, il promeut la production de cytokines Th2 et de cytokines Thl en réponse aux autres vaccins. Un effet systémique est retrouvé puisque l’administration du BCG à l’âge de deux mois promeut la réponse humorale anti-polio. 49 • Conclusions Le BCG peut être utilisé comme vecteur ou comme adjuvant pour moduler en début de vie les réponses immunes à des antigènes non mycobactériens. L’effet du vaccin BCG porte sur les réponses cellulaires et humorales, promeut les réponses Thl et Th2, et peut s’observer au niveau systémique. 50 Manuscript submitted for publication Néonatal immunization with Mycobacterium bovis bacillus CalmetteGuérin promotes immune responses to unrelated vaccine antigens Martin O.C. Ota , Johan Vekemans , Susanna E. Schlegel-Haueter , Katherine Fielding Mariama Sanneh', Michael Kidd', Melanie J. Newport Hilton Whittle', Paul-Henri Lambert Keith P.W.J. McAdam Peter Aaby Claire-Anne Siegrist Arnaud Marchant' ' Medical Research Council Laboratories, The Gambia ^ WHO Centre of Vaccinology and Néonatal Immunology, Switzerland ^ London School of Hygiene and Tropical Medicine Wellcome Trust Centre for Molecular Mechanisms in Disease, University of Cambridge, United Kingdom ^ Bandim Health Project, Guinea-Bissau Abstract The immaturity of the immune System increases the susceptibility of young infants to infections diseases and prevents the induction of protective immune responses by vaccines. BCG vaccination induces a potent Thl response to mycobacterial antigens in newboms. In this study we evaluated the influence of BCG on the response to unrelated vaccines given in early life. Administration of BCG at the time of priming markedly increased the cellular and antibody responses to the hepatitis B vaccine given at birth but had only a limited influence on the response to tetanus and diphtheria toxoids given at 2 months of âge. BCG promoted both Thl and Th2 type responses to unrelated vaccines. The effect of BCG was apparent at the systemic level as it increased the antibody response to oral polio vaccine. These results demonstrate that BCG influences the immune response to unrelated antigens in early life, likely through its influence on the maturation of dendritic cells. Introduction Infectious diseases are the main cause of mortality in young children, causing the death of about 4 million infants yearly This increased susceptibility to infections is related to an immaturity of the immune System that also prevents the induction of protective immune responses by vaccines Studies in mice indicate that immune responses at birth are often biased towards the T helper 2 (Th2) type and defective in the Thl type, the central defense mechanism against intracellular pathogens Relatively little is known about helper T cell responses in human newboms. Recent data showing that human cord blood-derived dendritic cells hâve a profound defect in the production of interleukin-12 (IL-12), a cytokine playing a central rôle in the différentiation of Thl lymphocytes, suggest that type 1 responses could also be defective in human newboms In contrast, we observed that M. Bovis Bacillus Calmette-Guérin (BCG) vaccination induces a potent Thl type immune response at birth in humans as in mice This could be related to the potent APC activating properties of BCG and/or to its persistence during the maturation of the immune System By inducing a potent Thl type response at birth, BCG could influence the immune response to unrelated antigens. We hâve observed that BCG immunization during the first week of life is associated with a reduced risk of atopy in children in Guinea-Bissau BCG is the world’s most widely used vaccine and although its efficacy against adult disease is variable it protects against childhood tuberculosis An influence of BCG on immune responses to unrelated antigens would therefore hâve important public health implications. The objective of this study was to evaluate whether the Thl type immune response induced by BCG could influence the T cell and the antibody responses to unrelated vaccine antigens. Children were recruited at birth and randomly allocated to one of three study groups, receiving BCG at birth, 2 months or 4.5 months of âge. This design allowed us to analyze the effect of BCG when given (1) at the time of priming with hepatitis B (HBV) and oral polio (OPV) vaccines at birth or with diphtheria and tetanus toxoids (DPT) at two months of âge or (2) at the time of booster immunization with HBV and OPV at two months of âge. Immune responses to vaccines were measured at 4.5 months of âge and were therefore not influenced by BCG in infants who received BCG at 4.5 months. Table 1. Influence of BCG on antibody responses to HBV and OPV Age at sampling HBV^ Study group birth 2 months 4.5 months BCG at birth 75(75,235) 511 (255, 1015) 14158 (8727, 22968) - 0.03 0.004 75 (75, 267) 202(167,332) 6867 (4842, 9738) - - 0.8 BCG at 4.5 months 75(75,278) 344(168, 529) 6816(4951,9384) BCG at birth 2.2 (1.4, 3.5) 7.9 (4.5, 13.8) 14.3 (7.3, 28.0) - 0.37 0.38 2.1 (1.4, 3.2) 5.5 (2.8, 10.8) 40.8 (29.0, 57.4) - - 0.002 2.7 (1.8,4.4) 6.2 (3.4, 11.5) 9.4(4.0,21.0) P* BCG at 2 months P** OPV^ P* BCG at 2 months P** BCG at 4.5 months Anti-HBs and OPV-1 antibody concentrations were measured in infants vaccinated with BCG at birth (n samples at birth=45, at 2 months=34 and at 4.5 months=27), at 2 months {n samples at birth=44, at 2 months=34 and at 4.5 months=29), or at 5 months of âge {n samples at birth=44, at 2 months=34 and at 4.5 months=28). ^HBs antibody results are expressed as médian mlU/ml (95% CI) and OPV antibody results are expressed as géométrie mean lU/ml (95% CI) * Infants vaccinated at birth with BCG vs infants vaccinated at 4.5 months (Controls) except for 2 months sampling data where infants vaccinated at birth were compared to infants vaccinated at 2 or 4.5 months. ** Infants vaccinated at 2 months with BCG vs infants vaccinated at 4.5 months. Results BCG induces a Th 1 type immune response at birth and at 2 months of âge We first confirmed that BCG induced a Thl type immune response in our study population Infants vaccinated at birth with BCG produced high concentrations of IFN-y and showed strong proliférative responses to PPD at 2 and 4.5 months of âge (Fig. 1). In contrast, only low production of type 2 cytokines, IL-5 and IL-13, was detected. Similar responses were observed at 4.5 months in infants who had been vaccinated at 2 months of âge. Influence of BCG administration at the time ofpriming with unrelated antigens In control infants who had not received BCG, HBV immunization at birth, 2 and 4 months of âge induced a ThO type response characterized by the production of IFN-y, IL-5 and IL-13 (Fig. 2). Administration of BCG at the time of priming markedly increased the lymphocyte response to HBV. Cytokine and proliférative responses to HBs Ag were significantly higher in infants vaccinated at birth than in infants who had not received BCG. The production of both type 1, IFN-y, and type 2 cytokines, IL-5 and IL-13 were enhanced by BCG. This effect was already apparent at two months of âge, after a single dose of HBV, and was further enhanced at 4.5 months of âge. The specificity of these différences for vaccine antigens was confirmed by the lack of influence of BCG on responses to PHA in both groups (Fig. 3). As shown in Table 1, the increased lymphocyte response was associated with an increased antibody response. Infants vaccinated at birth with BCG had significantly higher antiHBs IgG than infants who had not received BCG. This effect was apparent at 2 months of âge and was maximal after immunisation with 3 doses of HBV. OPV vaccination at birth, 1,2 and 3 months of âge stimulated the production of high concentrations of anti-PVl neutralising antibodies (Table 1). Administration of BCG at the time of OPV priming did not significantly increase the antibody concentration to PVl as measured at 2 and 4.5 months. The influence of BCG administration at the time of priming with unrelated vaccines was also assessed in children receiving BCG at 2 months of âge, with their first dose Table 2. Influence of BCG on antibody responses to TT and DT Age at sampling Y'j'li Study group 2 months 4.5 months BCG at birth 581 (327, 1131) 2290(1543,3393) 0.25 0.61 836(509, 1303) 2730(1916,3889) - 0.55 813 (476, 1523) 2669(1722,4137) 50 (50, 50) 1092(614, 1942) 0.97 0.85 50 (50, 50) 1434 (822, 2501) - 0.50 50 (50, 50) 1075 (564,2051) P* BCG at 2 months P** BCG at 4.5 months DT^ BCG at birth P* BCG at 2 months P** BCG at 4.5 months Anti-TT and DT antibody concentrations were measured in infants vaccinated with BCG at birth (n samples at 2 months=35 and at 4.5 months=28), at 2 months (n samples at 2 months=35 and at 4.5 months=29), or at 5 months of âge (« samples at 2 months=35 and at 4.5 months=28). ^TT and DT antibody concentrations are expressed as médian mlU/ml (95% CI). * Infants vaccinated at birth with BCG vs infants vaccinated at 4.5 months (Controls) except for 2 months sampling data where infants vaccinated at birth were compared to infants vaccinated at 2 or 4.5 months. ** Infants vaccinated at 2 months with BCG vs infants vaccinated at 4.5 months (Controls). of DPT. DPT immunization at 2, 3 and 4 months of âge induced a ThO type response to TT (Fig. 4). BCG vaccination increased the lymphocyte response to TT. Infants vaccinated with BCG at 2 months of âge showed higher proliférative and cytokine responses to TT than infants who had not received BCG but these différences were only significant for IL-5 and IL-13. The specificity of these différences was also confirmed by the similar responses to PHA observed in the two groups (Fig. 3). Relatively high concentrations of anti-TT IgG were detected at two months of âge (Table 2), as a resuit of the maternai immunization practice in The Gambia BCG administration with DPT priming did not influence the antibody response to TT as measured at 4.5 months. The antibody response to DT was also similar in infants who received BCG at two months and in those who had not received BCG. Influence ofBCG administration prior to priming with unrelated antigens Infants vaccinated at birth with BCG, 2 months before the first dose of DTP, showed significantly higher IL-13 responses to TT than infants who had not received BCG (Fig. 4). These IL-13 responses to TT were similar to that measured in infants who received BCG at 2 months of âge. In contrast, no significant effect of BCG vaccination at birth was observed on proliférative, IFN-y or IL-5 responses to TT. As observed when BCG was given at the time of priming, BCG vaccination at birth did not influence antibody response to TT or DT (Table 2). Influence of BCG administration at time of booster immunization with unrelated antigens Infants vaccinated with BCG at 2 months of âge, at the same time as the second dose of HBV, produced significantly higher concentrations of IL-5 and IL-13 in response to HBs Ag than infants who had not received BCG (Fig 2). These responses were similar to that measured in infants who received BCG at the time of priming. In contrast, BCG vaccination at 2 months did not significantly influence proliférative or IFN-y responses to HBV. As shown in Table 1, BCG vaccination at 2 months of âge did not influence the antibody response to HBV. In contrast, a marked enhancement of the antibody response to OPV was observed (Table 1). Infants vaccinated with BCG at 2 months of âge, at the same time as the third dose of OPV, reached higher I ) BCG at 4.5 months 2ZZZ1 BCG at 2 months twvi BCG at birth Age at sampling Age at sampling Age at sampling Age at sampling Figure 1: T lymphocyte response to BCG. Immune response to BCG was assessed by measuring T cell prolifération as well as IFN-y, IL-5 and IL-13 production in response to PPD in vitro restimulation. Responses to PPD were measured at birth in a sériés of cord blood (gray bars, n=23); at 2 months of âge, post-vaccination in infants who received BCG at birth (crossed bars, n infants tested ranged from 30 to 32, depending on the response measured) and pre-vaccination in infants scheduled to receive BCG at 2 months (hatched bars, n= 26 to 34) or 4.5 months of âge (open bars, n=27 to 32); at 4.5 months of âge, post-vaccination in infants who received BCG at birth (crossed bars, «= 23 to 27) or at 2 months of âge (hatched bars, n- 23 to 29), and pre-vaccination in infants scheduled to receive BCG at 4.5 months (open bars, n= 22 to 26). Data are expressed as géométrie mean and 95% CI except IL-5 concentrations that are expressed as médian and 95% CI. The figure shows the test P-value obtained in a régression model adjusting for birth weight, ethnicity, date and season of delivery, sex, and birth order. anti-PVl antibody concentrations than infants who had not received BCG. These concentrations were also higher than that measured in infants who received BCG at the time of priming. Discussion This study is the first to demonstrate that BCG vaccination in early life significantly enhances T and B cell responses to unrelated vaccine antigens. Unexpectedly, BCG vaccination 1) affected responses to various vaccines differently whether administered at the time of priming, boosting or even before priming, 2) enhanced both Thl and Th2 cytokine responses to unrelated antigens, and 3) extended its influence on antibody responses to the mucosally administered oral polio vaccine. The effect of BCG on unrelated vaccine antigens injected in the same arm was found to dépend on the vaccine antigen and on the timing of immunization in relation to BCG administration. The strongest influence of BCG was observed on responses to HBV, one of the most immunogenic vaccines administered to infants '. The administration of BCG at the time of HBV priming at birth markedly increased T cell (prolifération, IFN-y, IL-5, IL-13) as well as antibody responses to HBV. When given at 2 months of âge, at the time of booster HBV immunization, BCG also increased the production of type 2 cytokines, but not the proliférative, IFN-y or antibody responses. BCG also increased the immune response to priming with TT. BCG administration at 2 months of âge, together with the first dose of DPT, increased the production of type 2 cytokines in response to TT but did not significantly influence TT-specific proliférative, IFN-y or antibody responses. No significant effect was observed on the antibody response to DT (for which cellular responses were not assessed), in keeping with data reported by Simondon et al. showing no influence of BCG vaccination on antibody response to pertussis vaccine ".A surprising finding was that a similar increase of TT-specific IL-13 responses was observed when BCG was given at birth, 2 months before DTP priming. Thus, BCG may influence T and B cell responses to unrelated vaccine antigens that are administered at the same injection site either simultaneously or even several weeks later. Figure 2: T lymphocyte response to HBV. AH infants were vaccinated with HBV at birth, 2 and 4 months of âge. Immune response to HBV was assessed by measuring T cell prolifération as well as IFN-y, IL-5 and IL-13 production in response to HBs Ag in vitro restimulation. Responses to HBs Ag at birth were measured in a sériés of cord blood (gray bars, n=23). Responses to HBs Ag were measured at 2 and 4.5 months in infants who received BCG at 4.5 months of âge (open bars, control infants, n tested ranged from 27 to 32 at 2 months and from 22 to 26 at 4.5 months, depending on the response measured), at 2 months of âge (hatched bars, n= 26 to 34 at 2 months and «=23 to 29 at 4.5 months) or at birth (crossed bars, n=30 to 32 at 2 months and «=23 to 27 at 4.5 months). Data are expressed as géométrie mean and 95% CI except IL-5 concentrations that are expressed as médian and 95% CI. The figure shows the test Pvalue obtained in a régression model adjusting for birth weight, ethnicity, date and season of delivery, sex, and birth order. One of the central characteristics of Thl and Th2 cells is that they reciprocally inhibit their différentiation and fimction Given the induction of a potent Thl type response to mycobacterial antigens such as PPD, the observation that BCG promoted both type 1 and type 2 cytokine responses to unrelated vaccine antigens was unexpected. In fact, the production of Th2 cytokines was more ffequently increased than that of Thl. The mechanism underlying the stimulation of T cell responses by BCG is likely to be related to its influence on the maturation of néonatal dendritic cells (DC), as DC are essential antigen-presenting cells for the priming of naïve T cells Mycobacteria, including M. bovis BCG, activate adult DC, increasing their production of IL-12 and their expression of co-stimulatory molécules, which support the induction of Thl responses However, recent data indicate that DC derived from cord blood monocytes hâve defective expression of IL-12 (p35) gene as well as of membrane costimulatory molécules Under sub-optimal conditions of co-stimulation, IL-12 was shown to stimulate the production of both type 1 and type 2 cytokines by néonatal CD4 T cells The promotion of type 1 and type 2 cytokine (or even prédominant Th2 cytokine) responses by BCG in early life could thus be related to a sub-optimal State of activation of néonatal DC. Further studies are needed to evaluate whether the promotion of type 2 cytokine responses to unrelated antigens by BCG is a characteristic feature of néonatal responses, or whether it is also observed in adults. The mechanisms underlying the influence of BCG on the priming of antibody responses to unrelated vaccine antigens is likely to involve enhanced activation of T lymphocytes by APC. In support of this hypothesis, the enhanced HBV antibody response following BCG vaccination at birth paralleled the marked increase in the production of T cell cytokines, whereas the more modest increase in the cytokine response to TT was not associated with significant changes in the TT antibody response. The increased antibody response to HBV priming was marginal when assessed at 2 months of âge, whereas a marked increase was observed at 4.5 months of âge. This indicates that BCG at birth had a limited impact on early life plasmocyte différentiation, but markedly enhanced induction of memory B cells. This is in accordance with studies in mice suggesting that induction of memory B cells occurs much earlier during life than plasmocyte différentiation '. The enhancement of APC-T cell interactions did not appear to be sufficient to promote the antibody response to booster HBV immunization. Indeed, although a similar increase in the production of Figure 3; T lymphocyte response to PHA. T lymphocyte response to PHA was assessed by measuring T cell prolifération as well as IFN-y, IL-5 and IL-13 production in vitro. Responses to PHA at birth were measured in a sériés of cord blood (gray bars, n-23). Responses to PHA were measured at 2 and 4.5 months in infants who received BCG at 4.5 months of âge (open bars, control infants, n tested ranged from 27 to 32 at 2 months ffom 22 to 26 at 4.5 months, depending on the response measured), at 2 months of âge (hatched bars, n=26 to 34 at 2 months and n=23 to 29 at 4.5 months) or at birth (crossed bars, n=30 to 32 at 2 months and n=23 to 27 at 4.5 months). Data are expressed as géométrie mean and 95% CI. The figure shows the test P-value obtained in a régression model adjusting for birth weight, ethnicity, date and season of delivery, sex, and birth order. type 2 cytokines was observed in infants who received BCG at the time of priming or boosting, the antibody response was not increased by BCG when given at the time of boosting. BCG considerably influenced the antibody response to mucosally administered oral polio vaccine. Newboms develop a relatively weak response to OPV and BCG vaccination at birth did not significantly increased OPV antibody responses. In contrast, BCG markedly enhanced OPV antibody response when given at 2 months of âge, together with the third dose of OPV. These data suggest that the maturation of B cell responses to OPV is associated with an increased responsiveness to the influence of BCG. The marked increase in the response to OPV suggests that intradermal BCG vaccination can influence immune responses to unrelated antigens at the systemic level. A systemic modulation of immune responses was recently observed in patients with intestinal helminth infection De Smedt et al. reported that injection of bacterial products induces the migration and the maturation of splenic DC in mice . A similar mechanism could be involved in the upregulation of systemic immune responses by BCG. This study has several important implications. First, BCG administration, in its native form or as a live vector, could be a useful strategy to improve the immunogenicity of vaccines in early life Second, BCG vaccination in early life could influence immune responses to unrelated infections pathogens. A recent report indicating that BCG vaccination is associated with reduced mortality in infants in Guinea-Bissau emphasizes the potential public health relevance of this hypothesis . The possible R 91 influence of BCG on the development of allergie reactions remains controversial ’ ’ 99 . The enhancement of Th2 responses by BCG observed m this study suggests that the influence of BCG on the immune response to allergens is likely to be more complex than a polarization towards Thl responses. P=0.77 Age at sampling Age at sampling 3 BCG at 4.5 months (contrais) V777\ BCG at 2 months KXZ2 BCG at birth Figure 4; T lymphocyte response to TT. Ail infants were vaccinated with DPT at 2 and 4 months of âge. Immune response to TT was assessed by measuring T cell prolifération as well as IFN-y, IL-5 and IL-13 production in response to TT in vitro restimulation. Responses to TT were measured at 2 and 4.5 months in infants who received BCG at 4.5 months of âge (open bars, control infants, n tested ranged from 27 to 32 at 2 months and from 22 to 26 at 4.5 months, depending on the response measured), at 2 months of âge (hatched bars, n=26 to 34 at 2 months and n=23 to 29 at 4.5 months) or at birth (crossed bars, n=30 to 32 at 2 months and n=23 to 27 at 4.5 months). Data are expressed as géométrie mean and 95% CI except ail IL-5 and IL13 concentrations as well as IFN-y concentrations measured at 2 months which are expressed as médian and 95% CI. The figure shows the test P-value obtained in a régression model adjusting for birth weight, ethnicity, date and season of delivery, sex, and birth order. Methods Study design and population This study was a prospective and randomized trial approved by the Gambia Govemment/Medical Research Council (MRC) Ethics Committee. Newboms were enrolled at birth at Royal Victoria Hospital, Banjul, after maternai informed consent. The following were excluded from the study, neonates bom to mothers with systemic infection at the time of delivery, newboms with congénital defects, with birth weight less than 2.5 kg and twins. When a person with a suggestive history of tuberculosis was found in the compound, the newbom was vaccinated with BCG and excluded from the study. Enrolled newboms were randomly allocated in blocks of six to one of three groups, receiving BCG immediately, at 2 months or at 4.5 months of âge (control infants). Ail other vaccines were given according to recommendation of the Gambian Expanded Program for Immunization, including OPV at birth, 1, 2 and 3 months, HBV at birth, 2 and 4 months and diphtheria / whole cell pertussis / tetanus vaccine (DPT) at 2, 3 and 4 months. Blood samples were collected at birth (cord blood), 2 and 4.5 months of âge. 151 newboms were enrolled into the study. 104 were studied at 2 months, including 35, 35 and 34 infants vaccinated with BCG at birth, 2 or 4.5 months of âge, respectively. 85 were studied at 4.5 months, including 28, 29 and 28 infants vaccinated with BCG at birth, 2 or 4.5 months of âge, respectively. Pre-vaccination T cell responses to BCG and HBV were measured in a consecutive sériés of 23 cord blood samples. Vaccines BCG (0.05 ml, Aventis Pasteur, Lyon, France) was given intradermally in the left arm. HBV (0.5 ml, Engerix B, Glaxo SmithKline, Rixensart, Belgium) and whole cell DPT (0.5 ml, Aventis Pasteur) were injected intramuscularly in the left arm. OPV (Sabin, Glaxo SmithKline) was given orally. In vitro lymphocyte responses to vaccine antigens Peripheral blood mononuclear cells (PBMC) were isolated by density gradient centrifugation (Lymphoprep, Nycomed, Oslo, Norway) and resuspended in complété RPMI medium supplemented with 10% human AB semm (Sigma, St. Louis, MO). PBMC (IOV2OO pl) were incubated with antigens including purified protein dérivative (PPD RT49, 10 |J.g/ml, Statens Sérum Institute, Copenhagen, Denmark), hepatitis B surface antigen (HBsAg, 2 pg/ml, Glaxo SmithKline) and tetanus toxoid (TT, 2 pg/ml, Chiron Behring, Marburg, Germany), PHA (PHA-L, 10 pg/ml. Sigma Chemicals, UK) or medium alone. [Methyl-^H] Thymidine ( 1 pCi/well, Amersham Life Science, UK) was added for the final 17 h of culture to assess cell prolifération. Thymidine incorporation was measured by liquid scintillation using a Betaplate reader (LKB1205, Turku, Finland) Cytokine assays Cytokine concentrations were measured in supematants collected on day 2 (PHA) or day 6 (medium and antigens) using commercially available reagents (IFN-y and IL-5: BioSource Europe, Fleurus, Belgium; IL-13: Diaclone, Besancon, France). Antibody assays Neutralizing antibodies to poliovirus type 1 were measured as recommended by the World Health Organization Dilutions of heat-inactivated sera were incubated with poliovirus (100 TCID50) for 3 h. The mixture was incubated with Hep-2 cells for 5 days. The sérum antibody titer was taken as the highest sérum dilution protecting 50% of cultures against virus challenge and was converted into international units. Antibody concentrations to TT, diphtheria toxoid (DT) and HBsAg were determined by ELISA on plates coated with TT (Chiron Behring), DT (Aventis Pasteur), or HBsAg antigen (GlaxoSmithKline). Incubation of sérum samples was followed by successive addition of biotinylated goat anti human IgG (Sigma) and extravidineperoxidase (for TT and DT antibodies) or peroxidase-coupled goat anti human IgG (Cappell-ICN, Costa Mesa, CA, for HBsAg antibodies) and ABTS substrate. Antibody concentrations were calculated with the Softmax^ PRO software (Molecular Devices) by comparison with standard curves (4-parameter fitting) using international standards of reference. Values below the assay cut-off (i.e. < 100 mlU/ml (tetanus, diphtheria) or 150 mlU/ml (hepatitis B)) were arbitrarily given a value of half the cutoff for détermination of mean géométrie titers. Statistical analysis Background production of cytokines measured in control wells was subtracted from that measured in antigen-stimulated wells. After logarithm transformation, data were compared using the t-test. Where there were either many non-responders or persistent skewing of data after log transformation, the Wilcoxon test was used. Multiple régression analysis was conducted to allow for potential confounders. Despite randomization group 2 infants had a lower birth weight (p = 0.02). Thus birth weight, ethnicity, date and season of delivery, sex, parity of mother were adjusted for. Those measurements with many non-responders were categorized and analyzed by ordinal logistic régression. Tables and figures show adjusted p values for three pairwise comparisons. At 2 months sampling groups vaccinated with BCG at 2 or 4.5 months were combined and compared to the group vaccinated at birth. At 4.5 months sampling the group vaccinated with BCG at 4.5 months was compared to groups vaccinated at birth or 2 months, separately. Statistical significance was assessed at the two-sided 0.05 level. Ail statistical analysis was done using Stata software (version 6; Stata Corporation, College Station, TX). Acknowledgments We are particularly gratefiil to Paolo Valenti and Gianna Cadau for excellent technical assistance in antibody déterminations and to Suleyman Manjang for excellent field Work. We thank Clothilde Thiriart and Martine Wettendorff, Glaxo-SmithKline, Belgium, for providing vaccines and vaccine antigens for the in vitro assays. This study would not hâve been possible without the help and support of the Gambian EPI Program and the staff of the Royal Victoria Hospital, Banjul, The Gambia. This study was funded by the Medical Research Council, UK and by Glaxo-SmithKline, Belgium. We are extremely grateful to the mothers who accepted to hâve their baby enrolled into a study on the first day of their life. Référencés 1. Siegrist, C.A. Néonatal Vaccinology. Vaccine. (2001) (in press). 2. Marchant, A. & Newport, M. Prévention of infections diseases by néonatal and early infantile immunization: prospects for the new millennium. Curr. Opin. Infect. Dis. 13, 241-246 (2000). 3. Adkins, B. T-cell fimction in newbom mice and humans. Immunol. Today. 20, 330-335 (1999). 4. Goriely, S. et al. Déficient IL-12 (p35) gene expression by dendritic cells derived from néonatal monocytes. J. Immunol. 166, 2141-2146 (2001). 5. Barrios, C. et al. Néonatal and early life immune response to varions forms of vaccine antigens differ from adult immune responses: prédominance of a Th2biased pattern which persists afiler adult boosting. Eur. J. Immunol. 26: 1489-1496 (1996). 6. Marchant, A. et al. Newboms develop a Thl-type Immune response to Mycobacterium bovis Bacillus Calmette-Guérin vaccination. J. Immunol. 163, 2249-2255 (1999). 7. Vekemans , J. et al. Néonatal bacillus Calmette-Guérin vaccination induces adultlike IFN-y production by €04"^ T lymphocytes. Eur. J. Immunol. (2001) (in press). 8. Aaby, P. et al. Early BCG vaccination and réduction in atopy in Guinea-Bissau. Clin. Exp. Allergy. 30, 644-650 (2000). 9. Colditz GA, et al. The efficacy of Bacillus Calmette-Guérin vaccination of newboms and infants in the prévention of tuberculosis: meta-analysis of the published literature. Pediatrics. 96, 29-35 (1995). 10. Mulholland, K. et al. Maternai immunization with Haemophilus influenza type b polysaccharide-tetanus protein conjugate vaccine in The Gambia. J.A.M.A. 275, 1182-1188 (1996). 11. Simondon, F. et al. Randomised study of the possible adjuvant effect of BCG vaccine on the immunogenicity of Diphtheria-Tetanus-Acellular Pertussis vaccine in Senegalese infants. Eur. J. Clin. Microbiol. Infect. Dis. 18, 23-29 (1999). 12. Abbas, A., Murphy, K.M. & Sher, A. Functional diversity of helper T lymphocytes. Nature. 383, 787-793 (1996). 13. Banchereau, J. & Steinman, R.M. Dendritic cells and the control of immunity. Nature. 392, 245-252 (1998). 14. Inaba, K., Inaba, M., Naito, M. & Steinman, R.M. Dendritic cell progenitors phagocytose particulates, including bacillus Calmette-Guérin organisms, and sensitize mice to mycobacterial antigens in vivo. J. Exp. Med. 178, 479-488 (1993). 15. Henderson, R.A., Watkins, A.S.C. & Flynn, J. Activation of human dendritic cells following infection with Mycobacterium tuberculosis. J. Immunol. 159, 635-643 (1997). 16. Ohshima, Y. & Delespesse, G. T cell-derived IL-4 and dendritic cell-derived IL12 regulate the lymphokine-producing phenotype of alloantigen-primed naïve human CD4 T cells. J. Immunol. 158, 629-636 (1997). 17. Borkow, G. et al. Chronic immune activation associated with intestinal helminth infections results in impaired signal transduction and anergy. J. Clin. Invest. 106, 1053-1060 (2000). 18. De Smedt, T. et al. Antigen-specific lymphocytes regulate lipopolysaccharideinduced apoptosis of dendritic cells in vivo. J. Immunol. 161, 4476-4479 (1998). 19. Zhu, Y. et al. Recombinant Bacille Calmette-Guérin expressing the measles virus nucleoprotein protects infant Rhésus macaques from measles virus pneumonia. J. Infect. Dis. 176, 1445-1453 (1997). 20. Kristensen, I., Aaby, P. & Jensen, H. Routine vaccination and child survival; follow-up study in Guinea-Bissau. B.M.J. 321, 1435-1439 (2000). 21. Gruber, C., Kulig, M., Bergmann, R., Guggenmoos-Holzmann, I. & Wahn, U. Delayed Hypersensitivity to Tuberculin, Total Immunoglobulin E, Spécifie Sensitization, and Atopie Manifestation in Longitudinally Followed Early Bacille Calmette-Guerin-Vaccinated and Nonvaccinated Children. Pediatrics. 107, E36 (2001). 22. Alm, J.S., Lilja, G., Pershagen, G. & Scheynius, A. Early BCG vaccination and development of atopy. Lancet. 350,400-403 (1997). 23. Manual for the virological investigation of polio. World Health Organization, (Geneva, Switzerland, 1997). 5. L’infection maternelle à Trypanosoma cruzi module la capacité de nouveaunés non infectés à produire des cytokines pro- et anti-inflammatoires Résumé • Objectif Etudier l’effet de l’infection maternelle à T. cruzi sur la capacité de nouveau-nés non infectés à produire des cytokines impliquées dans la réponse immune innée (IL-lp, IL-6, TNF-a, IL-10, TNFRl, TNFR2) et adaptative (IL-2, IFN-y, IL-4). • Résultats L’infection maternelle à T. cruzi s’accompagne d’une production accrue de cytokines d’origine lymphocytaire (IFN-y, IL-2, IL-4) en réponse à la stimulation de cellules sanguines par un lysat parasitaire, témoignant de la présence de lymphocytes spécifiques d’antigènes parasitaires dans la circulation maternelle. On observe une production d’IFN-y en réponse au lysat parasitaire chez 2 sur 17 nouveau-nés de mères infectées. Chez les mères infectées et chez leurs nouveau-nés, on trouve une capacité accrue de production de cytokines pro-inflammatoires (IL-ip, IL-6 et TNFa) et anti-inflammatoires (IL-10, TNFRl, TNFR2) en réponse au lysat parasitaire, ainsi qu’une augmentation d’IL-ip et d’IL-6 en réponse à la stimulation par le lipopolysaccharide bactérien et la phytohaemagglutinine. • Conclusions L’infection maternelle à T. cruzi semble n’induire une activation lymphocytaire que chez une faible proportion de nouveau-nés. Par contre, la production accrue de cytokines pro- et anti-inflammatoires par des nourrissons non infectés nés de mères infectées témoigne de l’existence d’une activation monocytaire. 51 Infection and Immunity, Sept. 2000, p. 5430-5434 0019-9567/00/S04.00+0 Copyright © 2000, American Society for Microbiology. Ail Rights Reserved. Vol. 68, No. 9 Maternai Trypanosoma cruzi Infection Upregulates Capacity of Uninfected Neonate Cells To Produce Pro- and Anti-Inflammatory Cytokines JOHAN VEKEMANS,‘t CARINE TRUYENS,* FAUSTINO TORRICO,^ MARCO SOLANO,^ MARY-CRUZ TORRICO,^ PATRICIA RODRIGUEZ,== CRISTINA ALONSO-VEGA,*’^ AND YVES CARLIER'* Laboratory of Parasitology, Faculty of Medicine, University of Brussels, Brussels, Belgium,^ and CUMETROPILABIMED, Faculty of Medicine, Universidad Mayor de San Simon Cochabamba, Bolivia^ Received 15 February 2000/Returned for modification 28 March 2000/Accepted 12 June 2000 The possibility of maternai in utero modulation of the innate and/or adaptive immune responses of unin­ fected newborns from Trypanosoma cruzi-infected mothers was investigated by studying the capacity of their whole blood cells to produce cytokines in response to T. cruzi lysate or lipopolysaccharide-plus-phytohemagglutinin (LPS-PHA) stimulation. Cells of such newborns occasionally released gamma interferon (IFN-7) and no interleukin-2 (IL-2) and IL-4 upon spécifie stimulation, while their mothers responded by the production of IFN-7, IL-2, and IL-4. Infection in mothers was also associated with a hyperactivation of maternai cells and also, strikingly, of cells of their uninfected neonates, since their release of proinflammatory (IL-lp, IL-6, and tumor necrosis factor alpha [TNF-ot]) as well as of anti-inflammatory (IL-10 and soluble TNF receptor) cytokines or factors was upregulated in the presence of LPS-PHA and/or parasite lysate. These results show that T. cruzi infection in mothers induces profound perturbations in the cytokine response of their uninfected neonates. Such maternai influence on néonatal innate immunity might contribute to limit the occurrence and severity of congénital infection. routine immunoturbidimetry, were within the normal ranges (means ± standard errors of the means [SEM]): 1.30 z: 0.17 and 1.19 i 0.32 mg/dl for uninfected and infected mothers, respectively, and below the détection limit of 0.2 mg/dl for neonates). This study was approved by the scientific/ethic committees of UMSS and Free University of Brussels (ULB), and informed written consent of the mothers was obtained before blood collection. Cord and maternai blood were collected just after delivery in endotoxin-free heparinized tubes (Becton Dickinson, MLS SA, Menin, Belgium) and immediately used for stimulation of whole blood cells (WBC) and study of cytokine production. Cord blood (10 ml) was also collected on EDTA disodium sait (Sigma, St. Louis, Mo.), added to 10 ml of 6 M guanidine hypochloride (Sigma), and kept at room température until use for T. cmzi-specific PCR. T. cruzi trypomastigotes and amastigotes (Tehuantepec strain) were obtained from culture medium of infected 3T3 flbroblasts as previously described (18). After three washings in RPMI 1640 medium, they were submitted to eight cycles of freezing-thawing under stérile conditions. The parasite lysate was stored at —70°C until use for cell stimulation. The prepared batch of T. cruzi lysate contained no détectable endotoxin (<1 pg/lO’ lysed parasites), as determined by the Limulus amebocyte lysate assay (BioWhittaker Europe, Verviers, Belgium). Lipopolysaccharide (LPS; from Escherichia coli 0111B4) and phytohemagglutinin (PHA) were purchased from Sigma. Maternai infection was assessed using the classical parasitespecific serological tests of enzyme-linked immunosorbent as­ say (ELISA), hémagglutination, and immunofluorescence (9). T. cmzi-specific immunoglobulin M (IgM) antibodies were not detected in maternai plasma by ELISA, indicating that moth­ ers were in the chronic form of Chagas’ disease. T. cruzi con­ génital infection in newborns was sought in cord blood by (i) Matemal-fetal transmission of Trypanosoma cruzi, the protozoan parasite agent of Chagas’ disease in Latin America, occurs in 2 to 12% of pregnancy in chronically infected moth­ ers, inducing severe disease and significant mortality (4, 7). The factors enabling the vertical transmission to occur, as well as those allowing the vast majority of babies of infected moth­ ers to remain uninfected, are not entirely known. Maternalfetal transfer of antigens might influence the capacity of the progeny to respond to infection through modulating the fêtai immune System (11,12,19, 22, 28, 39). However, there is little information on innate immunity of neonates in the case of maternai infection, whereas monocyte activation plays a cen­ tral rôle in controlling infection (20) as well as in maintaining pregnancy (36). To better understand the matemal-fetal immunological relationship in human T. cruzi infection, we explored the capacity of uninfected neonates and their infected mothers to produce type 1 (gamma interferon [IFN-7] and interleukin-2 [IL-2]) and type 2 (IL-4 and IL-5) cytokines, as well as proinflammatory (IL-ip, IL-6, and tumor necrosis fac­ tor alpha |TNF-a]) and anti-inflammatory (IL-10 and soluble TNF receptor [sTNFR]) factors. Seventeen asymptomatic mothers chronically infected with T. cruzi and 58 uninfected mothers from the Matemity German Urquidi (Universidad Mayor de San Simon [UMSS]), Cochabamba, Bolivia, and their uninfected neonates were enrolled in this study. Ail newborns were delivered at term. Cases of known pathology of newborns or mothers during pregnancy, twins, or cesarean-bom babies were excluded. Cross-reactive protein levels in maternai and cord plasma, determined by * Corresponding author. Mailing address: Laboratoire de Para.sitologie. Faculté de Médecine U.L.B., route de Lennik 808, CP 616, B-1070 Brussels, Belgium. Phone: 32 2 555 62 50. Fax: 32 2 555 61 28. E-mail: [email protected]. t Présent address: Medical Research Council, Fajara, The Cambia. 5430 NOTES Vol. 68, 2000 A IFN-r (pg/nJ) stinivdus A 11^2 (pg/nü) A IL-4 (pg/nd) 5431 A 11^5 (pg/nü) patient h LPS-PHA mother 24 72 neonate 24 72 T.cruzi mother 24 72 neonate 24 72 FIG. 1. Production of type 1 and type 2 cytokines by WBC from T. cmri-infcctcd (■) or uninfcctcd (□) mothers and their newboms. WBC wcrc stimulatcd or not for 24 or 72 h with LPS (10 ng/ml) plus PHA (5 |ig/ml) (A, C, E, and G) or a lysatc of T. cruzi (10'’ lyscd parasitcs/ml) (B, D, F, and H). Numbers of individual.s in cach group ranged from 26 to 43 for uninfcctcd mothers, 11 to 16 for infcctcd mothers, 25 lo 47 for neonates from uninfcctcd mothers, and 7 to 13 for uninfcctcd neonates from infcctcd mothers. Rcsults (mcan ± SEM) arc expressed as the différences between Icvcls obtaincd for stimulatcd and unstimulatcd cclls. The Mann-Whitney-Wilcoxon U test was used for statistical comparisons between infcctcd and uninfcctcd mothers and between their newboms (•, P < 0.05; P < 0.005). direct analysis of parasites by microscopie examination of buffy coat of blood coîlected in four heparinized microhematocrit tubes (each of 75 p.1) (23), (ii) T. cruzi-specific PCR, performed with the primers S35 (5'-AAA TAA TGT ACG GG(T/G) GAG ATG CAT GA-3') and S36 (5'-GGG TTC GAT TGG GGT TGG TGT-3') (42) as described by Centurion-Lara et al. (13), and (iii) détection of T. cmzt-specific IgM and IgA antibodies by spécifie ELISA. These techniques allowed us to detect one congenitally infected newbom in 18 séropositive mothers (5.6%), who was not included in this study. The WBC stimulation test was performed as previously reported (15), with minor modifications. Tenfold-diluted blood was incubated in polypropylene tubes (Falcon) either without stimulating agents or in the presence of either LPS (10 ng/ml) plus PHA (5 pg/ml) or T. cruzi lysate (10* lysed parasites/ml). After 24 or 72 h of incubation at 3TC in a 5% CO2 atmo­ sphère, the samples were centrifuged and the supematants were coîlected and kept at —70°C. Cytokine levels were determined using the following commercially available ELISAs: for lL-2, IFN--y, and TNF-a (detecting free and soluble TNFRbound TNF-a), EASIA from Medgenix, BioSource Europe, Nivelles, Belgium; for IL-4 and IL-10, ultrasensitive assays from Biosource, Nivelles, Belgium; for IL-ip, standard and antibody pairs from Genzyme, R&D Systems Europe, Abigdon, Oxon, United Kingdom; and for IL-5, Duoset Genzyme. Antibodies and standards kindly given by W. Buurman (De­ partment of Surgery, University of Limburg, Maastricht, The Netherlands) were used for sTNFR type 1 (sTNFRl), sTNFR2, and IL-6 déterminations, performed as previously described (16, 26, 38). The détection îimits of ELISAs were as follows: for IL-lp and IL-2, 10 pg/ml; for IL-4, 0.07 pg/ml; for IL-5, 8 pg/ml; for IL-10, 0.20 pg/ml; for IFN-y, 1.5 pg/ml; for lL-6, TNF-a, sTNFRl, and sTNFR2, 20 pg/ml. Results after WBC stimulation are expressed as the différences between the cytokine levels of stimulated and unstimulated cell samples (supematants of 1/10-diluted blood) at the same incubation time, without further correction by the dilution factor. Results are expressed as arithmetic means d: SEM of ail individual patients tested in each group. The Mann-Whitney-Wilcoxon U test was used for comparison between groups. (i) Cells of T. cnizi-infected mothers product ITN-y, lL-2, and lL-4 in response to parasite stimulation, whereas neonate cells occasionally release IFN-7. Whatever the patient group (infected or uninfected mothers and their neonates), IFN-7, IL-2, IL-4, and IL-5 were not spontaneousiy released by blood cells or were released only at similar background levels in ail patient groups. Mitogenic stimulation with LPS-PHA showed that maternai and néonatal cells were able to produce the type 1 cytokines IL-2 and IFN-7, with no significant différence according to maternai infection status (Fig. lA and C). Though neonates are generally considered poor IFN-7 producers (45), in this study newbom WBC were as able as WBC from the mothers to produce significant amounts of IFN-7 and IL-2, although with slightly different kinetics: newboms were more prone to produce IL-2 at 24 h than their mothers, whereas IFN-7 release was delayed. By contrast, but in agreement with previous work (46), the type 2 cytokines IL-4 and IL-5 were not produced by neonates from both groups in the presence of mitogens, whereas their mothers did produce these cytokines (Fig. lE and G). As expected, mothers chronically infected with T. cruzi harbored parasite-specific memory T cells, since their WBC re­ leased lymphocyte-derived cytokines (IFN-7, IL-2, and IL-4 but not IL-5 [Fig. IB, D, F, and H]) when incubated with T. cruzi antigens. Moreover, the production of both type 1 and type 2 cytokines suggests that the adaptive response to the parasite in mothers is not polarized, in agreement with previ­ ous reports on human and experimental Chagas’ disease (17, 47). Since matemal-fetal transfer of parasite antigens, présent in maternai blood (1) or released from parasites présent in the placenta (unpublished data), is likely in the case of maternai T. cruzi infection and could lead to lymphocyte priming (29), we also investigated the production of lymphocytic cytokines in uninfected neonates from infected mothers upon spécifie stim- 5432 Infect. Immun. NOTES stiiuvilus patient h LPS-PHA mother 24 72 neonate 24 72 FIG. 2. Production of proinflammatoiy cytokines by WBC front T. cruzi-mfeaed (■) or uninfcctcd (□) mothers and their newboms. WBC wcrc stimulatcd or nol for 24 or 72 h with LPS (10 ng/ml) plus PHA (5 pg/ml) (A, C, and E) or a lysatc of T. cmri (10'’ lyscd parasitcs/ml) (B, D, and F). Numbers of individuals in cach group ranged front 23 to 42 for uninfcctcd mothers, 7 to 13 for infcctcd mothers, 16 to 46 for neonates from uninfcctcd mothers, and 8 to 15 for uninfcctcd nconates from infcctcd mothers. Rcsults (mcan ± SEM) arc expressed as the différence between Icvcls obtaincd for stimulatcd and unstimulatcd cclLs. The Mann-Whitncy-Wilcoxon V test was used for stahstical comparisons between infcctcd and uninfcctcd mothers and between their newboms (*, P < 0.05; •*, P < 0.(X)5). ulation of WBC with T. cruzi lysate. However, except for significant IFN-y production by one neonate at 24 h (100 pg/ml) and another at 72 h (170 pg/ml), no type 1 or 2 cytokines were detected (Fig. IB, D, F, and H). This could be related to (i) a low release of such cytokines and/or cytokine consomption by cell receptors, thereby preventing their détection in ELISA (5); (ii) the presence of parasite-specific antibodies, transferred from mother into fêtai blood, disturbing antigen binding to antigen-presenting cells and the subséquent response by newborn T cells (40); or (iii) immunosuppression and/or apoptosis of lymphocytes induced by the parasitic molécules added in the WBC culture (25, 30). (ii) Maternai T. cruzi infection upregulates the capacity of maternai and neonate cells to produce proinflammatory cyto­ kines. In contrast to lymphocytic cytokines, IL-ip, IL-6, and TNF-a were spontaneously released by blood cells from moth­ ers as well as their neonates (data not shown), likely reflecting the monocytic activation normally associated with pregnancy and delivery (3, 37). As shown in Fig. 2A, C, and E, such spontaneous inflammatory cytokine release was enhanced in mothers and neonates upon in vitro stimulation with LPS-PHA (except for IL-6 in neonates of uninfected mothers). Moreover, IL-6, and to a lesser extent IL-1|3, levels were still higher in infected mothers and also, surprisingly, in their uninfected newboms. The parasite lysate strongly stimulated the produc­ tion of TNF-a and IL-6, and slightly that of IL-ip, in both chagasic mothers and their neonates (Fig. 2B, D, and F). A detailed analysis of individual results indicated that a simultaneous higher production of these cytokines was observed in 58% of newboms. T. cruzi infection in mothers could easily explain their higher capacity to produce inflammatory cyto­ kines. Indeed, although PHA-activated lymphocytes could be the source of IL-6, the simultaneous overproduction of three inflammatory cytokines suggests a monocytic origin. DifiFerent mechanisms could account for monocytic activation in infected mothers: (i) in vivo monocyte priming, known to occur during T. cruzi infection (8), strengthening the direct effect of parasite molécules supporting proinflammatory activities (2, 10, 21, 35) and présent in the parasite lysate used to activate cells; (ii) monocytic activation due to IPN-y released in vitro by spécifie lymphocytes after récognition of T. cruzi antigens; or (iv) proinflammatory cytokine release resulting from a cross-linking of FcR on monocytes and/or NK cells (6, 14, 27) by im­ mune complexes formed by the T. cmz/-specific antibodies présent in the blood of infected mothers and the parasite lysate added in vitro. It is puzzling to observe such overproduction of inflamma­ tory cytokines also in uninfected neonates from infected moth­ ers. This did not resuit from an increase of monocyte concen­ tration, since we hâve verified that their numbers are similar in both groups of neonates (202 ± 42 and 230 ± 23 monocytes/ mm^ for newbom of infected and uninfected mothers, respectively), strongly suggesting that their monocytes are hyperaciivated as in their mothers. Although the monocytic origin of proinflammatory cytokines has still to be confirmed, this is, as far as we know, the first indication of a maternai modulation of néonatal innate immunity in human infection. This agréés with our previous observations regarding experimental Chagas' disease showing that both fetuses and offspring of infected mice display increased TNF-a gene transcription and/or production (34). The origin of néonatal (and probably fêtai) monocytic hyperactivation remains unknown. Mechanisms similar to those mentioned above for mothers might also fonction in neonates, following matemal-fetal transfer of shed T. cruzi molécules or antibodies. In vivo IFN-y-dependent monocyte activation seems unlikely since this cytokine was hardly détect­ able in the supernatants of neonate cells. The maternai induc­ tion of such néonatal cell activation raises the question of its contribution in the control of congénital infection, since the neonates displaying such activation were uninfected (as veri­ fied by parasitological, PCR, and antibody détection). It is tempting to hypothesize that such newboms could be protected against an eventual vertical transmission of parasites, by a synergy between maternally transferred antibodies and acti- NOTES Vol. 68, 2000 A IL-10 (pg/ml) stimulus patient h A sTNFRl (pg/nü) 0 100 200 5433 A sTNFR2 (pg/ml) 300 0 10000 20000 30000 LPS-PHA mothei 24 72 neonate 24 72 FIG. 3. Production of anti-inflammatory cytokine and factors by WBC front T. entzi-inferted (■) or uninfcctcd (□) mothers and their newborns. WBC wcrc stimulaicd or not for 24 or 72 h with LPS (10 ng/ml) plus PHA (5 pg/ml) (A, C, and E) or a lysalc of T. cruzi (K)'’ lyscd parasilcs/ml) (B, D, and F). Numbers of individuals in cach group ranged from 22 to 41 for uninfcctcd mothers, 9 to 15 for infcctcd mothers. 26 to 43 for neonates from uninfcctcd mothers, and 8 lo 13 for uninfcctcd neonates from infeaed mothers. Rcsults (mcan ± SEM) arc expressed as the différence between Icvcls obtaincd in stimulatcd and unstimulaicd eclls. The Mann-Whitncy-Wilcoxon V test was used for statistical comparisons between infcctcd and uninfcctcd mothers and between their newborns {'.P < 0.05; •*,/’< 0.005). vated monocytes, previously shown to be effective in the in vitro and in vivo killing of parasites (32, 33, 44). (iii) Maternai T. cruzi infection upregulates the capacity of maternai and newborn cells to produce anti-inflamniatory fac­ tors. The effect of maternai infection on proinflammatory cy­ tokines prompted us to also investigate the production of the potent anti-inflammatory factor IL-10 (41), as well as the sT­ NFRl and sTNFR2, previously shown to play an essential rôle in modulating TNF bioactivity (31), particularly in experimen­ tal Chagas’ disease (43). Though only traces of IL-10 could be found in supematants of unstimulated cells from newborns and mothers (data not shown), LPS-PHA stimulated IL-10 produc­ tion by WBC from ail patient groups (Fig. 3A), whatever the maternai infection status. By contrast, maternai infection was associated with a higher reactivity of both mother and newborn WBC to parasite lysate, which produced two- to threefold more IL-10 after 24 h of culture than the control couples (Fig. 3B). Infection status did not modiiy the WBC release of both sTNFRs, either spontaneously (data not shown) or after incu­ bation with LPS-PHA (Fig. 3C and E). By contrast, T. cruzi components induced a higher release of both sTNFRs in infected mothers and their newborns (Fig. 3D and F). The overproduction of IL-10 and sTNFR by cells incubated with the parasite lysate was observed in the same newborns from infected mothers as those who responded upon proinflammatory cytokine production. The in vivo triggering of anti-inflammatory factors might protect fêtai or néonatal tissues against the harmful effects generated by the intense inflammatory reaction that would occur in the case of congénital infection. Such homeostatic régulation might also contribute to avoidance of the fêtai growth retardation associated with oveiproduction of TNF (24). Indeed, sTNFR/TNF molar ratios (calculated as previ­ ously described [43]) were similar in neonates of infected and uninfected mothers (data not shown). This suggests that TNF bioactivity remains similar in control and infected groups of mothers or neonates and could explain why neonates from infected mothers displayed normal birth weights (3,438 ± 154 and 3,293 1: 48 g for newborns from infected and uninfected mothers, respectively). In conclusion, a potent State of cell activation is induced in uninfected neonates (and probably fetuses) from T. cruzi-infected mothers, leading to the simultaneous production of proand anti-inflammatory factors in the presence of parasite an­ tigens. Such maternai influence on néonatal innate immunity might hâve protective effects, limiting the occurrence and outcome of congénital infections. We thank Mildreth Castro (CUMETROP, UMSS, Cochabamba, Bolivia) and Antonio Pardo, Amilcar Mercado, and Jaime Varga.s (Maternity Cerman Urquidi, Cochabamba, Bolivia) for the manage­ ment of patients, Jean-Marie Boeynaems (Erasmus Hospital, ULB, Brussels, Belgium) for CRP quantification, Corine Liesnard, Françoise Brancart, and Laurent Debaisieux (Erasmus Hospital, ULB) for help with PCR as.says, and Wim Buurman (Department of Surgery. Faculty II, University of Limburg, Maastricht, The Netherlands) for providing reagents for some ELISAs. This Work was supported by grants from Fonds National de la Recherche Scientifique (FNRS), Centre de Recherche Inter-Univer­ sitaire en Vaccinologie (CRIV), and Action de Recherche Concertée de la Communauté Française de Belgique (ARC). REFERENCES 1. Afiranchino, J. L., C. F. Ibanez, A. O. Luquetti, A Rassi, M. B. Reves. R. Macina, L. Aslund, U. Pettersson, and A. C. Frasch. 1989. Identification of a Trfpanosoma cruzi antigen that is shed during the acutc phase of Chagas' disease. Mol. Biochem. Parasitol. 34:221-228. 2. Almeida, I. C., M. M. Camargo, D. O. Procopio, L. S. Silva, A. Mehiert. L. R. Travassos, R. T. Gazzinelli, and M. A. Ferguson. 2000. Highiy purified glycosylphosphatidylinositols from Trypanosoma cruzi arc potent proinflanimatory agents. EMBO J. 19:1476-1485. 3. Austgulen, R., E. Lien, N. B. Liabakk, G. Jacobsen, and K. J. Arntzen. 1994. Incrcascd Icvcls of cytokines and cytokine acnviiy modifiers in normal pregnancy. Eur. J. Obstet. Gynecol. Reprod. Biol. 57:149-155. 4. Azogue, E., C. La Fuente, and C. Darras. 1985. Congénital Chagas' discase in Bolivia; cpidcmiological aspects and pathological findings. Trans. R. Soc. Trop. Med. Hyg. 79:176-180. 5. Baroja, M. L.. and J. L. Ceuppens. 1987. More exact quantification uf intcrlcukin-2 prcxJuction by addition of anti-Tac monoclonal antibody to cultures of stimulatcd lymphocytes. J. Immunol. Methods 98:267-270. fi. Berger, S., H. Ballo, and H. J. Stutte. 1996. Immune complcx-induccd in- 5434 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. Infect. Immun. NOTES tcrlcukin'6, intcrlcukin*l() and prostaglandin sccrction by human mono­ cytes: a network of pro- and anti-in0ammatory cytokines dépendent on the antigcn:antibody ratio. Eur. J. Immunol. 26:1297-1301. Bitteocourt, A. L. 1988. Ameriean trypanosomiasis (Chagas’ diseasc), p. 62-86. In C. MacLcod (ed.), Parasitic infections in pregnancy and the newborn. Oxford Medical Publications, Oxford, United Kingdom. Brener« and R. T. Gazzinelli. 1997. Immunological control of Trypanosoma cruzi infection and paihogencsis of Chagas’ diseasc. Int. Arch. Allcrgy Immunol. 114:103-110. Breniere, S. R. Carrasco, H. Miguez, J. L. Lemesre, and Y. Cartier. 1985. Comparisons of immunological tests for scrodiagnosis of Chagas diseasc in Bolivian patients. Trop. Geogr. Med. 37:231-238. Camargo, M. M., 1. C. Almeida, M. E. Pereira, M. A. Ferguson, L. R. Travassos, and R. T. GazzinellL 1997. Glycosylphosphatidylinositol-anchored mucin-like glycoproicins isolatcd from Tryponosoma cruzi trypomastigotes initiatc the synthesis of proinflammatory cytokines by macrophages. J. Immunol. 158:5890-5901. Camus, D., Y. Carlier, J. C Bina, R. Borojevic, A. Prata, and A. Capron. 1976. Sensitization to Schixto.soma mansoni antigen in uninfcctcd childrcn born to infcctcd mothers. J. Infect. Dis. 134:405-408. Carlier, Y,, and C. Truyens. 1999. Influence of maternai infection on offspring résistance towards parasites. Parasitol. Today 11:94-99. (>nturion-Lara, A., L. Barrett, and AV. C. Van Voortiis. 1994. Quantitation of parasitemia by compétitive polymerase chain reaction amplification of parasite kDNA minicirdes during chronic infection with Tryponosoma cruzi. J. Infect. Dis. 170:1334-1339. Débets, J. M., J. G. Van de AVinkel, J. L. Ceuppens, L E. Dieteren, and AV. A. Buurman. 1990. Cross-linking of both Fc gamma RI and Fc gamma RII induccs sccrction of tumor nccrosis factor by human monocytes, rcquiring high affinity Fc-Fc gamma R interactions. Functional activation of Fc gamma. J. Immunol. 144:1304-1310. De Groote, D., P. F. Zangerle, Y. Gevaert, M. F. Fassotte, Y. Béguin, P.-F. Noizat, J. Pirenne, R. Gathy, M. Lopez, L Dehart, et al. 1992. Direct stim­ ulation of cytokines (IL-1 beta, TNF-alpha, IL-6, IL-2, IFN-gamma and GM-CSF) in wholc blood. I. Comparison with isolatcd PBMC stimulation. Cytokine 4:239-248. Dentener, M. A., V. Bazil, E. J. Von Asmuth, M. Ceska, and AV. A. Buurman. 1993. Involvcmcnt of CD14 in lipopolysaccharidc-induccd tumor nccrosi.s factor-alpha, IL-6 and ID8 rclcasc by human monocytes and alvcolar mac­ rophages. J. Immunol. 150:2885-2891. Dutra, AV. O., K. J. Gollob. J. C. Pinto Dias, G. Gazzinelli, R. Correa Oliveira, R. L. Coflfiuan, and J. F. Carvalho Parra. 1997. Cytokine mRNA profile of pcriphcral blood mononuclcar cclls isolatcd from individuals with Trypano.^oma cruzi chronic infection. Scand. J. Immunol. 45:74-80. el Bouhdîdi, A., C. Truyens, M. T. Rivera, H. Bazin, and Y. Carlier. 1994. Trypano.Koma cruzi infection in micc induccs a polyisotypic hypergammaglobulinacmia and parasitc-spccific response involving high IgG2a concen­ trations and highly avid IgGl antibodics. Parasite Immunol. 16:69-76. Elson, L. A Days, M. Calvopina, AV. Paredes, E. A^a^jo, R. H. Guderian. J. E. Bradley, and T. B. Nutman. 1996. In utero c}q>osurc to Onchocerca volvulus: rclationship to subséquent infection intensity and cellular immune rcspon.sivcncss. Infect. Immun. 64:5061-5065. Fearon, D. T. 1997. Sccking wisdom in innatc immunity. Nature 388:323324. Femandez-Gomez, R., S. Esteban, R. Gomez-Corvera, K. Zoulika, and A. Ouaissi. 1998. Trypano.wma cruzi: Tc52 released protcin-induccd incrcascd expression of nitric oxide synthasc and nitric oxide production by macro­ phages. J. Immunol. 160:3471-3479. Fievet, N., P. Ringwald, J. Bickii, B. Dubois, B. Maubert, J. Y. Le Hesran, M. Cot, and P. Deloron. 1996. Malaria cellular immune rcsponscs in neonates from Cameroon. Parasite Immunol. 18:483-490. FreiliJ, H., L. Muller, and S. M. Gonzalez Cappa. 1983. Direct micromethod for diagnosis of acutc and congénital Chagas’ diseasc. J. Clin. Microbiol. 18:327-330. Fried, M., R. O. Muga, A. O. Misore, and P. E. Duffy. 1998. Malaria cliciLs type 1 cytokines in the human placenta: IFN-gamma and TNF-alpha associated with pregnancy outcomes. J. Immunol. 160:2523-2530. Kierszenbaum, F,, J. L, de Diego, M. Fresno, and M. B. Sztein. 1999. Inhibitory cffccts of the Trypano.wma cruzi membrane glycoprotcin AGCIO on the expression of IL-2 rcceptor chains and sccrction of cytokines by subpopulations of activated human T lymphocytes. Eur. J. Immunol. 29: 1684-1691. Leeuvrenberg. J. F., T. M. Jeunhorome, and AV. A. Buurman. 1994. Slow Editor: J. M. Mansfield 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. 46. 47. rclcasc of soluble TNF rcccptors by monocytes in vitro. J. Immunol. 152: 4036-4043. Leile de Moraes, M. and M. Dy. 1997. Natural killcr T cells: a poicnt cytokinc-producing ccll population. Eut. Cytokine Netw. 8:229-237. Malhotra, I., P. Mungai, A AVamachi, J. Kioko, J. H. Ouma, J. A\’. Kazura, and C. L, King. 1999. Hclminth- and Bacillus Calmcttc Guerin-induccd immunity in childrcn sensitized in utero to filariasis and schistosomiasis. J. Immunol. 162:6843-6848. Neves, S. F,, S. Eloi-Santos, R. Ramos, &. Rigueirinho, G. Gazzinelli. and R. Correa-Oliveira. 1999. In utero sensitization in Chagas’ diseasc leads to altcrcd lymphocyte phcnotypic patterns in the ncwbom cord blood mononuclear cclls. Parasite Immunol. 21:631-639. Nunes, M. P„ R. M. Andrade, M. F. Lopes, and G. A DosReis. 1998. Activation-induced T cell death exacerbâtes Trypano.\omû cruzi réplication in macrophages eocultured with CD4+ T lymphocytes from infcctcd hosLs. J. Immunol. 160:1313-1319. Olsson, I., T. Gatanaga, U. GuUberg, M. Lantz, and G. A. Granger. 1993. Tumour nccrosis factor (TNF) binding proteins (soluble TNF rcceptor forms) with possible rôles in inflammation and malignancy. Eur. Cytokine Nciw. 4:169-180. Plata, F., F. Garcia Pons, and J. AVietzerbin. 1987. Immune résistance to Tryponosoma cruzi: synergy of spécifie antibodics and rccombinani inter­ feron gamma in vivo. Ann. Inst. Pasteur Immunol. 138:397-415. Plata, F,, J. AVietzerbin, F. G. Pons, E. Falcoff!, and H. Eisen. 1984. Syncrgistic protection by spécifie antibodics and interferon against infection by Tryponosoma cruzi in vitro. Eur. J. Immunol. 14:930-935. Rivera, M. T., S. Marques de Araujo, R. Lucas, J. Deman, C. Truyens, M. P. Defresne, P, de Baetseüer, and Y. Carlier. 1995. High tumor nccrosis factor alpha (TNF-a) production in Tryponosoma cruzi-infcctcd prégnant micc and incrcascd TNF-a gcnc transcription in their offspring. Infect. Immun. 63: 591-595. Saavedra, E., M. Herrera, AV. Gao, H. Uemura, and M. A. Pereira. 1999. The Tryponosoma cruzi trans-sialidasc, through its COOH-tcrminal tandem repeat, uprcgulates intcrlcukin 6 sccrction in normal human intestinal microvascular endothélial cclls and pcriphcral blood mononuclcar cclls. J. Exp. Med. 190:1825-1836. Sacks, G., L Sargent, and C. Redman. 1999. An innatc view of human pregnancy. Immunol. Today 20:114-118. Sarandakou, A., G. Giannaid, A. Malamitsi-Puchner, D. Rizos, E. Hourdaki. E. Protonotariou, and L Phocas. 1998. Inflammaiory cytokines in newhorn infants. Mediators Inflamm. 7:309-312. Schols, A. M., AV. A Buurman, A. J. Staal van den Brekel, M. A. Dentener, and E. F. AVouters. 1996. Evidence for a relation between mctabolic dérange­ ments and incrcascd Icvcls of inflammatory mediators in a subgroup of patients with chronic obstructive pulmonary diseasc. Thorax 51:819-824. Shearer, G. M., and M. Clerici. 1996. Protcctivc immunity against HIV infection: has nature donc the experiment for us? Immunol. Today 17:21-24. Siegrist, C. A. 2000. Vaccination in the néonatal period and carly infancy. Int. Rev. Immunol. 19:195-219. Stordeur, P., and M. Goldman. 1998. lntcrlcukin-10 as a rcgulatory cytokine induccd by cellular stress: molccular aspects. Int. Rev. Immunol. 16:501-522. Sturm, N. R., AV. Degrave, C. Morel, and L. Simpson. 1989. Sensitive détec­ tion and schizodeme classification of Tryponosoma cruzi cclls by amplifica­ tion of kinctoplast minicirclc DNA séquences: use in diagnosis of Chagas’ diseasc. Mol. Biochem. Parasitol. 33:2(15-214. Truyens, C, F. Torrico, R. Lucas, P. de Baetselier, AV. A Buurman, and Y’. Carlier. 1999. The endogenous balance of soluble tumor nccrosis factor rcccptors and tumor nccrosis factor modulâtes cachexia and monality in micc acutcly infcctcd with Tryponosoma cruzi. Infect. Immun. 67:5579-5586. Umekita, L. F., and I. Mota. 2000. How arc antibodics involved in the protcctivc mcchanism of susceptible micc infeaed with T. cruzi'} Braz. J. Med. Biol. Rcs. 33:253-258. AVUson, C. B., L. Penix, AV. M. AVeaver, A. Melvin, and D. B. Lewis. 1992. Ontogeny of T lymphocyte fonction in the nconatc. Am. J. Reprod. Immu­ nol. 28:132-135. Yang, L. P., D. G. Byun, C. E. Demeure, N. Vezzio, and G. Delespesse. 1995. Default development of cloncd human naivc CD4 T cclls into intcrlcukin-4and intcrlcukin-5-producing cffcctor cclls. Eur. J. Immunol. 25:3517-3520. Zhang, L., and R. L. Tarleton. 1996. Characterization of cytoldnc production in murine Trypano.soma cruzi infection by in situ immunocytochemistry: lack of association between susceptibility and type 2 cytokine production. Eur, J. Immunol. 26:102-109. DISCUSSION et PERSPECTIVES 52 Le développement de nouvelles stratégies vaccinales permettant de fermer la fenêtre de vulnérabilité vis-à-vis des maladies infectieuses en période infantile est une urgence en pays en voie de développement Ces stratégies doivent permettre d’induire une immunité protectrice chez le nourrisson avant l’âge d’exposition au pathogène, une période marquée par l’immaturité du système immunitaire. A titre d’exemple, nous présentons en figure 10 le risque augmenté d’évolution chronique de l’hépatite B lors de l’acquisition de cette infection en bas âge Les modèles murins d’étude des fonctions du système immunitaire en début de vie mettent en évidence un déficit prépondérant d’induction de réponse vaccinale de type Thl, et le développement préférentiel de réponses de type Th2 De faibles réponses de type Thl en début de vie pourraient expliquer la susceptibilité du nourrisson humain aux infections par germes intracellulaires, comme en témoigne la fréquence des mycobactérioses atypiques et des salmonelloses chez des enfants atteints d’un déficit congénital de l’expression du récepteur de TIFN-y . Chez des nourrissons non atteints de déficit immunitaire congénital, un défaut de production d’IL-12 et/ou d’IFN-y a été montré en association avec des infections sévères par le virus de la rougeole, par le virus herpétique, par le vims respiratoire syncitial et par le plasmodium falciparum Des vaccins dirigés contre les agents de la tuberculose, de la malaria, du syndrome d’immunodéficience acquise, de la bronchiolite et de la rougeole, visant à activer des réponses immunes de type Thl, sont en cours de développement . Certains de ces vaccins ont démontré des résultats prometteurs au cours d’études d’immunogénicité chez l’adulte, mais ils n’ont pas été évalués chez l’enfant On sait peu de choses sur la capacité de nouveau-nés et de nourrissons humains à développer des réponses T de type mature. Un approfondissement des connaissances des fonctions immunes cellulaires des nouveau-nés et des nourrissons est nécessaire au développement de stratégies de vaccination néonatale. Dans la première partie de notre travail, mené en Gambie, nous avons utilisé les vaccins administrés à la naissance dans le cadre du programme national de 53 Proportion de porteurs chroniques Figure 10. Relation entre l'âge d'infection par le virus de l'hépatite B et le risque de devenir porteur chronique de l'antigène HBs (référence 326). vaccination comme modèles pour étudier les caractéristiques des réponses immunes cellulaires de nouveau-nés et de jeunes nourrissons. Il s’agit du vaccin vivant atténué contre la poliomyélite, du vaccin subunitaire contre l’hépatite B, et du vaccin vivant atténué contre la tuberculose, le bacille Calmette-Guérin. 1. Capacité des nouveau-nés et des nourrissons à développer des réponses immunes vaccinales de type Thl et Th2 a. Défaut de production d’IFN-y en réponse à la vaccination du nourrisson par les vaccins contre la poliomyélite et l’hépatite B La production d’IFN-y dans des surnageants de cultures cellulaires stimulées aux antigènes de virus polio a été étudiée trois semaines après la dernière dose vaccinale chez des nourrissons immunisés contre la poliomyélite à la naissance puis à 1, 2 et 3 mois de vie, et chez des adultes vaccinés dans l’enfance et ayant reçu une dose de rappel. On ne détecte pas d’IFN-y chez les nourrissons, alors qu’on en trouve chez certains adultes. Cette différence est confirmée par l’analyse de la proportion des lymphocytes circulants produisant de l’IFN-y en réponse à la stimulation par des antigènes viraux, significativement plus faible chez les nourrissons que chez les adultes. La réponse proliférative après stimulation de cellules sanguines mononucléées par des antigènes viraux est aussi plus faible chez les nourrissons que chez les adultes. Ces données suggèrent donc qu’un défaut de production d’IFN-y est associé à la vaccination en début de vie humaine. Néanmoins, au sein de notre étude, l’histoire de l’exposition aux antigènes polio chez les adultes et chez les nourrissons n’est pas identique. Ces deux groupes ne sont donc pas strictement comparables. Il n’était pas possible d’étudier la réponse au vaccin polio chez des individus adultes non immuns en Gambie, étant donné le haut taux de couverture vaccinale et la transmission environnementale du vaccin vivant. L’existence d’un défaut de génération de réponse Thl suite à la vaccination néonatale est néanmoins confirmée par nos résultats concernant les réponses immunes au vaccin 54 contre l’hépatite B. Dans ce cas-ci, les adultes ayant participé à l’étude étaient des individus n’ayant pas été vacciné préalablement et n’ayant pas été infectés par le virus de l’hépatite B, comme en témoigne l’absence d’anticorps sériques anti-HBc. Deux semaines après la dernière de trois doses de vaccin administrées à deux mois d’intervalle, nous avons observé chez le nourrisson vacciné une production d’IFN-y diminuée par rapport à celle de l’adulte, en réponse à la stimulation de cellules mononucléées par l’antigène vaccinal HBs. Il existe donc, comme chez la souris, un défaut de production d’IFN-y en réponse à certains vaccins en début de vie humaine. L’immaturité documentée de différents secteurs du système immunitaire du nouveau-né pourrait expliquer la faible capacité du nouveau-né à développer des réponses immunes de type Thl (figure 5). Néanmoins, étant donné que l’activation in vitro de lymphocytes T néonataux en présence de signaux de co-stimulation adéquats leur permet d’afficher rapidement un phénotype mature, nous pensons que le défaut de fonction des cellules présentatrices de l’antigène joue un rôle particulier dans l’observation d’un déficit de production d’IFN-y après vaccination en début de vie humaine Chez les nouveau-nés, l’immaturité de cellules dendritiques, les cellules initiatrices de la réponse immune adaptative, a été démontrée récemment. Cette immaturité se caractérise par un déficit d’expression basale de molécules de co-stimulation à la surface cellulaire, et par un défaut de maturation et une production diminuée d’IL-12 p35 en réponse au lipopolysaccharide bactérien . La stimulation de lymphocyte T par des cellules dendritiques immatures favorise chez l’adulte l’émergence de lymphocytes T producteurs d’IL-10, une cytokine capable d’inhiber le développement des réponses de type Thl Les nouveau-nés pourraient être particulièrement sensibles à ce phénomène. De même, il a été démontré que des lymphocytes de nouveau-nés porteurs de marqueurs NK et de marqueurs T, appelés lymphocytes NKT, et impliqués dans l’orientation précoce de la réponse immune grâce à leur capacité de produire des quantités importantes d’IFN-y ou d’IL-4 au moment de l’induction de la réponse primaire, sont particulièrement sensibles au phénotype des cellules dendritiques présents dans leur environnement 55 L’hypothèse d’un rôle important des cellules présentatrices de l’antigène dans l’induction de la réponse immune chez les nouveau-nés est supportée par les études démontrant chez la souris que l’induction d’une réponse de type Thl peut se faire en présence d’agents capables d’activer les fonctions de présentation de l’antigène L’analyse de la réponse au vaccin BCG néonatal supporte également cette hypothèse, et démontre que la génération d’une réponse auxiliaire productrice de quantités importantes d’IFN-y est possible dès la naissance. b. Le vaccin BCG administré à des nouveau-nés induit l’activation de lymphocytes CD4 producteurs de quantités importantes d’IFN-y Nous avons montré que le vaccin BCG néonatal induit l’activation de lymphocytes T CD4 capables de produire une quantité importante d’IFN-y après stimulation par la PPD, qui contient un grand nombre d’antigènes mycobactériens protéiques solubles. On observe des taux similaires d’IFN-y chez des nourrissons vaccinés au BCG et chez des adultes immuns. On observe également une fréquence similaire de lymphocytes circulants producteurs d’IFN-y en réponse à la PPD. L’interprétation de la comparaison des réponses à la PPD entre adultes et nouveau-nés doit se faire avec prudence, car, comme dans le cas des antigènes polio, les adultes en Gambie sont continuellement exposés à des antigènes mycobactériens, et nous ne les avons pas étudiés dans le cadre d’une immunisation primaire comme les nourrissons. Nos résultats suggèrent néanmoins que le développement d’rme réponse de type Thl à la naissance est possible. Il a été démontré que le BCG induit la production d’IL-12 et l’expression de molécules co-stimulatrices par les cellules dendritiques d’adultes Chez l’adulte, les mycobactéries sont capables d’induire une production rapide d’IFNy par des cellules NK et des lymphocytes T yô . Or, l’addition d’IFN-y exogène permet de restaurer la capacité de maturation et de production d’IL-12 par les cellules dendritiques de nouveau-nés Nous émettons l’hypothèse que les propriétés activatrices du BCG sur les cellules dendritiques et sur d’autres types cellulaires tels que les yô sont responsables de sa capacité à induire une réponse IFN-y dominante chez le nouveau-né (figure 11). Cette hypothèse pourrait être investiguée en étudiant l’effet du BCG sur la production d’IL-12 et l’expression de molécules de co- 56 Figure 1 l.Le BCG,en infectant les cellules dendritiques et en stimulant la production d'IFN-ypar les lymphocytes yô ou NK, est susceptible d'induire la production d'IL-12 et l'expression des molécules du CMH déclassé II, de CD40 et de molécule B7 parles cellules dendritiques, favorisant ainsi le développement d'une réponse de typeThl chez le nouveau-né vacciné. BCG IFN-y Cellule présentatrice de l'antigène CS) Lymphocyte A Cytokine □ Récepteur de cytokine ® CMH Cl II | CD40 Peptide antigénique | CD40 ligand Récepteur de cellule! ^ ^ CD28 stimulation par les cellules dendritiques du nouveau-né, en présence et en absence de cellules NK et de lymphocytes yô. c. Absence de biais Th2 et production d’anticorps chez les nourrissons vaccinés Dans le modèle murin, la vaccination néonatale s’accompagne généralement d’un développement préférentiel de réponse Th2 En réponse à la stimulation in vitro de cellules sanguines mononucléaires par des antigènes de virus polio vaccinal ou par la PPD, nous avons mesuré des concentrations très faibles d’IL-4, d’IL-5 et/ou d’IL-13 dans les surnageants de cultures cellulaires de nourrissons vaccinés comme d’adultes immuns. Il est difficile de comparer la production de cytokines Th2 par les nourrissons et les adultes dans ces cas, puisqu’on se situe à la limite de la sensibilité du test utilisé. Une méthode plus sensible de détection de cytokines telles que la PCR quantitative pourrait être utile pour investiguer cette question. Bien qu’elle comporte plusieurs phases de stimulations cellulaires in vitro, l’analyse clonale est également une approche sensible et représentative de la polarisation Thl/Th2 d’une réponse immune in vivo Chez des nourrissons vaccinés par le BCG à la naissance, les clones lymphocytaires spécifiques de la PPD sont de phénotype Thl et ThO. Chez des adultes immuns, un profil globalement similaire est retrouvé, et on détecte même quelques clones Th2. L’interprétation de ces données doit se faire avec prudence, car le nombre de clones analysés est assez faible. Nos observations suggèrent néanmoins l’absence de biais systématique Th2 dans les réponses vaccinales de nourrissons. Cette conclusion est supportée par l’analyse de la réponse immune au vaccin contre l’hépatite B. En réponse à l’antigène HBs, en effet, des quantités significatives et similaires de cytokines Th2 (IL-5, IL-13) ont été mesurées dans les surnageants de cultures cellulaires d’adultes et de nourrissons vaccinés. On peut s’interroger sur les mécanismes d’activation de la synthèse de quantités importantes d’anticorps dirigés contre des antigènes vaccinaux, alors qu’on ne détecte que des quantités faibles de cytokines Th2. Il est peu probable qu’il s’agisse de réponses humorales T-indépendantes. En effet, il a été démontré chez des nourrissons que quelques semaines après la vaccination contre la polio, les anticorps présents dans 57 Figure 12. Apparition des anticorps anti-poliomyélite après vaccination orale, chez le nourrisson (référence 340). 16 48 Days 64 80 96 le sérum sont majoritairement des IgG, et que des IgA sont produits au niveau mucosal, ce qui témoigne de l’existence d’une aide à la commutation isotypique provenant des lymphocytes T (figure 12). En réponse à la vaccination de nourrissons contre l’hépatite B, on observe également une production d’IgM qui ne dure que quelques jours, après quoi les IgGl, 3 et 4 sont les isotypes dominants 287 288 L’analyse de la réponse T ne nous permet à présent pas d’expliquer l’observation surprenante de la production de quantités supérieures d’anticorps chez le nourrisson, par rapport à l’adulte, en réponse aux vaccins contre la poliomyélite et contre l’hépatite B. Les réponses humorales sont généralement considérées comme étant de faible amplitude en début de vie, et des schémas précoces de vaccination induisent généralement des concentrations sériques d’anticorps d’utilisation de calendriers de vaccination plus tardifs plus faibles que lors Bien que nos observations en matière de production d’anticorps supporte le développement de stratégies de vaccinations précoces contre des infections contrôlées par l’immunité humorale, l’étude de la persistance des taux d’anticorps, des isotypes produits et de l’affinité des anticorps pour les antigènes chez les nourrissons est nécessaire à l’appréciation globale de ces résultats. Les particularités de l’aide des lymphocytes T à la synthèse des immunoglobulines en début de vie devraient être caractérisées. L’expression de récepteurs de chémokines à la surface des lymphocytes néonataux mérite d’être étudiée, étant donné leur rôle dans l’aide à la synthèse des immunoglobulines par les lymphocytes B au niveau des follicules lymphoïdes • Rôle de la voie d’administration du vaccin La voie d’administration du vaccin pourrait jouer un rôle dans les différences observées dans la capacité de nourrissons à produire de l’IFN-y après vaccination par le BCG intradermique, le vaccin oral contre la poliomyélite, et le vaccin intramusculaire contre l’hépatite B. La présence au niveau du derme de cellules présentatrices de l’antigène professionnelles, les cellules de Langerhans, pourrait être un élément déterminant de l’immunogénicité du BCG La production d’IFN-y après vaccination sous-cutanée par le BCG est effectivement moindre que celle retrouvée après vaccination intradermique Des études récentes de vaccins à l’ADN ont montré l’avantage de la vaccination intradermique par rapport à la 58 vaccination sous-cutanée, et ont donné lieu au développement de revolvers permettant la délivrance intradermique d’un grand nombre de particules vaccinales . Dans le modèle murin, la voie dermique ne permet pas l’induction de tolérance néonatale aux alloantigènes Dans le cas de la vaccination orale contre la poliomyélite, la rate joue probablement un rôle important dans la présentation antigénique, puisque le virus se retrouve dans la circulation sanguine après vaccination Chez les souriceaux, il a été observé que la rate est un organe de développement préférentiel de réponses Th2, ceci semblant être dû au rôle prédominant de lymphocytes B par rapport aux cellules dendritiques dans la présentation antigénique Les organes lymphoïdes associés aux muqueuses sont aussi susceptibles de jouer un rôle important après vaccination entérique. Or, l’exposition orale aux allergènes environnementaux en début de vie s’accompagne d’un développement de réponse Th2 par défaut réponses Th2 suite à l’exposition entérique Bien que l’établissement de à certains antigènes semble particulièrement marqué en période infantile, des phénomènes similaires semblent exister chez l’adulte. Ainsi, l’exposition orale aux mycobactéries peut inhiber la réaction d’hypersensibilité retardée à la tuberculine induite par la vaccination par le BCG chez des adultes La vaccination entérique n’en demeure pas moins une voie privilégiée pour les stratégies de vaccination en début de vie, en raison du côté peu invasif et non douloureux de la procédure vaccinale. Les connaissances concernant les réponses immunes cellulaires infantiles demeurent limitées. Les caractéristiques de l’expansion de cellules effectrices, la génération de lymphocytes mémoires, la persistance de la réponse, le trafic tissulaire des populations cellulaires effectrices seront des questions essentielles à investiguer. La capacité de nouveau-nés à générer une réponse vaccinale cytotoxique devra également être étudiée. Le rôle de lymphocytes T régulateurs en début de vie devra être caractérisé. Il sera aussi intéressant d’étudier, chez l’homme, l’existence d’une compartimentalisation anatomique des voies de différenciation des lymphocytes T auxiliaires. 59 2. L’administration précoce du BCG peut moduler le développement de réponses immunes adaptatives à d’autres antigènes Après avoir démontré que le BCG a la particularité d’induire une réponse de type Thl à la naissance, nous avons observé qu’il peut également promouvoir la réponse cellulaire et humorale à d’autres vaccins administrés durant la petite enfance. Quels peuvent en être les mécanismes ? On n’observe pas de modulation des réponses a la phytohaemagglutinine, un mitogène activant non spécifiquement les lymphocytes. L’effet du BCG porte exclusivement sur les réponses spécifiques de l’antigène aux autres vaccins. Ceci supporte l’hypothèse d’un effet du BCG sur les conditions de présentation de l’antigène plutôt que directement sur les lymphocytes T. Il a été démontré chez l’animal que la vaccination par le BCG induit dans le ganglion régional une augmentation de la quantité totale d’IFN-y, d’IL-12 et d’IL-18 produit, ainsi que le recrutement d’un grand nombre de cellules dendritiques dans différentes régions du ganglion ^97,298 imaginer que ces facteurs pro­ inflammatoires affectent le développement des autres réponses immunes initiées dans le même ganglion, après l’injection du BCG et d’un autre vaccin dans le même bras. De manière surprenante, nous avons aussi observé que l’administration du BCG à l’âge de deux mois promeut la production d’anticorps neutralisants anti-polio. Etant donné la virémie induite par la vaccination anti-poliomyélite, la rate joue sans doute un rôle dans la réaction immune primaire suite à la vaccination . Nos observations suggèrent donc que le BCG est capable d’un effet immunomodulateur à distance. La nature des facteurs immunostimulants liés au BCG au niveau du ganglion aussi bien qu’au niveau systémique sont inconnus. Une dissémination du BCG vers des organes lymphoïdes situés à distance est possible, par voie vasculaire, en situation extra- ou intracellulaire dans une cellule phagocytaire. Des autopsies faites sur des nourrissons ayant été vaccinés par le BCG à la naissance ont effectivement démontré la présence de granulomes tuberculoïdes et de BCG dans le foie, la rate, la moelle osseuse Dans ces localisations, le BCG pourrait activer des processus inflammatoires capables de moduler le développement de réactions immunes en cours. Les succès de l’immunothérapie de cancers par l’instillation de BCG en sont 60 peut-être ime illustration Par ailleurs, des molécules produites par le BCG pourraient se retrouver dans la circulation et moduler des réponses immunes à distance. Il a en effet été démontré que l’infection de cellules dendritiques par le BCG n’est pas indispensable pour induire une augmentation de l’expression de molécules de co-stimulation et la production de cytokines pro-inflammatoires : des éléments de la paroi du BCG produisent le même effet La présence dans le sang de facteurs mycobactériens solubles aux propriétés immunostimulantes n’a néanmoins jamais été démontrée. L’immunomodulation liée au BCG pourrait aussi résulter de la production systémique de facteurs endogènes lors de la vaccination. Ces facteurs pourraient servir de signaux d’appel à distance, capables d’activer le système immunitaire, et de moduler la génération de réponses immunes adaptatives en cours. Il pourrait s’agir de cytokines pro-inflammatoires, de protéines de la phase aiguë ou de protéines de choc thermique. On peut trouver surprenant que le BCG promeuve la production de cjdokines de type Th2 et les réponses humorales à d’autres vaccins. Il faut néanmoins se rappeler que si le BCG induit la production de quantités importantes d’IFN-y par des lymphocytes CD4 activés, l’analyse clonale démontre que des lymphocytes ThO voire Th2 sont aussi présents. De même, bien que leur rôle dans la protection contre la tuberculose demeure peu connu, des anticorps dirigés contre les antigènes mycobactériens sont retrouvés chez des individus infectés par Mycobacterium tuberculosis ou vaccinés par le BCG Il serait inexact d’opposer réponse Thl à réponse humorale. L’IFN-y peut participer à l’induction de commutation isotypique, et l’expression du CD40L à la surface des lymphocytes T est essentielle aussi bien lors de la régulation de la réponse T que dans l’interaction avec le lymphocyte B Il est possible que la promotion des réponses Th2 et humorales par le BCG soit spécifique des premiers mois de vie. Il a néanmoins été démontré dans des modèles animaux adultes que la vaccination par le BCG ou d’autres infections sont capables d’induire tme déviation immune ou une rupture de tolérance De même, l’induction de la production d’IFN-y par un vaccin expérimental comprenant le BCG permet d’influencer le décours d’une infection ultérieure à T. cruzi chez des souris adultes L’influence de l’âge sur les effets modulateurs du BCG sur les réponses à 61 Table 4. Vaccins en développement susceptibles de présenter des qualités particulières pour être utilisés en début de vie. Avantages Type de vaccin Vaccin vivant recombinant Persistance dans l’hôte, protection longue, nombre de doses réduit BCG Thl, CTL, anticorps ? Poxvirus Thl, CTL, anticorps Salmonella, autres Immunité muqueuse Vaccin inerte Production standardisée, pas de maladie vaccinale, non transmissible Vaccins subunitaires + adjuvants Th 1, anticorps Formulations particulières* Th 1, anticorps Vaccins au DNA Thl, CTL, anticorps * Permettent de faciliter le passage de l’antigène vers des voies d’activation de l’immunité cellulaire. Inconvénients Maladie vaccinale, production, distribution Réactogénicité variable Risque d’intégration ? auto-immunité ? d’autres antigènes devra être recherchée. Par ailleurs, la persistance de l’effet modulateur du BCG sur les réponses aux autres antigènes devrait être investiguée. 3. Vers de nouvelles indications cliniques du BCG ? Les propriétés modulatrices du BCG sur les réponses aux autres antigènes pourraient avoir des implications cliniques. Une étude récente en Guinée-Bissau suggère en effet que la vaccination par le BCG s’accompagne d’une réduction de mortalité qui n’est pas expliquée par la prévention de la tuberculose Dans le même environnement, un effet protecteur du BCG contre le développement d’atopie a été rapporté . Notre observation concernant la promotion des réponses vaccinales en Gambie supporte la continuation de la vaccination néonatale par le BCG en pays en voie de développement. D’autres composés dotés de propriétés immunostimulatrices en début de vie pourraient être recherchés. Ces composés pourraient être utilisés comme adjuvants au cours de vaccinations ou viser à diminuer la sensibilité aux infections intra- ou extra-cellulaires en stimulant les réponses de type Thl et les réponses humorales. La toxicité potentielle d’immunothérapies impose néanmoins une grande prudence dans l’administration au nourrisson de molécules immunostimulatrices à but thérapeutique Le BCG pourrait également connaître de nouvelles indications comme vaccin vecteur recombinant, exprimant des antigènes non mycobactériens. Divers types de vaccins susceptibles de générer des réponses immunes cellulaires vigoureuses sont en cours de développement . La table 4 reprend les propriétés générales de vaccins vivants, tués et de vaccins à l’ADN, différents vaccins susceptibles de présenter des avantages en période néonatale. Des résultats encourageants ont été obtenus chez l’adulte, mais, à part le BCG, des vaccins connus pour leurs propriétés activatrices de l’immunité cellulaire n’ont pas été étudiés en début de vie. En table 5, on peut voir les propriétés souhaitables des vaccins à administrer en début de vie. Cette liste résume l’ensemble des qualités qu’on peut être en mesure d’espérer, mais il y a des spécificités en fonction des différents pathogènes. La table 6 présente le type d’immunité qui devrait être générée pour le contrôle de quelques-unes des grandes maladies contre lesquels un vaccin en début de vie est nécessaire. Nos observations démontrent que le BCG, 62 Table 5. Objectifs de vaccins futurs pour la période néonatale. 1. Induction rapide d’anticorps (isotypes appropriés) 2. Induction rapide de réponses ThI et CTL 3. Induction d’immunité mémoire 4. Absence d’inhibition par les anticorps maternels 5. Peu d’effets secondaires (douleur, fièvre, maladie vaccinale, cicatrice, auto-immunité) 6. Compatibilité d’administration avec les autres vaccins 7. Aspects logistiques : coûts limités, bonne stabilité, acceptabilité Table 6. Maladies infantiles importantes qui pourraient être contrôlées par de nouveaux vaccins administrés précocement. Pathogène Type d’immunité souhaitée Malaria Thl, CTL, anticorps Rotavims, autres entéropathogènes Anticorps, immunité muqueuse Virus respiratoire syncitial Anticorps, immunité muqueuse, Thl, CTL Rougeole Anticorps, Thl, CTL Tuberculose Thl, CTL HIV CTL, anticorps Allergie Thl grâce à ses propriétés adjuvantes et au fait que son administration au nouveau-né est déjà pratiquée, pourrait être un vecteur vaccinal intéressant en début de vie. 4. Modulation du système immunitaire inné du nouveau-né par une infection chronique maternelle L’étude que nous avons menée en Bolivie montre qu’une infection maternelle peut affecter le développement du système immunitaire inné in utero. Nous avons en effet observé que l’infection maternelle à T. cruzi induit chez des nourrissons non infectés une capacité accrue à produire des cytokines monocytaires pro- (IL-ip, IL-6, TNF-a) et anti- (IL-10, sTNFRl, sTNFR2) inflammatoires en réponse à un lysat parasitaire. Le mécanisme par lequel se fait la modulation du système monocytaire du nouveau-né n’est pas élucidé. Un rôle des anticorps maternels spécifiques d’antigènes de T. cruzi et qui peuvent lier les récepteurs de fragments Fc des immunoglobulines à la surface des monocytes du nouveau-né est possible Néanmoins, une synthèse accrue d’IL- ip et d’IL-6 en réponse à la stimulation par un mélange de lipopolysaccharide bactérien et de phytohaemagglutinine démontre que l’activation du système monocytaire-macrophagique des nourrissons n’est pas exclusivement spécifique de l’antigène. Un passage transplacentaire de molécules immunomodulatrices qui agiraient sur les monocytes fœtaux est donc probable. De telles molécules sont produites par T. cruzi, mais leur passage transplacentaire n’a pas été démontré Il serait intéressant de définir le rôle de cette activation du système monocytaire fœtal dans le cadre de l’infection congénitale à T. cruzi. La phase aiguë de la maladie de Chagas, caractérisée par une parasitémie élevée, est principalement contrôlée par les fonctions bactéricides des monocytes/macrophages activés Bien que l’infection congénitale survienne dans 2 à 12% des grossesses de femmes infectées, l’activation du système monocytaire pourrait contribuer à empêcher la transmission verticale du parasite chez la majorité restante . L’effet de l’infection maternelle sur la capacité de monocytes de nouveau-nés à tuer des parasites intracellulaires et à présenter des antigènes parasitaires pourrait être étudié. 63 L’effet de l’infection maternelle sur le contrôle de l’infection non pas congénitale mais posmatale, par le vecteur, plus tard en cours de vie, est également incoruiu. Pour que l’infection maternelle ait des conséquences durables sur la capacité de l’individu à contrôler une infection à T. cruzi, une modulation des réponses lymphocytaires, dotées de mémoire immunologique, est sans doute nécessaire. Nous n’avons détecté de cytokines lymphocytaires dans le surnageant de cellules sanguines stimulées par un lysat parasitaire que chez une faible proportion de nouveau-nés de mères infectées par T. cruzi. La stimulation de cellules sanguines par un lysat parasitaire permet sans doute la détection de réponses CD4, mais on ne peut exclure l’activation d’une réponse CD8 non détectée, car les antigènes ne sont pas présentés par les molécules HLA de classe I dans ces conditions de stimulation. Il conviendrait de rechercher au moyen d’autres méthodes l’activation in utero de lymphocytes CD8 spécifiques de T. cruzi. Si l’activation de lymphocytes CD4 et/ou CD8 par l’infection maternelle se confirme par l’étude d’un plus grand nombre d’individus au moyen de méthodes sensibles de détection de ces réponses, et que leur persistance est démontrée, un effet protecteur ou aggravant sur une infection post-natale devrait être recherché. Etant donné la composante non spécifique de l’antigène de l’activation de la production de cytokines monocytaires, on peut s’interroger sur le rôle que l’infection maternelle à T. cruzi peut jouer dans la capacité du nourrisson à répondre à d’autres stimulations immunitaires en début de vie. Il serait intéressant, d’une part, d’étudier les fonctions de présentation de l’antigène des monocytes, macrophages et cellules dendritiques de nouveau-nés et d’enfants plus âgés nés de mères infectées. D’autre part, cette question pourrait être investiguée par l’étude du rôle de l’infection maternelle à T. cruzi sur le développement de la réponse immune aux différents vaccins de la petite enfance et sur le développement d’allergies. 5. Obstacles aux développements de la vaccinologie néonatale Par notre travail, nous espérons avoir contribué à mieux définir les particularités du système immunitaire du nouveau-né humain. Nous avons identifié des facteurs prénataux et post-nataux susceptibles d’influencer le développement des réponses immunes du nourrisson. Ceci, dans l’espoir d’améliorer les connaissances des conditions permettant d’induire précocement des réponses immunes protectrices 64 contre des maladies infectieuses dévastatrices, surtout en pays en voie de développement, là où le travail présenté ici a été mené. Bien que l’importance de développer des stratégies de vaccination précoce soit reconnue, de nombreux obstacles s’opposent encore à leur développement On observe actuellement en pays ^ 1 fi industrialisés un souci croissant bien compréhensible d’éviter les réactions non désirables liés aux vaccins. Or, les particularités du système immunitaire du nouveau-né pourraient s’accompagner d’une susceptibilité augmentée à certains effets secondaires liés à la vaccination. Les risques d’effets secondaires justifient le remplacement du vaccin vivant atténué contre la poliomyélite par le vaccin inactivé, et du vaccin cellulaire contre la coqueluche par le vaccin acellulaire, dans les pays industrialisés Le vaccin contre le rotavirus mis sur le marché aux Etats-Unis a été retiré ensuite à cause d’un risque d’intussusception intestinale Un lien entre la vaccination du nourrisson contre l’hépatite B, contre la rougeole et contre VHaemophilius influenzae de type b et le développement sclérose en plaque, d’autisme et de diabète a été suggéré, mais jamais démontré ' . Les risques d’effets secondaires sont à considérer dans le développement de vaccins futurs également. Dans le cas de l’utilisation de vaccins à l’ADN, il existe un risque théorique mais non démontré de développement de maladies auto-immunes ou de cancers secondaires à l’intégration de l’ADN au sein du génome de cellules de l’individu vacciné. La cicatrice inélégante induite par un BCG recombinant ou par certains vaccins pox pourrait également limiter leur acceptation. En l’absence de démonstration d’effets négatifs l’emportant sur les effets positifs de la vaccination, la vaccination doit néanmoins demeurer un geste civique rendu à la collectivité, une participation personnelle aux efforts de contrôle des maladies infectieuses à l’échelle planétaire, en plus du but de protection individuelle. En pays en voie de développement, l’épidémiologie des infections impose parfois de reconsidérer la balance entre effets bénéfiques et effets secondaires. La transmission environnementale du vaccin vivant contre la poliomyélite, augmentant les taux de couverture vaccinale, impose d’y continuer son administration ^17 . Les effets du vaccin contre le rotavirus mériteraient d’y être étudiés, car le bénéfice lié à un contrôle de la diarrhée pourrait dépasser de loin le risque lié à l’intussusception 65 La crainte d’effets secondaires complique le développement d’initiatives d’études de la vaccination en début de vie. Des questions importantes et non résolues concernent les conditions et l’endroit du passage des études d’immunogénicité chez l’adulte aux études en début de vie Dans bien des pays développés, le principe de la prise de sang chez des enfants sains uniquement à but de recherches est mal accepté. Dans les pays en voie de développement, on voit d’un mauvais œil l’étude de vaccins potentiellement toxiques sur une population qui risque de ne pas bénéficier des résultats des études, pour des raisons économiques. L’étude de l’âge optimal de vaccination par des vaccins existants pourrait se faire dans les pays où les recommandations actuelles ne permettent pas un contrôle satisfaisant de la maladie. Ainsi, l’immunogénicité et l’efficacité clinique de schémas de vaccination précoces comportant une dose à la naissance méritent d’être étudiés en pays en voie de développement dans le cas des vaccins conjugués contre le pneumocoque, VHaemophilius influenzae de type b, le méningocoque, la coqueluche, la diphtérie, la rougeole. Pour éviter de menacer l’immunogénicité à long terme de tels schémas, une dose tardive additionnelle pourrait être administrée. Pour l’étude de nouveaux vaccins, formulations, adjuvants, il faudra planifier des études en partenariat entre institutions de pays en voie de développement et pays industrialisés. Les études d’immunogénicité et de toxicité devraient prendre place aussi bien dans un pays en voie de développement que dans un pays industrialisé, alors que les études d’efficacité pourraient évoluer indépendamment. Des partenariats entre membres d’institutions scientifiques, gouvernements, institutions internationales, mécènes et compagnies privées de production de vaccins devraient définir précocement le cadre de recherche, de production et de distribution des vaccins. Ce cadre doit permettre d’assurer un accès aux vaccins dans les régions les plus touchées et garantir la stabilité économique aux investisseurs financiers. Les considérations éthiques concernant ces études doivent être évaluées notamment par des représentants des gouvernements ainsi que des membres de la société civile des pays où ces études ont lieu. 66 BIBLIOGRAPHIE 67 1. Henderson,R. Vaccination and world health. Wiley,J.a.S. (ed.) (John Wiley & Sons, Chichester, England,1995). 2. Miller,M.A. & Hinman,A.R. Vaccines. Plotkin,S.A. & Orenstein,W.A. (eds.), pp. 1074-1088 (W.B. Saunders, Philadelphia, 1999). 3. Cutts,F.T. & 01ivé,J.-M. Vaccines. Plotkin,S.A. & Orenstein,W.A. (eds.), pp. 1047-1073 (W. B. Saunders, Philadelphia USA, 1999). 4. WHO Maternai and safe motherhood program. MSM 96.7, (1995). 5. Murray,C.J. & Lopez,A.D. Global mortality, disability, and the contribution of risk factors: Global Burden of Disease Study. Lancet 349,1436-1442 (1997). 6. Murray,C.J. & Lopez,A.D. Mortality by cause for eight régions of the world: Global Burden of Disease Study. Lancet 349,1269-1276 (1997). 7. Bisgard,K.M. et al. Haemophilus influenzae invasive disease in the United States, 1994-1995: near disappearance of a vaccine-preventable childhood disease. Emerg. Infect. Dis. 4, 229-237 (1998). 8. Bisgard,K.M. et al. Respiratory diphtheria in the United States, 1980 through 1995. Am. J. Public Health 88, 787-791 (1998). 9. Siegrist,C.A. Vaccination in the néonatal period and early infancy. Int. Rev. Immunol. 19, 195219(2000). 10. Weijer,C. The future of research into rotavirus vaccine. BMJ 321, 525-526 (2000). 11. Raviglione,M.C., Snider,D.E. & Kochi,A. Global epidemiology of tuberculosis. Morbidity and mortality of a worldwide épidémie. JAMA 273,220-226 (1995). 12. YusufH.R., Daniels,D., Smith,P., Coronado,V. & Rodewald,L. Association between administration of hepatitis B vaccine at birth and completion of the hepatitis B and 4:3:1:3 vaccine sériés. JAMA 284, 978-983 (2000). 13. Muthukkumar,S., Goldstein,). & Stein,K.E. The ability of B cells and dendritic cells to présent antigen increases during ontogeny. J. Immunol. 165, 4803-4813 (2000). 14. Hayward,A.R., Herberger,M.J., Groothuis,J. & Levin,M.R. Spécifie immunity aller congénital or néonatal infection with cytomégalovirus or herpes simplex virus. J. Immunol. 133, 2469-2473 (1984). 15. Chihnonczyk,B.A., Levin,M.J., McDufïy,R. & Hayward,A.R. Characterization of the human newbom response to herpesvirus antigen. J. Immunol. 134,4184-4188 (1985). 16. Hunt,D.W., Huppertz,H.I., Jiang,H.J. & Petty,R.E. Studies of human cord blood dendritic cells: evidence for functional immaturity. Blood 84,4333-4343 (1994). 17. Petty,R.E. & Hunt,D.W. Néonatal dendritic cells. Vaccine 16, 1378-1382 (1998). 18. Goriely,S. et al. Déficient IL-12(p35) gene expression by dendritic cells derived fi"om néonatal monocytes. J. Immunol. 166, 2141-2146 (2001). 19. Lee,S.M. et al. Decreased interleukin-12 (IL-12) from activated cord versus adult peripheral blood mononuclear cells and upregulation of interferon-gamma, natural killer, and lymphokineactivated killer activity by IL-12 in cord blood mononuclear cells. Blood 88, 945-954 (1996). 68 20. QianJ.X. et al. Decreased interleukin-15 from activated cord versus adult peripheral blood mononuclear cells and the effect of interleukin-15 in upregulating antitumor immune activity and cytokine production in cord blood. Blood 90, 3106-3117 (1997). 21. De Wolf-Peeters,C., Van der Steen,K., Moerman,?., Desmet,V. & Drijkoningen,M. Epidermal Langerhans' cells and dermal dendritic cells in human fêtai and néonatal skin; an immunohistochemical study. Pediatr Dermatol 4, 11-17 (1987). 22. Nelson,D.J., McMenamin,C., McWilliam,A.S., Brenan,M. & Holt,P.G. Development of the airway intraepithélial dendritic cell network in the rat from class II major histocompatibility (la)negative precursors: differential régulation of la expression at different levels of the respiratory tract. J. Exp. Med. 179,203-212 (1994). 23. Nelson,D.J. & Holt,P.G. Defective régional immunity in the respiratory tract of neonates is attributable to hyporesponsiveness of local dendritic cells to activation signais. J. Immunol. 155, 3517-3524(1995). 24. Garvy,B.A. & Qureshi,M.H. Delayed inflammatory response to Pneumocystis carinii infection in néonatal mice is due to an inadéquate lung enviromnent. J. Immunol. 165,6480-6486 (2000). 25. Lu,C.Y., Calamai,E.G. & Unanue,E.R. A defect in the antigen-presenting function of macrophages from néonatal mice. Nature 282, 327-329 (1979). 26. Wilson,C.B. Immunologie basis for increased susceptibility of the neonate to infection. J. Pediatr. 108, 1-12 (1986). 27. Lewis,D.B., Larsen,A. & Wilson,C.B. Reduced interferon-gamma mRNA levels in human neonates. Evidence for an intrinsic T cell deficiency independent of other genes involved in T cell activation. J. Exp. Med. 163, 1018-1023 (1986). 28. Bryson,Y.J., Winter,H.S., Gard,S.E., Fischer,T.J. & Stiehm,E.R. Deficiency of immune interferon production by leukocytes of normal newboms. Cell Immunol. 55, 191-200 (1980). 29. Wakasugi,N. & Virelizier,J.L. Defective IFN-gamma production in the human neonate. I. Dysrégulation rather than intrinsic abnormality. J. Immunol. 134, 167-171 (1985). 30. Wakasugi,N. et al. Defective IFN-gamma production in the human neonate. ü. Rôle of increased sensitivity to the suppressive effects of prostaglandin E. J. Immunol. 134, 172-176 (1985). 31. Lewis,D.B. et al. Cellular and molecular mechanisms for reduced interleukin 4 and interferongamma production by néonatal T cells. J. Clin. Invest 87,194-202 (1991). 32. Bertotto,A. et al. Activation of cord T lymphocytes. 11. Cellular and molecular analysis of the defective response induced by anti-CD3 monoclonal antibody. Cell Immunol. 127, 247-259 (1990). 33. Takahashi,N., Imanishi,K., Nishida,H. & Uchiyama,T. Evidence for immunologie immaturity of cord blood T cells. Cord blood T cells are susceptible to tolérance induction to in vitro stimulation with a superantigen. J. Immunol. 155, 5213-5219 (1995). 34. Adkins,B. & Hamilton,K. Freshly isolated, murine néonatal T cells produce IL-4 in response to anti-CD3 stimulation. J. Immunol. 149,3448-3455 (1992). 35. Taylor,S. & Bryson,Y.J. Impaired production of gamma-interferon by newbom cells in vitro is due to a functionally immature macrophage. J. Immunol. 134, 1493-1497 (1985). 36. Adkins,B. T-cell function in newbom mice and humans. Immunol. Today 20, 330-335 (1999). 69 37. Early,E.M. & Reen,D.J. Antigen-independent responsiveness to interleukin-4 demonstrates differential régulation of newbom human T cells. Eur. J. Immunol. 26, 2885-2889 (1996). 38. Hassan,!., 0746111,8., 0'Neill,L.A., Pattison,U. & Reen,D.J. Signalling via CD28 of human naive néonatal T lymphocytes. Clin. Exp. Immunol. 102, 192-198 (1995). 39. Adkins,B., Ghanei,A. & Hamilton,K. Up-regulation of murine néonatal T helper cell responses by accessory cell factors. J. Immunol. 153, 3378-3385 (1994). 40. Katamura,K. et al. Sélective induction of interleukin-4- and interferon-y-producing T cells ffom cord blood naive T cells. Effects of costimulatory signaling through CD28. Int. Arch. Allergy Immunol. 106, 101-106(1995). 41. Yang,L.P., Byun,D.G., Demeure,C.E., Vezzio,N. & Delespesse,G. Default development of cloned human naive CD4 T cells into interleukin-4- and interleukin-5- producing effector cells. Eur. J. Immunol. 25, 3517-3520 (1995). 42. Wu,C.Y., Demeure,C., Kiniwa,M., Gately,M. & Delespesse,G. IL-12 induces the production of IFN-gamma by néonatal human CD4 T cells. J. Immunol 151, 1938-1949 (1993). 43. Pirenne,H. et al. Comparison of T cell functional changes during childhood with the ontogeny of CDw29 and CD45RA expression on CD4+ T cells. Pediatr. Res. 32, 81-86 (1992). 44. Fadel,S. & Sarzotti,M. Cellular immune responses in neonates. Int. Rev. Immunol. 19, 173-193 (2000). 45. Matthews,N.C., Wadhwa,M., Bird,C., Borras,F.E. & Navarrete,C.V. Sustained expression of CD 154 (CD40L) and proinflammatory cytokine production by alloantigen-stimulated umbilical cord blood T cells. J. Immunol. 164, 6206-6212 (2000). 46. Fuleihan,R., Ahem,D. & Geha,R.S. Decreased expression of the ligand for CD40 in newbom lymphocytes. Eur. J. Immunol. 24, 1925-1928 (1994). 47. Nonoyama,S. et al. Diminished expression of CD40 ligand by activated néonatal T cells. J. Clin. Invest 95, 66-75 (1995). 48. Durandy,A. et al. Undetectable CD40 ligand expression on T cells and low B cell responses to CD40 binding agonists in human newboms. J. Immunol 154, 1560-1568 (1995). 49. Bofill,M. et al. Immature CD45RA(low)RO(low) T cells in the human cord blood. I. Antécédents of CD45RA+ unprimed T cells. J. Immunol 152, 5613-5623 (1994). 50. Hassan,!. & Reen,D.!. Néonatal CD4+ CD45RA+ T cells: precursors of adult CD4+ CD45RA+ T cells? Res. Immunol 144, 87-92 (1993). 51. Varas,A. et al. Analysis of the human néonatal thymus: evidence for a transient thymie involution. J. Immunol. 164, 6260-6267 (2000). 52. Shu,U. et al. Interleukin 12 exerts a differential effect on the maturation of néonatal and adult human CD45R0- CD4 T cells. J. Clin. Invest 94, 1352-1358 (1994). 53. Billingham,R.E., Brent,L. & Medawar,P.B. Nature 172, 603 (1953). 54. Gammon,G. et al. Néonatal T-cell tolérance to minimal immunogenic peptides is caused by clonal inactivation. Nature 319,413-415 (1986). 55. Schurmans,S. et al. In vivo effects of anti-IL-4 monoclonal antibody on néonatal induction of tolérance and on an associated autoimmune syndrome. J. Immunol 145, 2465-2473 (1990). 70 56. Donckier,V. et al. Critical rôle of interleukin 4 in the induction of néonatal transplantation tolérance. Transplantation 59,1571-1576 (1995). 57. Abramowicz,D. et al. Néonatal induction of transplantation tolérance in mice is associated with in vivo expression of IL-4 and -10 mRNAs. Transplant. Proc. 25, 312-313 (1993). 58. Donckier,V. et al. IFN-ganuna prevents Th2 cell-mediated pathology after néonatal injection of semiallogenic spleen cells in mice. J. Immunol. 153, 2361-2368 (1994). 59. Donckier,V. et al. IL-12 prevents néonatal induction of transplantation tolérance in mice. Eur. J. Immunol. 28, 1426-1430 (1998). 60. Flamand,V. et al. CD40 ligation prevents néonatal induction of transplantation tolérance. J. Immunol. 160,4666-4669(1998). 61. Ridge,J.P., Fuchs,E.J. & Matzinger,P. Néonatal tolérance revisited: tuming on newbom T cells with dendritic cells. Science 271,1723-1726 (1996). 62. Alferink,J. et al. Control of néonatal tolérance to tissue antigens by peripheral T cell trafficking. Science 2S2, 1338-1341 (1998). 63. Rocha,V. et al. Comparison of outcomes of unrelated bone marrow and umbilical cord blood transplants in children with acute leukemia. Blood 97,2962-2971 (2001). 64. Vietor,H.E. et al. Intrauterine transfusions affect fêtai T-cell immunity. Blood 90, 2492-2501 (1997). 65. Siegrist,C. Néonatal and early life vaccinology. Vaccine 19, 3331-3346 (2001). 66. Barrios,C. et al. Néonatal and early life immune responses to varions forms of vaccine antigens qualitatively differ from adult responses: prédominance of a Th2-biased pattern which persists after adult boosting. Eur. J. Immunol. 26, 1489-1496 (1996). 67. Adkins,B. & Du,R.Q. Newbom mice develop balanced Thl/Th2 primary effector responses in vivo but are biased to Th2 secondary responses. J. Immunol. 160,4217-4224 (1998). 68. Martinez,X. et al. DNA immunization circumvents déficient induction of T helper type 1 and cytotoxic T lymphocyte responses in neonates and during early life. Proc. Natl. Acad. Sci. U. S. A 94, 8726-8731 (1997). 69. Bot,A., Antohi,S., Bot,S., Garcia-Sastre,A. & Bona,C. Induction of humoral and cellular immunity against influenza vims by immunization of newbom mice with a plasmid bearing a hemagglutinin gene. Int. Immunol. 9,1641-1650 (1997). 70. Bot,A., Bot,S. & Bona,C. Enhanced protection against influenza vims of mice immunized as newboms with a mixture of plasmids expressing hemagglutinin and nucleoprotein. Vaccine 16, 1675-1682 (1998). 71. Min,B. et al. Differential control of néonatal tolereince by antigen dose versus extended exposure and adjuvant. Cell Immunol. 200,45-55 (2000). 72. Min,B., Legge,K.L., Pack,C. & Zaghouani,H. Néonatal exposure to a self-peptideimmunoglobulin chimera circumvents the use of adjuvant and confers résistance to autoimmune disease by a novel mechanism involving interleukin 4 lymph node déviation and interferon gamma-mediated splenic anergy. J. Exp. Med. 188, 2007-2017 (1998). 73. Singh,R.R., Hahn,B.H. & Sercarz,E.E. Néonatal peptide exposure can prime T cells and, upon subséquent immunization, induce their immune déviation: implications for antibody vs. T cellmediated autoimmunity. y. Exp. Med. 183, 1613-1621 (1996). 71 74. KovarikJ. et al. CpG oligodeoxynucleotides can circumvent the Th2 polarization of néonatal responses to vaccines but may fail to fully redirect Th2 responses established by néonatal priming. J. Immunol. 162, 1611-1617 (1999). 75. Bot,A., Bot,S., Garcia-Sastre,A. & Bona,C. DNA immunization of newbom mice with a plasmid-expressing nucleoprotein of influenza virus. Viral Immunol. 9, 207-210 (1996). 76. Bot,A., Bot,S., Garcia-Sastre,A. & Bona,C. Protective cellular immunity against influenza virus induced by plasmid inoculation of newbom mice. Dev. Immunol. 5,197-210 (1998). 77. Hassett,D.E., Zhang,J. & Whitton,J.L. Néonatal DNA immunization with a plasmid encoding an internai viral protein is effective in the presence of maternai antibodies and protects against subséquent viral challenge. J. Virol. 71, 7881-7888 (1997). 78. Manickan,E., Yu,Z. & Rouse,B.T. DNA immunization of neonates induces immunity despite the presence of maternai antibody. y. Clin. Invest 100,2371-2375 (1997). 79. Hassett,D.E., Zhang,J., Slifka,M. & Whitton,J.L. Immune responses following néonatal DNA vaccination are long-lived, abundant, and qualitatively similar to those induced by conventional immunization. J. Virol. 74, 2620-2627 (2000). 80. Martinez,X. et al. Combining DNA and protein vaccines for early life immunization against respiratory syncytial vims in mice. Eur. J. Immunol. 29,3390-3400 (1999). 81. Gerdts,V., Babiuk,L.A., van Drunen Littel-van den Hurk & Griebel,P.J. Fêtai immunization by a DNA vaccine delivered into the oral cavity. Nat. Med. 6,929-932 (2000). 82. Butts,C., Zubkoff,!., Robbins,D.S., Cao,S. & Sarzotti,M. DNA immunization of infants: potential and limitations. Vaccine 16, 1444-1449 (1998). 83. Bot,A. DNA vaccination and the immune responsiveness of neonates. Int. Rev. Immunol. 19, 221-245 (2000). 84. Brazolot Millan,C.L., Weeratna,R., Krieg,A.M., Siegrist,C.A. & Davis,H.L. CpG DNA can induce strong Thl humoral and cell-mediated immune responses against hepatitis B surface antigen in young mice. Proc. Natl. Acad. Sci. U. S. A 95, 15553-15558 (1998). 85. Chelvarajan,R.L. et al. CpG oligodeoxynucleotides overcome the unresponsiveness of néonatal B cells to stimulation with the thymus-independent stimuli anti-IgM and TNP-Ficoll. Eur. J. Immunol 29, 2808-2818 (1999). 86. Mor,G. et al Induction of néonatal tolérance by plasmid DNA vaccination of mice. J. Clin. Invest 98,2700-2705 (1996). 87. Arulanandam,B.P., Van Cleave,V.H. & Metzger,D.W. IL-12 is a potent néonatal vaccine adjuvant. Eur. J. Immunol. 29,256-264 (1999). 88. Arulanandam,B.P., Mittler,J.N., Lee,W.T., 0'Toole,M. & Metzger,D.W. Néonatal administration of IL-12 enhances the protective efficacy of antiviral vaccines. J. Immunol. 164, 3698-3704 (2000). 89. Kovarik,J. et al Limitations of in vivo IL-12 supplémentation strategies to induce Thl early life responses to model viral and bacterial vaccine antigens. Virology 268, 122-131 (2000). 90. Barrios,C., Brandt,C., Bemey,M., Lambert,P.H. & Siegrist,C.A. Partial correction of the TH2/TH1 imbalance in néonatal murine responses to vaccine antigens through sélective adjuvant effects. Eur. J. Immunol. 26, 2666-2670 (1996). 72 91. KovarikJ. & Siegrist,C.A. Optimization of vaccine responses in early life: the rôle of delivery Systems and immunomodulators. Immunol. Cell Biol. 76,222-236 (1998). 92. Siegrist,C.A. et al. Protective efficacy against respiratory syncytial virus following murine néonatal immunization with BBG2Na vaccine: influence of adjuvants and maternai antibodies. J. Infect. Dis. 179,1326-1333 (1999). 93. Siegrist,C.A. et al. Induction of néonatal THl and CTL responses by live viral vaccines: a rôle for réplication patterns within antigen presenting cells? Vaccine 16, 1473-1478 (1998). 94. Forsthuber,T., Yip,H.C. & Lehmann,P.V. Induction of THl and TH2 immunity in néonatal mice. Science 271, 1728-1730 (1996). 95. Sarzotti,M., Robbins,D.S. & Hoffman,P.M. Induction of protective CTL responses in newbom mice by a murine retrovirus. Science 271, 1726-1728 (1996). 96. Adkins,B. Development of néonatal Thl/Th2 function. Int. Rev. Immunol. 19,157-171 (2000). 97. Wells,W.J., Parkman,R., Smogorzewska,E. & Barr,M. Néonatal thymectomy: does it affect immune fimction?y. Thorac. Cardiovasc. Surg. 115,1041-1046 (1998). 98. Sullender,W.M. et al. Humoral and cell-mediated immunity in neonates with herpes simplex virus infection. J. Infect. Dis. 155,28-37 (1987). 99. Burchett,S.K. et al. Diminished interferon-gamma and lymphocyte prolifération in néonatal and postpartum primary herpes simplex virus infection. J. Infect. Dis. 165, 813-818 (1992). 100. Reynolds,D.W., Dean,P.H., Pass,R.F. & Alford,C.A. Spécifie cell-mediated immunity in children with congénital and néonatal cytomégalovirus infection and their mothers. J. Infect. Dis. 140,493-499 (1979). 101. Aase,J.M., Noren,G.R., Reddy,D.V. & Geme,J.W. Mumps-virus infection in prégnant women and the immunologie response of their offspring. N. Engl. J. Med. 286, 1379-1382 (1972). 102. Starr,S.E., Tolpin,M.D., Friedman,H.M., Paucker,K. & Plotkin,S.A. Impaired cellular immunity to cytomégalovirus in congenitally infected children and their mothers. J. Infect. Dis. 140, 500505 (1979). 103. Friedmann,P.S. Cell-mediated immunological reactivity in neonates and infants with congénital syphilis. Clin. Exp. Immunol. 30,271-276 (1977). 104. Buimovici-Klein,E. & Cooper,L.Z. Cell-mediated immune response in rubella infections. Rev. Infect. Dis. 7 Suppl l:S123-8., S123-S128 (1985). 105. Pass,R.F., Stagno,S., Britt,W.J. & Alford,C.A. Spécifie cell-mediated immunity and the natural history of congénital infection with cytomégalovirus. J. Infect. Dis. 148, 953-961 (1983). 106. Paryani,S.G. & Arvin,A.M. Intrauterine infection with varicella-zoster virus after maternai varicella. N. Engl. J. Med. 314, 1542-1546 (1986). 107. Hara,T. et al. Human V delta 2+ gamma delta T-cell tolérance to foreign antigens of Toxoplasma gondii. Proc. Natl. Acad. Sci. U. S. A 93,5136-5140 (1996). 108. Weil,G.J. et al. Prénatal allergie sensitization to helminth antigens in offspring of parasiteinfected mothers. J. Clin. Invest 71,1124-1129 (1983). 109. Malhotra,!. et al. In utero exposure to helminth and mycobacterial antigens generates cytokine responses similar to that observed in adults. J. Clin. Invest 99,1759-1766 (1997). 73 110. Camus,D. et al. Sensitization to Schistosoma mansoni antigen in uninfected children bom to infected mothers. J. Infect. Dis. 134,405-408 (1976). 111. Prescott,S.L. et al. Transplacental priming of the human immune System to environmental allergens: universal skewing of initial T cell responses toward the Th2 cytokine profile. J. Immunol. 160,4730-4737(1998). 112. Holt,P.G. Primary allergie sensitization to environmental antigens: périnatal T cell priming as a déterminant of responder phenotype in adulthood. J. Exp. Med. 183,1297-1301 (1996). 113. Prescott,S.L. et al. Development of allergen-specific T-cell memory in atopie and normal children. Lancet iSi, 196-200 (1999). 114. Gem,J.E., Lemanske,R.F. & Busse,W.W. Early life origins of asthma. J. Clin. Invest 104, 837843 (1999). 115. Rowe,J. et al. Antigen-specific responses to diphtheria-tetanus-acellular pertussis vaccine in human infants are initially Th2 polarized. Infect. Immun. 68, 3873-3877 (2000). 116. Hall,C.B. Prospects for a respiratory syncytial virus vaccine. Science 265, 1393-1394 (1994). 117. Ryan,M. et al. Bordetella pertussis respiratory infection in children is associated with preferential activation of type 1 T helper cells. J. Infect. Dis. 175, 1246-1250 (1997). 118. Ausiello,C.M., Urbani,F., la Sala,A., Lande,R. & Cassone,A. Vaccine- and antigen-dependent type 1 and type 2 cytokine induction after primary vaccination of infants with whole-cell or acellular pertussis vaccines. Infect. Immun. 65,2168-2174 (1997). 119. Borkowsky,W. et al. Lymphoproliférative responses to recombinant HIV-1 envelope antigens in neonates and infants receiving gpl20 vaccines. AIDS Clinical Trial Group 230 Collaborators. J. Infect. Dis. 181, 890-896 (2000). 120. Winkler,S. et al. Frequency of cytokine-producing T cells in patients of different âge groups with Plasmodium falciparum malaria. J. Infect. Dis. 179,209-216 (1999). 121. Pollard,A.J. et al. Cellular immune responses to Neisseria meningitidis in children. Infect. Immun. 67, 2452-2463 (1999). 122. Gans.H.A. et al. IL-12, IFN-gamma, and T cell prolifération to measles in immunized infants. J. Immunol. 162, 5569-5575 (1999). 123. Ildirim,!., Sapan,N. & Cavusoglu,B. Comparison of BCG vaccination at birth and at third month of life. Arch. Dis. Child 67, 80-82 (1992). 124. Pabst,H.F., Godel,J.C., Spady,D.W., McKechnie,!. & Grace,M. Prospective trial of timing of bacillus Calmette-Guerin vaccination in Canadian Créé infants. Am. Rev. Respir. Dis. 140, 10071011 (1989). 125. Ravn,P., Boesen,H., Pedersen,B.K. & Andersen,P. Human T cell responses induced by vaccination with Mycobacterium bovis bacillus Calmette-Guerin. J. Immunol. 158, 1949-1955 (1997). 126. Marchant,A. et al. Newboms develop a Th 1-type immune response to Mycobacterium bovis bacillus Calmette-Guerin vaccination. J. Immunol. 163,2249-2255 (1999). 127. Brandt,C. et al. Protective immunity against respiratory syncytial virus in early life after murine maternai or néonatal vaccination with the recombinant G fusion protein BBG2Na. J. Infect. Dis. 176, 884-891 (1997). 74 128. Matriano,J.A., Socarras,S. & Streilein,J.W. Cellular mechanisms that maintain neonatallyinduced tolérance of class II alloantigens. Evidence that factor-mediated suppression silences cytotoxic T cell activity. J. Immunol. 153, 1505-1514 (1994). 129. Franchini,M. et al. Protective T-cell-based immunity induced in néonatal mice by a single réplicative cycle of herpes simplex virus. J. Viral. 75, 83-89 (2001). 130. Delespesse,G. et al. Maturation of human néonatal CD4+ and CD8+ T lymphocytes into Thl/Th2 effectors. Vaccine 16, 1415-1419 (1998). 131. Barbey,C. et al. Characterisation of the cytotoxic alloresponse of cord blood. Bone Marrow Transplant. 22 Suppl 1, S26-S30 (1998). 132. Gehrz,R.C. & Rutzick,S.R. Cytomégalovirus (CMV)-specific lysis of CMV-infected target cells can be mediated by both NK-like and virus-specific cytotoxic T lymphocytes. Clin. Exp. Immunol. 61, 80-89 (1985). 133. Rola-Pleszczynski,M. et al. Spécifie impairment of cell-mediated immunity in mothers of infants with congénital infection due to cytomégalovirus. J. Infect. Dis. 135, 386-391 (1977). 134. Buseyne,F., Blanche,S., Schmitt,D., Griscelli,C. & Riviere,Y. Détection of HIV-specific cellmediated cytotoxicity in the peripheral blood fi'om infected children. J. Immunol. 150, 35693581 (1993). 135. McFarland,E.J. et al. High frequency of Gag- and envelope-specific cytotoxic T lymphocyte precursors in children with vertically acquired human immunodeficiency virus type 1 infection. J. Infect. Dis. 170, 766-774 (1994). 136. Luzuriaga,K., Koup,R.A., Pikora,C.A., Brettler,D.B. & Sullivan,J.L. Déficient human immunodeficiency virus type 1-spécifie cytotoxic T cell responses in vertically infected children. J. Pediatr. 119, 230-236 (1991). 137. Pollack,H. et al. CD8+ T-cell-mediated suppression of HFV réplication in the first year of life: association with lower viral load and favorable early survival. AIDS 11, F9-13 (1997). 138. Buseyne,F. et al. Early HIV-specific cytotoxic T lymphocytes and disease progression in children bom to HIV-infected mothers. AIDS Res. Hum. Retroviruses 14, 1435-14^ (1998). 139. Rowland-Jones,S.L. et al. HIV-specific cytotoxic T-cell activity in an HIV-exposed but uninfected infant. Lancet 341, 860-861 (1993). 140. Shearer,G.M. & Clerici,M. Protective immunity against HIV infection: has nature donc the experiment for us? Immunol. Today 17,21-24 (1996). 141. De Maria,A., Cirillo,C. & Moretta,L. Occurrence of human immunodeficiency virus type 1 (HrV-l)-specific cytolytic T cell activity in apparently uninfected children bom to HIV-1infected mothers. J. Infect. Dis. 170, 1296-1299 0994). 142. Isaacs,D., Bangham,C.R. & McMichael,A.J. Cell-mediated cytotoxic response to respiratory syncytial virus in infants with bronchiolitis. Lancet 2,169-11 \ (1987). 143. Mbawuike,I.N. et al. HLA-restricted CD8+ cytotoxic T lymphocyte, interferon-gamma, and interleukin-4 responses to respiratory syncytial vims infection in infants and children. J. Infect. Dis. 183, 687-696 (2001). 144. Chiba,Y. et al. Development of cell-mediated cytotoxic immunity to respiratory syncytial virus in human infants following naturally acquired infection. J. Med. Virol. 28, 133-139 (1989). 75 145. Jaye,A., Magnusen,A.F., Sadiq,A.D., Corrah.T. & Whittle,H.C. Ex vivo analysis of cytotoxic T lymphocytes to measles antigens during infection and after vaccination in Gambian children. J. Clin. Invest 102,1969-1977 (1998). 146. Mbawuike,l.N., Piedra,P.A., Cate,T.R. & Couch,R.B. Cytotoxic T lymphocyte responses of infants after natural infection or immunization with live cold-recombinant or inactivated influenza A virus vaccine. J. Med. Virol. 50, 105-111 (1996). 147. Herzenberg,L.A., Kantor,A.B. & Herzenberg,L.A. Layered évolution in the immune system. A model for the ontogeny and development of multiple lymphocyte lineages. Ann. N. Y. Acad. Sci. 651, 1-9(1992). 148. Gathings,W.E., Kubagawa,H. & Cooper,M.D. A distinctive pattern of B cell immaturity in périnatal humans. Immunol. Rev. 57, 107-126 (1981). 149. Metcalf,E.S. & Klinman,N.R. In vitro tolérance induction of néonatal minine B cells. J. Exp. Med. 143,1327-1340 (1976). 150. Schroeder,H.W. et al. Developmental régulation of the human antibody répertoire. Ann. N. K. Acad. Sci. 764, 242-260 (1995). 151. Stoll,B.J. et al. Immunoglobulin sécrétion by the normal and the infected newbom infant. J. Pediatr. 122, 780-786 (1993). 152. Enders,G. Rubella antibody titers in vaccinated and nonvaccinated women and results of vaccination during pregnancy. Rev. Infect. Dis. 7 Suppl 1, S103-S107 (1985). 153. Naot,Y., Desmonts,G. & Remington,J.S. IgM enzyme-linked immimosorbent assay test for the diagnosis of congénital Toxoplasma infection. J. Pediatr. 98, 32-36 (1981). 154. Griffiths,P.D., Stagno,S., Pass,R.F., Smith,R.J. & Alford,C.A. Congénital cytomégalovirus infection: diagnostic and prognostic significance of the détection of spécifie immunoglobulin M antibodies in cord sérum. Pediatrics 69, 544-549 (1982). 155. Gill,T.J. et al. Transplacental immunization of the human fétus to tetanus by immunization of the mother. J. Clin. Invest 72, 987-996 (1983). 156. Baker,C.J. et al. Immunization of prégnant women with a polysaccharide vaccine of group B streptococcus. N. Engl. J. Med. 319, 1180-1185 (1988). 157. McCormick,J.B. et al. Antibody response to serogroup A and C meningococcal polysaccharide vaccines in infants bom of mothers vaccinated during pregnancy. J. Clin. Invest 65, 1141-1144 (1980). 158. Einhom,M.S., Weinberg,G.A., Anderson,E.L., Granoff,P.D. & Granoff,D.M. Immunogenicity in infants of Haemophilus influenzae type B polysaccharide in a conjugale vaccine with Neisseria meningitidis outer-membrane protein. Lancet 2,299-302 (1986). 159. Johnson,C.E. et al. Measles vaccine inununogenicity in 6- versus 15-month-old infants bom to mothers in the measles vaccine era. Pediatrics 93, 939-944 (1994). 160. Klinge,J., Lugauer,S., Kom,K., Heininger,U. & Stehr,K. Comparison of immunogenicity and reactogenicity of a measles, mumps and rubella (MMR) vaccine in German children vaccinated at 9-11, 12-14 or 15-17 months of âge. Vaccine 18, 3134-3140 (2000). 161. Booy,R. et al. Immunogenicity of combined diphtheria, tetanus, and pertussis vaccine given at 2, 3, and 4 months versus 3, 5, and 9 months of âge. Lancet 339, 507-510 (1992). 76 162. American Academy of Pediatrics Committee on Infections Diseases: Universal hepatitis B immunization. Pediatrics 89, 795-800 (1992). 163. Goldfarb,J. et al. Comparative study of the immunogenicity and safety of two dosing schedules of Engerix-B hepatitis B vaccine in neonates. Pediatr. Infect. Dis. J. 13, 18-22 (1994). 164. 01in,P., Hallander,H.O., Gustafsson,L., Barreto,L. & Podda,A. Measuring protection; a case study of pertussis vaccines—Swedish Trial 11; secondary non-randomized comparisons between two schedules of infant vaccination. Dev. Biol. Stand. 95, 211-220 (1998). 165. Paunio,M. et al. Secondary measles vaccine failures identified by measurement of IgG avidity: high occurrence among teenagers vaccinated at a young âge. Epidemiol. Infect. 124, 263-271 (2000). 166. Plebani,A. et al. Sérum IgG subclass concentrations in healthy subjects at different âge: âge normal percentile charts. Eur. J. Pediatr. 149,164-167 (1989). 167. Pihlgren,M. et al. Delayed and déficient establishment of the long-term bone marrow plasma cell pool during early life. Eur. J. Immunol. 31, 939-946 (2001). 168. Lieberman,J.M. et al. Effect of néonatal immunization with diphtheria and tetanus toxoids on antibody responses to Haemophilus influenzae type b conjugate vaccines. J. Pediatr. 126, 198205 (1995). 169. Kurikka,S. et al. Néonatal immunization: response to Haemophilus influenzae type b-tetanus toxoid conjugate vaccine. Pediatrics 95, 815-822 (1995). 170. Andre,F.E. & Zuckerman,A.J. Review: protective efficacy of hepatitis B vaccines in neonates. J. Med. Virol. 44, 144-151 (1994). 171. Dengrove,J. et al. IgG and IgG subclass spécifie antibody responses to diphtheria and tetanus toxoids in newboms and infants given DTP immunization. Pediatr. Res. 20, 735-739 (1986). 172. BaraffiL.J. et al. Immunologie response to early and routine DTP immunization in infants. Pediatrics 73, 37-42 (1984). 173. Gold,R., Lepow,M.L., Goldschneider,!. & Gotschlich,E.C. Immune Response of human infants of polysaccharide vaccines of group A and C Neisseria meningitidis. J. Infect. Dis. 136 Suppl, S31-S35 (1977). 174. Twmnasi,P.A. et al. A trial of a group A plus group C meningococcal polysaccharide-protein conjugate vaccine in Afiican infants. J. Infect. Dis. 171, 632-638 (1995). 175. Ridings,!., Dinan,L., Williams,R., Roberton,D. & Zola,H. Somalie mutation of immunoglobulin V(H)6 genes in human infants. Clin. Exp. Immunol. 114,33-39 (1998). 176. Goldblatt,D., Vaz,A.R. & Miller,E. Antibody avidity as a surrogate marker of successfiil priming by Haemophilus influenzae type b conjugate vaccines following infant immunization. J. Infect. Dis. 177, 1112-1115 (1998). 177. Timens,W., Boes,A., Rozeboom-Uiterwijk,T. & Poppema,S. Immaturity of the human splenic marginal zone in infancy. Possible contribution to the déficient infant immune response. J. Immunol. 143, 3200-3206 (1989). 178. Lucas,A.H., Azmi,F.H., Mink,C.M. & Granoff,D.M. Age-dependent V région expression in the human antibody response to the Haemophilus influenzae type b polysaccharide. J. Immunol. 150, 2056-2061 (1993). 77 179. Vallès-Ayoub,Y., Govan,H.L. & Braun,J. Evolving abundance and clonal pattern of human germinal center B cells during childhood. Blood 76, 17-23 (1990). 180. Splawski,J.B., Jelinek,D.F. & Lipsky,P.E. Délinéation of the functional capacity of human néonatal lymphocytes. J. Clin. Invest 87,545-553 (1991). 181. Brugnoni,D. et al. Ineffective expression of CD40 ligand on cord blood T cells may contribute to poor immunoglobulin production in the newbom. Eur. J. Immunol. 24,1919-1924 (1994). 182. Friedberg,S.H. & Weissman,I.L. Lymphoid tissue architecture. II. Ontogeny of peripheral T and B cells in mice: evidence against Peyer's patches as the site of génération of B cells. J. Immunol. 113,1477-1492(1974). 183. Lu,C.Y., Beller,D.I. & Unanue,E.R. During ontogeny, la-bearing accessory cells are found early in the thymus but late in the spleen. Proc. Natl. Acad. Sci. U. S. A 77, 1597-1601 (1980). 184. Rijkers,G.T., Sanders,E.A., Breukels,M.A. & Zegers,B.J. polysaccharide déterminants. Vaccine 16, 1396-1400 (1998). 185. Cadoz,M. Potential and limitations of polysaccharide vaccines in infancy. Vaccine 16, 13911395 (1998). 186. MacLennan,!. et al. Immunologie memory 5 years after meningococcal A/C conjugale vaccination in infancy. J. Infect. Dis. 183,97-104 (2001). 187. Adams,W.G. et al. Décliné of childhood Haemophilus influenzae type b (Hib) disease in the Hib vaccine era. JAMA 269,221-226 (1993). 188. Adegbola,R.A. et al. Haemophilus influenzae type b meningitis in The Gambia after introduction of a conjugale vaccine. Lancet 354,1091-1092 (1999). 189. Simister,N.E. & Story,C.M. Human placental Fc receptors and the transmission of antibodies ffom mother to fétus. J. Reprod. Immunol. 37,1-23 (1997). 190. Einhom,M.S., Granoff,D.M., Nahm,M.H., Quinn,A. & Shackelford,P.G. Concentrations of antibodies in paired maternai and infant sera; relationship to IgG subclass. J. Pediatr. 111, 783788 (1987). 191. Lewis,D.B. & Wilson,C.B. Remington,J.S. & Klein,J.O. (eds.), pp. 25-138 (W. B. Saunders, Philadelphia,2001 ). 192. Rahman,M. et al. Use of tetanus toxoid for the prévention of néonatal tetanus. 1. Réduction of néonatal mortality by immunization of non-pregnant and prégnant women in rural Bangladesh. Bull. World Health Organ 60,261-267 (1982). 193. Englund,J.A. et al. Transplacental antibody transfer following maternai immunization with polysaccharide and conjugale Haemophilus influenzae type b vaccines. J. Infect. Dis. 171, 99105 (1995). 194. Englund,J.A. et al. Maternai immunization with influenza or tetanus toxoid vaccine for passive antibody protection in young infants. J. Infect. Dis. 168,647-656 (1993). 195. 0'Dempsey,T.J. et al. Meningococcal antibody titres in infants of women immunised with meningococcal polysaccharide vaccine during pregnancy. Arch. Dis. Child Fêtai Néonatal Ed 74,F43-F46(1996). 196. Shahid,N.S. et al. Sérum, breast milk, and infant antibody after maternai immunisation with pneumococcal vaccine. Zancer 346, 1252-1257 (1995). Infant B cell responses to 78 197. Lmder,N. et al. Effect of maternai immunization with oral poliovirus vaccine on néonatal immunity. Pediatr. Infect. Dis. J. 13, 959-962 (1994). 198. Kasper.D.L. et al. Immune response to type III group B streptococcal polysaccharide-tetanus toxoid conjugale vaccine. J. Clin. Invest 98,2308-2314 (1996). 199. Riley,E.M. et al. Lack of association between maternai antibody and protection of African infants from malaria infection. Infect. Immun. 68, 5856-5863 (2000). 200. Carlier,Y. & Truyens,C. Influence of maternai infection on offspring résistance towards parasites. Parasitology Today 11, 94-99 (1995). 201. Siegrist,C.A. et al. Influence of maternai antibodies on vaccine responses: inhibition of antibody but not T cell responses allows successful early prime-boost strategies in mice. Eur. J. Immunol. 28,4138-4148(1998). 202. Siegrist,C.A. & Lambert,P.H. Maternai immunity and infant responses to immunization: factors influencing infant responses. Dev. Biol. Stand. 95, 133-139 (1998). 203. Albrecht,P., Ennis,F.A., Saltzman,E.J. & Krugman,S. Persistence of maternai antibody in infants beyond 12 months: mechanism of measles vaccine failure. J. Pediatr. 91, 715-718 (1977). 204. Sato,H., Albrecht,P., Reynolds,D.W., Stagno,S. & Ennis,F.A. Transfer of measles, mumps, and rubella antibodies from mother to infant. Its effect on measles, mumps, and rubella immunization. Am. J. Dis. Child 133,1240-1243 (1979). 205. Sarvas,H., Kurikka,S., Seppala,I.J., Makela,P.H. & Makela,0. Maternai antibodies partly inhibit an active antibody response to routine tetanus toxoid immunization in infants. J. Infect. Dis. 165, 977-979(1992). 206. Bjorkholm,B., Granstrom,M., Taranger,!., Wahl,M. & Hagberg,L. Influence of high titers of maternai antibody on the sérologie response of infants to diphtheria vaccination at three, five and twelve months of âge. Pediatr. Infect. Dis. J. 14, 846-850 (1995). 207. Kanra,G., Yalcin,S.S., Ceyhan,M. & Yurdakok,K. Clinical trial to evaluate immunogenicity and safety of inactivated hepatitis A vaccination starting at 2-month-old children. Turk. J. Pediatr. 42, 105-108 (2000). 208. Barin,F. et al. Immune response in neonates to hepatitis B vaccine. Lancet 1, 251-253 (1982). 209. Taylor,W.R., Mambu,R.K., ma-Disu,M. & Weinman,J.M. Measles control efforts in urban Africa complicated by high incidence of measles in the first year of life. Am. J. Epidemiol. 127, 788-794 (1988). 210. Garly,M.L. et al. Early two-dose measles vaccination schedule in Guinea-Bissau: good protection and coverage in infancy. Int. J. Epidemiol. 28, 347-352 (1999). 211. Siegrist,C.A. et al. Déterminants of infant responses to vaccines in presence of maternai antibodies. Vaccine \6, 1409-1414(1998). 212. Knudsen,K.M. et al. Child mortality following standard, medium or high titre measles immunization in West Africa. Int. J. Epidemiol. 25, 665-673 (1996). 213. Gans,H.A. et al. Deficiency of the humoral immune response to measles vaccine in infants immunized at âge 6 months. JAMA 280, 527-532 (1998). 214. McGraw,T.T. Reimmunization following early immunization with measles vaccine: prospective study. Pediatrics 77,45-48 (1986). a 79 215. Stetler,H.C. et al. Impact of revaccinating children who initially received measles vaccine before 10 months of âge. Pediatrics 77,471-476 (1986). 216. Cherry,J.D., Feigin,R.D., Shackelford,P.G., Hinthom,D.R. & Schmidt,R.R. A clinical and sérologie study of 103 children with measles vaccine failure. J. Pediatr. 82, 802-808 (1973). 217. van Binnendijk,R.S., Poelen,M.C., van Amerongen,G., de Vries,P. & Osterhaus,A.D. Protective immunity in macaques vaccinated with live attenuated, recombinant, and subunit measles vaccines in the presence ofpassively acquired antibodies. 7. Infect. Dis. 175, 524-532 (1997). 218. Bonney,E.A. & Matzinger,P. The maternai immune system's interaction with circulating fêtai cells. J. Immunol. 158,40-47 (1997). 219. Thellin,0., Coumans,B., Zorzi,W., Igout,A. & Heinen,E. Tolérance to the foeto-placental 'graft'; ten ways to support a child for nine months. Cuir. Opin. Immunol. 12, 731-737 (2000). 220. Kelly,R.W. & Critchley,H.O. A T-helper-2 bias in decidua: the prostaglandin contribution of the macrophage and trophoblast. J. Reprod. Immunol. 33, 181-187 (1997). 221. Lin,H., Mosmann,T.R., Guilbert,L., Tuntipopipat,S. & Wegmaim,T.G. Synthesis of T helper 2type cytokines at the matemal-fetal interface. J. Immunol. 151,4562-4573 (1993). 222. Roth,I. et al. Human placental cytotrophoblasts produce the immunosuppressive cytokine interleukin 10. J. Exp. Med. 184, 539-548 (1996). 223. Raghupathy,R. Th 1-type immunity is incompatible with successful pregnancy. Immunol. Today 18, 478-482(1997). 224. Wegmaim,T.G., Lin,H., Guilbert,L. & Mosmann,T.R. Bidirectional cytokine interactions in the matemal-fetal relationship: is successful pregnancy a TH2 phenomenon? Immunol. Today 14, 353-356(1993). 225. Brabin,B.J. Epidemiology of infection in pregnancy. Rev. Infect. Dis. 7, 579-603 (1985). 226. Vamer,M.W. Autoimmune disorders and pregnancy. Semin. Perinatol. 15, 238-250 (1991). 227. Sacks,G., Sargent,!. & Redman,C. An innate view of human pregnancy. Immunol. Today 20, 114-118(1999). 228. Sacks,G., Sargent,!. & Redman,C. Innate immunity in pregnancy. Immunol. Today 21, 200-201 (2000). 229. Redman,C.W., Sacks,G.P. & Sargent,I.L. Preeclampsia: an excessive maternai inflammatory response to pregnancy. Am. J. Obstet. Gynecol. 180,499-506 (1999). 230. Clark,D.A., Arck,P.C. & Chaouat,G. Why did your mother reject you? Immunogenetic déterminants of the response to enviroiunental sélective pressure expressed at the uterine level. Am. J. Reprod. Immunol. 41, 5-22 (1999). 231. Fidel,P.L. et al. Systemic and local cytokine profiles in endotoxin-induced preterm parturition in mice. Am. J. Obstet. Gynecol. 170,1467-1475 (1994). 232. Beeson,J.G. et al. Adhesion of Plasmodium falciparum-infected érythrocytes to hyaluronic acid in placental malaria. Nat. Med. 6, 86-90 (2000). 233. Fievet,N. et al. Plasmodium falcipamm Induces a Thl/Th2 Disequilibrium, Favoring the ThlType Pathway, in the Human Placenta. J. Infect. Dis. 183, 1530-1534 (2001). 80 234. Menendez,C. et al. The impact of placental malaria on gestational âge and birth weight. J. Infect. Dis. 181, 1740-1745 (2000). 235. Lee,B.N. et al. Inflammatory cytokine expression is correlated with the level of human immunodeficiency virus (HIV) transcripts in HFV-infected placental trophoblastic cells. J. Viral. 71, 3628-3635 (1997). 236. Carlier,Y., Rivera,M.T., Truyens,C., Puissant,?. & Milaire,J. Interactions between chronic murine Trypanosoma cruzi infection and pregnancy: fêtai growth retardation. Am. J. Trop. Med. Hyg. 37,534-540(1987). 237. Altemani,A.M., Bittencourt,A.L. & Lana,A.M. Immunohistochemical characterization of the inflammatory infiltrate in placental Chagas' disease: a qualitative and quantitative analysis. Am. J. Trop. Med. Hyg. 62,319-324 (2000). 238. Rivera,M.T. et al. High tumor necrosis factor alpha (TNF-alpha) production in Trypanosoma cruzi-infected prégnant mice and increased TNF-alpha gene transcription in their offspring. Infect. Immun. 63, 591-595 (1995). 239. Wamer,J.A., Jones,C.A., Jones,A.C. & Wamer,J.O. Prénatal origins of allergie disease. J. Allergy Clin. Immunol. 105, S493-S498 (2000). 240. Lewert,R.M. & Mandlowitz,S. Schistosomiasis: prénatal induction of tolérance to antigens. Nature UA, 1029-1030(1969). 241. Steel,C., Guinea,A., McCarthy,J.S. & Ottesen,E.A. Long-term effect of prénatal exposure to maternai microfilaraemia on immune responsiveness to filarial parasite antigens. Lancet 343, 890-893 (1994). 242. Lammie,P.J., Hitch,W.L., Walker Allen,E.M., Hightower,W. & Eberhard,M.L. Maternai filarial infection as risk factor for infection in children. Lancet 331, 1005-1006 (1991). 243. Herz,U. et al. Impact of in utero Th2 immunity on T cell déviation and subséquent immediatetype hypersensitivity in the neonate. Eur. J. Immunol. 30, 714-718 (2000). 244. Barker,D.J.P. Mothers, Babies and Health in Later Life. Churchill Livingstone, Edinburgh (1998). 245. Winick,M. & Noble,A. Cellular response in rats during malnutrition at various âges. J. Nutr. 89, 300-306 (1966). 246. Kochanowski,B.A. & Sherman,A.R. Decreased antibody formation in iron-deficient rat pups— effect of iron repletion. Am. J. Clin. Nutr. 41, 278-284 (1985). 247. Chandra,R.K. Antibody formation in first and second génération offspring of nutritionally deprived rats. Science 190,289-290 (1975). 248. Godfrey,K.M., Barker,D.J. & Osmond,C. Disproportionate fêtai growth and raised IgE concentration in adult life. Clin. Exp. Allergy 24, 641-648 (1994). 249. Moore,S.E. et al. Season of birth predicts mortality in rural Gambia. Nature 388, 434 (1997). 250. Malhotra,!. et al. Helminth- and Bacillus Calmette-Guerin-induced immunity in children sensitized in utero to filariasis and schistosomiasis. J. Immunol. 162, 6843-6848 (1999). 251. Chougnet,C. et al. Influence of human immunodeficiency virus-infected maternai environment on development of infant interleukin-12 production. J. Infect. Dis. 181, 1590-1597 (2000). 81 252. Ota,M.O. et al. HFV-negative infants bom to HFV-1 but not HIV-2-positive mothers fail to develop a Bacillus Calmette-Guerin scar. AIDS 13, 996-998 (1999). 253. Martinez,F.D. Rôle of viral infections in the inception of asthma and allergies during childhood: could they be protective? Thorax 49,1189-1191 (1994). 254. Holt,P.G., Sly,P.D. & Bjorksten,B. Atopie versus infectious diseases in childhood: a question of balance? Pediatr. Allergy Immunol. 8, 53-58 (1997). 255. Worldwide variation in prevalence of symptoms of asthma, allergie rhinoconjunctivitis, and atopie eczema: ISAAC. The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Lancet 351, 1225-1232 (1998). 256. Rook,G.A. & Stanford,J.L. Give us this day our daily germs. Immunol. Today 19, 113-116 (1998). 257. Kramer,U., Heinrich,!., Wjst,M. & Wichmann,H.E. Age of entry to day nursery and allergy in later childhood. Lancet 353,450-454 (1999). 258. Ball,T.M. et al. Siblings, day-care attendance, and the risk of asthma and wheezing during childhood. N. Engl. J. Med. 343, 538-543 (2000). 259. Sudo,N. et al. The requirement of intestinal bacterial flora for the development of an IgE production System fiilly susceptible to oral tolérance induction. J. Immunol. 159, 1739-1745 (1997). 260. Neish,A.S. et al. Prokaryotic régulation of épithélial responses by inhibition of IkappaB-alpha ubiquitination. Science 289, 1560-1563 (2000). 261. Kalliomaki,M. et al. Probiotics in primary prévention of atopie disease: a randomised placebocontrolled trial. Lancet 357, 1076-1079 (2001). 262. Hopkin,J.M. Early life receipt of antibiotics and atopie disorder. Clin. Exp. Allergy 29, 733-734 (1999). 263. Shaheen,S.O. et al. Measles and atopy in Guinea-Bissau. Lancet 347, 1792-1796 (1996). 264. Shirakawa,T., Enomoto,T., Shimazu,S. & Hopkin,J.M. The inverse association between tuberculin responses and atopie disorder. Science 275, 77-79 (1997). 265. Aaby,P. et al. Early BCG vaccination and réduction in atopy in Guinea-Bissau. Clin. Exp. Allergy 30, 644-650 (2000). 266. Bodner,C., Godden,D. & Seaton,A. Family size, childhood infections and atopie diseases. The Aberdeen WHEASE Group. Thorax 53, 28-32 (1998). 267. Gereda,J.E. et al. Relation between house-dust endotoxin exposure, type 1 T-cell development, and allergen sensitisation in infants at high risk of asthma. Lancet 355, 1680-1683 (2000). 268. Alm,J.S., Lilja,G., Pershagen,G. & Scheynius,A. Early BCG vaccination and development of atopy. Lancet 350,400-403 (1997). 269. Strannegard,I.L., Larsson,L.O., Wennergren,G. & Strannegard,0. Prevalence of allergy in children in relation to prior BCG vaccination and infection with atypical mycobacteria. Allergy 53, 249-254(1998). 270. Paunio,M. et al. Measles history and atopie diseases: a population-based cross-sectional study. JAMA 19;283, 343-346 (2000). 82 271. McCarthy,M. Closing vaccination's "window of vulnerability". Lancet 357, 1022 (2001). 272. Edmunds.W.J., Medley.G.F., Nokes.D.J., Hall.A.J. & Whittle.H.C. The influence of âge on the development of the hepatitis B carrier State. Proc. R. Soc. Lond B Biol. Sci. 253, 197-201 (1993). 273. OttenhofflT.H., Kumararatne.D. & Casanova,J.L. Novel human iimnunodeficiencies reveal the essential rôle of type-I cytokines in immunity to intracellular bacteria. Immunol. Today 19, 491494 (1998). 274. Atabani,S. et al. Natural measles causes prolonged suppression of Interleukin-12 production. J. Infect. Dis. 184, 00 (2001). 275. Bont,L., Kavelaars,A., Heijnen,C.J., van Vught,A.J. & Kimpen,J.L. Monocyte interleukin-12 production is inversely related to duration of respiratory failure in respiratory syncytial virus bronchiolitis. J. Infect. Dis. 181,1772-1775 (2000). 276. Luty,A.J. et al. Low interleukin-12 activity in severe Plasmodium falciparum malaria. Infect. Immun. 68, 3909-3915 (2000). 277. Ellis,R.W. Vaccines. Plotkin.S.A. & Orenstein,W.A. (eds.), pp. 881-901 (W. B. Saunders, Philadelphia, 1999). 278. Jonuleit,H., Schmitt,E., Schuler,G., Knop,J. & Enk,A.H. Induction of interleukin 10-producing, nonproliferating CD4(+) T cells with regulatory properties by répétitive stimulation with allogeneic immature human dendritic cells. J. Exp. Med. 192, 1213-1222 (2000). 279. Kadowaki,N. et al. Distinct cytokine profiles of néonatal natural killer t cells after expansion with subsets of dendritic cells. J. Exp. Med. 193,1221-1226 (2001). 280. Henderson,R.A., Watkins,S.C. & Flynn,J.L. Activation of human dendritic cells following infection with Mycobacterium tuberculosis. J. Immunol. 159, 635-643 (1997). 281. Hoft,D.F., Brown,R.M. & Roodman,S.T. Bacille Calmette-Guerin vaccination enhances human gamma delta T cell responsiveness to mycobacteria suggestive of a memory-like phenotype. J. Immunol. 161, 1045-1054(1998). 282. Kemp,K., Hviid,L., Kharazmi,A. & Kemp,M. Interferon-gamma production by human T cells and natural killer cells in vitro in response to antigens from the two intracellular pathogens Mycobacterium tuberculosis and Leishmania major. Scand. J. Immunol. 46,495-499 (1997). 283. Marchant,A. et al. Polarization of PPD-specific T-cell response of patients with tuberculosis from ThO to Thl profile after successful antimycobacterial therapy or in vitro conditioning with interferon-alpha or interleukin-12. Am. J. Respir. Cell Mol. Biol. 24, 187-194 (2001). 284. Del Prete,G.F. et al. Purified protein dérivative of Mycobacterium tuberculosis and excretorysecretory antigen(s) of Toxocara canis expand in vitro human T cells with stable and opposite (type 1 T helper or type 2 T helper) profile of cytokine production. J. Clin. Invest 88, 346-350 (1991). 285. Romagnani.S. Induction of THl and TH2 responses: a key rôle for the 'natural' immune response? Immunol. Today 13,379-381 (1992). 286. Ogra,P.L., Fishaut,M. & Gallagher,M.R. Viral vaccination via the mucosal routes. Rev. Infect. Dis. 2, 352-369 (1980). 287. Gregorek,H. et al. The IgG subclass profile of anti-HBs response in vaccinated children and children seroconverted after natural infection. Vaccine 18, 1210-1217 (2000). 83 288. Minuk,G.Y., Hoofhagle,J.H., McAuliffe.V.J. & Purcell,R.H. IgM antibody responses to hepatitis B surface antigen in récipients of hepatitis B virus vaccine. J. Infect. Dis. 148, 330 (1983). 289. Breitfeld,D. et al. Follicular B helper T cells express CXC chemokine receptor 5, localize to B cell follicles, and support immunoglobulin production. J. Exp. Med. 192, 1545-1552 (2000). 290. Bos,J.D. & Kapsenberg,M.L. The skin immune System: progress in cutaneous biology. Immunol. Today 14, 75-78 (1993). 291. Kemp,E.B., Belshe,R.B. & Hoft,D.F. Immune responses stimulated by percutaneous and intradermal bacille Calmette-Guerin. J. Infect. Dis. 174,113-119 (1996). 292. Larregina,A.T. et al. Direct transfection and activation of human cutaneous dendritic cells. Gene Ther. 8, 608-617(2001). 293. Melnick,J.L., Proctor,R.O., Ocampo,A.R., Diwan,A.R. & Ben Porath,E. Free and bound virus in sérum after administration of oral poliovirus vaccine. Am. J. Epidemiol. 84, 329-342 (1966). 294. Adkins,B., Bu,Y. & Guevara,P. The génération of Th memory in neonates versus adults: prolonged primary Th2 effector fimction and impaired development of Thl memory effector function in murine neonates. J. Immunol. 166, 918-925 (2001). 295. Holt,P.G. & Macaubas,C. Development of long-term tolérance versus sensitisation to environmental allergens during the périnatal period. Curr. Opin. Immunol. 9, 782-787 (1997). 296. Hoft,D.F., Brown,R.M. & Belshe,R.B. Mucosal bacille calmette-Guerin vaccination of humans inhibits delayed-type hypersensitivity to purified protein dérivative but induces mycobacteriaspecific interferon-gamma responses. Clin. Infect. Dis. 30 Suppl 3:8217-22., S217-S222 (2000). 297. Chambers,M.A. et al. Differential responses to challenge with live and dead Mycobacterium bovis Bacillus Calmette-Guerin. J. Immunol. 158,1742-1748 (1997). 298. Demangel,C. et al. Stimulation of dendritic cells via CD40 enhances immune responses to Mycobacterium tuberculosis infection. Infect. Immun. 69, 2456-2461 (2001). 299. Trevenen,C.L. & Pagtakhan,R.D. Disseminated tuberculoid lésions in infants following BCG vaccination. Can. Med. Assoc. J. 127, 502-504 (1982). 300. Prescott,S., Jackson,A.M., Hawkyard,S.J., AlexandroffA.B. & James,K. Mechanisms of action of intravesical bacille Calmette-Guerin: local immune mechanisms. Clin. Infect. Dis. 31 Suppl 3, S91-S93 (2000). 301. Tsuji,S. et al. Maturation of human dendritic cells by cell wall skeleton of Mycobacterium bovis bacillus Calmette-Guerin: involvement of toll-like receptors. Infect. Immun. 68, 6883-6890 (2000). 302. Lyashchenko,K. et al. Heterogeneous antibody responses in tuberculosis. Infect. Immun. 66, 3936-3940 (1998). 303. Grewal,I.S., Borrow,P., Pamer,E.G., 01dstone,M.B. & Flavell,R.A. The CD40-CD154 System in anti-infective host defense. Curr. Opin. Immunol. 9,491-497 (1997). 304. Weintraub,J. & Weinbaum,F.I. The effect of BCG on experimental cutaneous leishmaniasis in mice. y. Immunol. 118, 2288-2290 (1977). 305. Rocken,M., Urban,J.F. & Shevach,E.M. Infection breaks T-cell tolérance. Nature 359, 79-82 (1992). 84 306. Araujo,Z. et al. Vaccination of mice with a combination of BCG and killed Leishmania promastigotes reduces acute Trypanosoma cruzi infection by promoting an IFN-gamma response. Vaccine 17, 957-964 (1999). 307. Kristensen,!., Aaby,P. & Jensen,H. Routine vaccinations and child survival: follow up study in Guinea-Bissau, West Africa. fiM/321,1435-1438 (2000). 308. Davis,I.D. Cytokine therapy in metastatic rénal cancer. N. Engl. J. Med. 339, 850 (1998). 309. Debets,J.M., Van de Winkel,J.G., Ceuppens,J.L., Dieteren,I.E. & Buurman.W.A. Cross-linking of both Fc gamma RI and Fc gamma RH induces sécrétion of tumor necrosis factor by buman monocytes, requiring high affinity Fc-Fc gamma R interactions. Functional activation of Fc gamma RII by treatment with proteases or neuraminidase. J. Immunol. 144, 1304-1310 (1990). 310. Camargo,M.M. et al. Glycosylphosphatidylinositol-anchored mucin-like glycoproteins isolated from Trypanosoma cruzi trypomastigotes initiate the synthesis of proinflammatory cytokines by macrophages. J. Immunol. 158, 5890-5901 (1997). 311. Camargo,M.M., Andrade,A.C., Almeida,I.C., Travassos,L.R. & Gazzinelli,R.T. Glycoconjugates isolated from Trypanosoma cruzi but not from Leishmania species membranes trigger nitric oxide synthesis as well as microbicidal activity in IFN-gamma-primed macrophages. J. Immunol. 159,6131-6139 (1997). 312. Ropert,C. et al. Requirement of mitogen-activated protein kinases and I kappa B phosphorylation for induction of proinflammatory cytokines synthesis by macrophages indicates functional similarity of receptors triggered by glycosylphosphatidylinositol anchors from parasitic protozoa and bacterial lipopolysaccharide. J. Immunol. 166, 3423-3431 (2001). 313. Shoda,L.K. et al. DNA from protozoan parasites Babesia bovis, Trypanosoma cruzi, and T. brucei is mitogenic for B lymphocytes and stimulâtes macrophage expression of interleukin-12, tumor necrosis factor alpha, and nitric oxide. Infect. Immun. 69,2162-2171 (2001). 314. Femandez-Gomez,R., Esteban,S., Gomez-Corvera,R., Zoulika,K. & Ouaissi,A. Trypanosoma cruzi: Tc52 released protein-induced increased expression of nitric oxide synthase and nitric oxide production by macrophages. J. Immunol. 160, 3471-3479 (1998). 315. Azogue,E., La Fuente,C. & Darras,C. Congénital Chagas' disease in Bolivia: epidemiological aspects and pathological findings. Trans. R. Soc. Trop. Med. Hyg. 79, 176-180 (1985). 316. Vekemans.J., Ota,M.O., Goetghebuer,T., Newport,M.J. & Marchant,A. "Immunization of newboms in the tropics." The Gambia, 25-27 November 1999. Vaccine 19, 387-392 (2000). 317. Goubeau,P. Vaccinations. Repères en immunisations actuelles. Vandepitte,!., Wauters,G. & Pellegrims,E. (eds.), pp. 35-44 (Garant, Leuven,1995). 318. Senterre,J. Vaccinations. Repères en immunisation actuelle. Vandepitte,!., Wauters,G. & Pellegrims,E. (eds.), pp. 43-62 (Garant, Leuven,1995). 319. Shoenfeld,Y. & Aron-Maor,A. Vaccination and autoimmunity-'vaccinosis': a dangerous liaison? J. Autoimmun. 14, 1-10 (2000). 320. Ascherio,A. et al. Hepatitis B vaccination and the risk of multiple sclerosis. N. Engl. J. Med. 344,327-332 (2001). 321. Classen,J.B. & Classen,D.C. Immunization in the first month of life may explain décliné in incidence of IDDM in The Netherlands. Autoimmunity 31,43-45 (1999). 322. Classen,J.B. & Classen,D.C. Hemophilus vaccine associated with increased risk of diabètes: causality likely. Diabètes Care 23, 872-873 (2000). 85 323. White,H. Association between type 1 diabètes and Hib vaccine. More research is still needed. 5M/319, 1133(1999). 324. Taylor,B- et al. Autism and measles, mumps, and rubella vaccine: no epidemiological evidence for a causal association. Lancet 353,2026-2029 (1999). 325. Dales,L., Hainnier,S.J. & Smith,N.J. Time trends in autism and in MMR immunization coverage in California. JAMA 285, 1183-1185 (2001). 326. Bower,H. New research demolishes link between MMR vaccine and autism. BMJ 19;318, 1643 (1999). 327. Perez-Schael,I. Future of research into rotavirus vaccine. Developing countries must apply mathematics to take their own decisions. BMJ322, 106-107 (2001). 86 Intitulé de la thèse annexe Cellules souches du sang de cordon ombilical : l’assurance-vie du troisième millénaire ? 87