TP L3 microbiologie 2013-2014 - umtice

1
Université du Maine 2013-2014
Travaux pratiques - Microbiologie
Avant-propos : règles de travail en laboratoire de microbiologie
Au cours des séances de travaux pratiques, vous serez amenés à manipuler de nombreux micro-
organismes. Certaines espèces peuvent être pathogènes. L’infection est un risque biologique potentiel (pour
soi, comme pour les personnes de son entourage) qui s’additionne aux autres risques inhérents aux activités
de laboratoire. Les consignes suivantes doivent donc être impérativement respectées pour éliminer
tous risques de contamination.
- Attacher des cheveux longs; porter une blouse (elle doit être enlevée avant de sortir).
- Ne pas fumer, ni manger, ni boire pendant les séances.
- Se laver les mains avant et après chaque séance de laboratoire.
- Nettoyer la surface de travail (alcool 70%, puis eau de Javel diluée) avant et après chaque séance.
- Eviter de parler ou de se déplacer inutilement lorsque des ensemencements sont faits.
- Organiser et disposer le matériel de telle sorte que rien ne soit renversé.
- Toujours manipuler les micro-organismes près de la flamme.
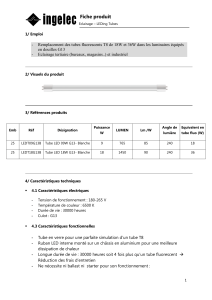
- Ne déposer les instruments sur la table qu’après les avoir stérilisés (anse, verrerie : par flambage;
pipette : par trempage dans l’alcool ou l’eau de Javel).
- Désinfecter immédiatement toute zone où a été renversé un liquide contaminé.
Pour les 4 séances de TP, apporter :
- des petites étiquettes à coller sur les tubes
- du scotch pour mettre sur les étiquettes (pour qu’elles ne partent pas lors de l’autoclavage)
- des feutres résistants à l’eau ou crayon de papier
- une blouse et quoi s'attacher les cheveux
- les calculs sont faits AVANT la séance de TP (pour la séance I) et APRES pour les autres
séances
Pour chaque tube ou boite ensemencé(e), sur l’étiquette il sera écrit :
- vos initiales
- votre groupe de TP
- quelle est la condition testée (ex : NaCL 2,5 %)
- un code pour la souche bactérienne
A la fin de certaines séances les étiquettes seront à enlever entièrement des tubes (eau chaude et
grattoir), de l'eau de javel devra être rajouté (~1 mL) dans les tubes, qui seront vidés à l'évier et
rincés, après 5 min d'incubation avec la javel.
Analyse bactériologique d’un prélèvement tellurique
Les micro-organismes sont omniprésents. En milieu naturel, ils ont pour origine le sol, l’eau, les
poussières et aérosols, les végétaux, les animaux (essentiellement au niveau de la peau, du tube digestif,
des voies respiratoires). L’objectif de ces manipulations est d’isoler et de déterminer certaines des
caractéristiques physiologiques et biochimiques de souches bactériennes présentes dans un échantillon de
terre. Cet échantillon se trouve dans un tube stérile de 50 mL (un tube fourni par binôme) afin d’éviter toute
contamination. Le tube ne doit être ouvert qu’au moment du prélèvement et sera maintenu fermé jusqu’aux
manipulations.

2
Poste de Microbiologie
Zone stérile délimitée par un bec Bunsen
Consignes de sécurité : Exemplaire étudiant
Ne jamais travailler avec des gants en présence de la flamme
Nettoyage de la paillasse :
Désinfecter la paillasse avec de l’eau de javel : LUNETTES
Nettoyage des mains
Lavage des mains avec du savon, puis friction avec de l’alcool à 70 %
Allumage du bec Bunsen
Préparer la zone de manipulation et le matériel
Demander l’autorisation de l’encadrant
Ecarter la pissette d’alcool ou tout matériau inflammable (ex : polycopiés)
Allumer le bec Bunsen en position flamme éclairante (virole fermée = flamme jaune) ou en
position veilleuse
Manipulation en zone stérile
La zone stérile se situe dans un rayon de 20 cm autour
du bec Bunsen en position flamme chauffante
(virole ouverte = flamme bleue)
Manipuler assis !!!
Fin de manipulation
Mettre toute pipette contaminée dans le bocal eau de Javel
Eteindre le bec Bunsen
Javelliser les tubes de culture à évacuer
Enlever les étiquettes (voir plus haut)
Ranger et javelliser la paillasse
Se laver les mains avant de sortir de la salle
Zone stérile
Conduite à tenir en cas de coupure avec du matériel souillé :
Avertir l’encadrant
Laver à l’eau et au savon puis désinfecter avec de l’alcool à 70 %
Conduite à tenir en cas de projection de liquide contaminé :
Avertir l’encadrant
Laver abondamment au savon et à l’eau

3
Préparation de l’analyse bactériologique : séance I
I - Extraction et mise en culture des bactéries présentes dans l’échantillon
1. Détermination de la teneur en eau
Cette étape est indispensable pour déterminer la teneur en micro-organismes par
gramme de terre sèche afin de pouvoir comparer les résultats entre les échantillons.
- Déterminer précisément le poids d’un poudrier (ou du matériel équivalent). M1=___
- Peser 5 g de terre et placer cet aliquote dans le poudrier.
- Déterminer précisément la masse du poudrier + terre. M2=___
- Placer l’ensemble dans une étuve à 100 °C pendant au moins 24 h.
- Déterminer la masse du poudrier + terre après ce délai. M3=___ (séance suivante)
- Estimer la teneur en eau et le poids sec de la terre (en gramme et en %) (Séance
suivante)
2. Extraction de la flore microbiologique
Cette étape permet de récupérer l’ensemble de la flore microbiologique sans
contrainte sélective. Elle est réalisée dans une solution d’eau physiologique qui constitue
un milieu isotonique empêchant la lyse des cellules en maintenant une valeur de pression
extracellulaire proche de celle de la pression intracellulaire.
- Peser 5 g de terre.
- Placer cet échantillon dans le tube contenant 30 mL de solution d’extraction
A
(eau physiologique stérile)
sous la flamme
- Homogénéiser vigoureusement.
- Ajuster le « volume contenant la terre » à 50 mL avec la solution stérile
d’extraction
B
sous la flamme
3. Dilutions et étalements
Sous la flamme
La suspension de micro-organismes est diluée en cascade de 10
-1
à 10
-6
. Le
transfert de 1 mL de la suspension initiale dans le 1
er
tube contenant 9 mL de solution de
dilution constitue la dilution 10
-1
. Répéter jusqu’à obtenir la dilution 10
-6
.
- Homogénéiser entre chaque dilution.
- Etaler 0,1 mL de chaque dilution (en commençant par la dilution la plus élevée) sur
une boîte de Gélose nutritive fournie (identifier les boîtes par vos initiales et le
N° de groupe sur le fond).
- Bien rincer la pipette avant et après chaque prélèvement (dans le tube inoculé).
- Placer les boîtes à incuber à l’envers à 20 °C pendant 24 h.
- Placer le tube de 50 mL contenant l’échantillon de terre + solution physiologique à
4 °C.

4
-Après les étalements, mettre un peu d’eau de javel dans les tubes ayant servis à la
dilution en cascade pour tuer les bactéries. Attendre quelques minutes et les vider
dans le bécher prévu à cet effet (« poubelle liquide »). Enlever les étiquettes ou
les inscriptions et mettre les tubes dans la bassine prévue à cet effet.
* L’étalement consiste à répartir de façon homogène l’échantillon (0,1 mL) sur la BP,
à l’aide d’un « râteau » stérile du moins concentré au plus concentré. A ne pas confondre
avec un ensemencement (transfert de bactéries sur un milieu axénique, qui ne contient
pas de micro-organisme), qui peut se faire, entre autre, par pipetage (III-1, III-2, III-3a), par
piqûre (III-3b), ou encore par la méthode des stries (III-3c).
II - Préparation des milieux
Cette étape permet de préparer les milieux liquides qui seront utilisés au cours de
ces travaux pratiques. Les compositions des milieux sont indiquées en annexe. Une fois
les mélanges réalisés et « aliquotés », ils seront stérilisés par autoclavage.
Penser à l’échantillon témoin en spectrophotométrie lors de l'estimation du
volume de BN à préparer.
- Estimer le volume de BN pour préparer les tubes (20 tubes : 2 ensemencements
multipliés par 4 températures, 5 concentrations NaCl, et 1 témoin). Rajouter deux
tubes pour le cas où vous vous tromperiez.
- Calculer les masses et les volumes nécessaires pour la suite des manipulations
(par exemple NaCl).
- Noter sur chaque tube et boîte vos initiales et n° de groupe et le milieu.
- Préparer les milieux selon les protocoles donnés en annexe.
Ces milieux seront stérilisés et utilisés lors des séances suivantes.

5
Analyse bactériologique de l’échantillon : séance II
I - Extraction et mise en culture des bactéries présentes dans l’échantillon (fin)
Peser les boites de terre sèche : masse M3 = _____
Estimer la teneur en eau et le poids sec de la terre (en gramme et en %)
1. Estimation de la teneur bactérienne
En partant du principe que chaque colonie isolée provient d’une seule cellule,
dénombrer les colonies contenues dans une boîte de Pétri. Les calculs seront effectués
à partir du nombre de colonies isolées comptabilisées sur les boîtes. Ces calculs devront
tenir compte des facteurs de dilution et des volumes étalés.
- A partir des boîtes obtenues avec les dilutions (séance I), estimer la teneur de
micro-organismes en Unités Formant Colonies/g de terre sèche.
2. Mise en culture de colonies isolées
L’isolement des colonies pour le dénombrement permet de travailler sur des souches
spécifiques de micro-organismes en vue d’identifier certaines de leurs caractéristiques
physiologiques et biochimiques. Pour cela il est nécessaire de partir de souches pures
mises en culture sur un milieu liquide non sélectif (le bouillon nutritif BN).
- Choisir 2 colonies isolées, d’aspect différent, obtenues sur boîtes.
- Décrire ces colonies : grandes, petites, lisses, rugueuses…..
- Les mettre en culture dans 3 mL de BN = Solution d’ensemencement
sous la
flamme, prélever sans gélose 2 à 3 colonies (suivant leur taille) et les mettre
dans les 3 mL de BN. Mélanger.
II - Techniques de coloration
L’observation des micro-organismes se fait grâce à la microscopie, le plus souvent
à l’aide de diverses techniques de coloration. Les colorants servent à mettre en évidence
la forme des cellules ou certaines de leurs caractéristiques, et apportent parfois une
information sur la composition de leur paroi. Les deux colorations proposées (coloration
de Gram, coloration de spores) se font sur des bactéries tuées, après préparation d’un
frottis.
1. Préparation d’un frottis bactérien
Les différentes étapes de la réalisation d’un frottis sont l’étalement d’un
prélèvement bactérien sur une lame, le séchage, la fixation. Déposer sur une lame une
petite goutte d’eau. Sous la flamme bleue, prélever, à l’aide d’une anse à ensemencer,
une colonie à étudier et l’écraser dans la goutte d’eau. Laisser sécher à l’air avant de fixer
la préparation à la chaleur en passant la lame 3 fois sur la flamme éclairante (cellules vers
le haut). Le passage doit être rapide (1 s pour l’ensemble de la lame), et effectué d’un
mouvement continu (la lame chauffée doit pouvoir être tenue dans la main sans
ressentir de douleur).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%