de la physiologie à la thérapeutique

62333
Thérapeutique
MASSON
Gynécologie
Gonadotrophines
et fonction ovarienne :
de la physiologie à la thérapeutique
Compte rendu du Symposium International Serono
du 16 janvier 2009, Monaco
Propos recueillis par Christian Rayr

Masson Thérapeutique « Gynécologie »
Gonadotrophines et fonction ovarienne :
de la physiologie à la thérapeutique
Journée organisée par Merck-Serono, Monaco, 16 janvier 2009
Propos recueillis par Christian Rayr
Avant-propos
D’après la communication de Roger Roulier .............................................................. 1
Thème 1 : Bases physiologiques
LH, FSH et folliculogénèse
D’après la communication d’Alain Gougeon .............................................................. 3
Relations structure-activité des gonadotropines
D’après la communication de Yves Combarnous ........................................................... 5
Pharmacogénomique et sensibilité individuelle aux gonadotrophines
D’après la communication de Jean-Noël Hugues ........................................................... 7
Thème 2 : Quelle gonadotrophine pour quelle situation clinique ?
Les hypogonadismes hypogonadotrophiques congénitaux et acquis chez la femme
D’après la communication de Jacques Young .............................................................. 9
Stratégies thérapeutiques en AMP : rôle de la LH
D’après la communication de Peter Humaidan ............................................................ 11
Le recrutement folliculaire excessif
D’après la communication de Didier Dewailly ............................................................ 13
Recrutement folliculaire inadéquat : intérêt de la LH exogène
D’après la communication d’Ernesto Bosch .............................................................. 15
Conclusion : encore des questions
D’après la communication de Bruno Salle ...............................................................17

Gonadotrophines et fonction ovarienne
1
Classe thérapeutique la plus utilisée en médecine de la reproduction, les gonadotrophines ont considérablement
évolué au fil des années. Initialement extraites d’urines de femmes ménopausées, mode de production toujours
valide, ces hormones sont produites aujourd’hui par recombinaison génétique. Ainsi, leur pureté s’est grandement
améliorée, leur activité biologique peut désormais être évaluée précisément, la galénique et les modes d’administra-
tion se sont diversifiés et des associations de FSH et LH sont disponibles dans des proportions variables. Toutefois,
face à cette offre toujours croissante, le clinicien, lui, est souvent dérouté par la multiplicité des publications… aux
conclusions parfois opposées !
Les divergences ont pour origine quatre grandes difficultés liées à l’assistance médicale à la procréation (AMP)
elle-même :
- la finalité du traitement en AMP est la naissance d’un enfant vivant ramené à la maison. Compte tenu de la
fréquence de cet événement, la mise en évidence d’une différence significative entre des protocoles distincts
exige des effectifs importants et qui ne seraient obtenus qu’après un temps de mise en œuvre long, au cours
duquel les traitements et pratiques peuvent évoluer… ;
- les populations étudiées sont souvent peu homogènes et difficiles à définir. C’est le cas, par exemple, des
« mauvaises répondeuses », pour lesquelles la comparaison des publications entre elles est difficile.
- les gonadotrophines utilisées sont diverses, tout comme les doses administrées et le moment de leur utilisation.
- enfin, les traitements associés aux gonadotrophines sont multiples : agonistes et antagonistes de la GnRH
varient par leur nature, leur mode d’administration et les doses utilisées.
À côté de ces difficultés, des progrès notables ont été accomplis dans la connaissance de la physiologie des
gonadotrophines. Il a donc paru utile à la fois de faire le point sur ces acquis théoriques et d’essayer de dégager,
sinon des protocoles consensuels, du moins des notions pratiques destinées à nous aider à répondre aux principales
situations rencontrées en AMP.
Avant-propos
R. Roulier
Institut de médecine de la reproduction (IMR), 6, rue Rocca, 13008 Marseille, France
Correspondance : r[email protected]

Thème 1 : Bases physiologiques
3
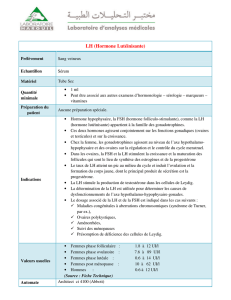
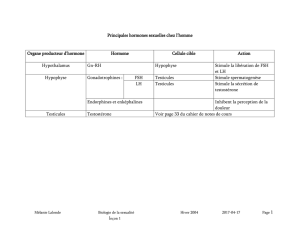
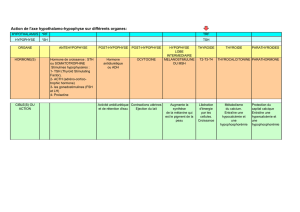
Les hormones hypophysaires LH et FSH jouent un
rôle fondamental dans la régulation de la fonction ova-
rienne, mais n’agissent pas de façon identique lors des
différentes étapes de la croissance folliculaire.
L’entrée en croissance des follicules de la
réserve ovarienne
FSH et LH ne semblent pas impliquées dans l’entrée en
phase de croissance des follicules quiescents. En effet,
ce sont principalement des facteurs paracrines intra-
ovariens qui y contribuent soit par un contrôle positif
(bFGF, LIF, BMP-4 & -7, KGF, GDF9, ECM/activine
A, insuline, androgènes, NGF…) soit, à l’inverse, par
un effet inhibiteur (TGFß, somatostatine et AMH).
La croissance folliculaire basale
Le rôle de FSH et LH reste également très modeste
lors de la croissance folliculaire basale. En effet, la
croissance des follicules est principalement due à la
prolifération des cellules de la granulosa en réponse
à l’action de facteurs locaux produits par l’ovocyte
(GDF9), la granulosa (EGF) et la thèque interne (KGF,
FGF). À l’inverse, l’AMH, autre facteur local, inhibe
la prolifération des cellules de la granulosa et pourrait
être un des facteurs majeurs de contrôle de la vitesse
de croissance folliculaire. Ainsi, le rôle des facteurs
locaux, dont l’une des cibles d’action est le contrôle de
l’activité du récepteur de la FSH, demeure prépondé-
rant. Toutefois, la présence d’une quantité minimale de
FSH paraît indispensable à un développement quantita-
tivement normal de la population folliculaire.
Le follicule sélectionnable et la sélection
du follicule ovulatoire : la FSH prend le
pouvoir
Au stade de la sélection folliculaire, la FSH, jusqu’alors
peu impliquée, exerce une action décisive. En effet, les
follicules sélectionnables deviennent très sensibles à
la FSH endogène circulante qui stimule la proliféra-
tion des cellules de la granulosa. Ils sont également
très sensibles aux gonadotrophines exogènes (hMG
ou rFSH) qui permettent ainsi de recruter l’ensemble
des follicules sélectionnables présents et d’induire une
hyperstimulation ovarienne dite contrôlée.
Lors du cycle naturel dans l’espèce humaine, un seul
follicule est sélectionné. La granulosa des différents
follicules sélectionnables pourrait être plus ou moins
stimulable par FSH, en conséquence, le follicule sélec-
tionné serait celui qui présente la plus grande sensibilité
à FSH. Dans ce processus de sélection physiologique,
les facteurs de croissance, spécifiquement IGF-II,
jouent un rôle fondamental en stimulant l’expression
du gène de l’aromatase et également la prolifération
des cellules de la granulosa. Dans le même temps,
en début de phase folliculaire, la libération de LH est
modifiée, en particulier sa pulsatilité qui est accélérée
du fait de la diminution de la progestérone secondaire
à la régression du corps jaune.
La maturation du follicule ovulatoire :
la LH prend le pouvoir
Jusqu’au milieu de la phase folliculaire, FSH stimule,
en synergie avec l’IGF-II, la prolifération des cellules
de la granulosa, l’expression de l’aromatase (synthèse
Thème 1 : Bases physiologiques
LH, FSH et folliculogénèse
D’après la communication d’Alain Gougeon
Inserm U-865, Faculté de Médecine Laennec, 7, rue Guillaume Paradin, 69372 Lyon cedex 08
Correspondance : [email protected]

Thème 1 : Bases physiologiques
4
d’œstradiol), la production d’inhibine A et l’apparition
des récepteurs à LH (LH-R) à la surface des cellules
de la granulosa. De son côté, LH stimule la production
d’androgènes par la thèque interne.
Au milieu de la phase folliculaire, la FSH par le biais
des FSH-R, présents sur les cellules de la granulosa,
stimule la production d’inhibine A et d’œstradiol par
le follicule sélectionné. Celle-ci, par un effet feedback
négatif sur l’hypophyse induit une chute de la FSH
circulante qui conduira à l’atrésie l’ensemble des fol-
licules non sélectionnés. Les LH-R, toujours présents
sur les cellules de la thèque interne, apparaissent à
la surface des cellules de la granulosa du follicule
sélectionné. LH agit ainsi en synergie avec FSH pour
soutenir la maturation folliculaire.
La LH stimule la production d’androgènes qui sont
aromatisés en œstradiol par la granulosa sous l’in-
fluence de la FSH et de l’IGF-II. L’effet feedback
positif de l’œstradiol sur l’hypothalamus permet le
déclenchement de la décharge ovulante (LH + FSH)
lorsque les niveaux d’œstradiol plasmatiques attei-
gnent le seuil de déclenchement propre à chaque
individu. La décharge ovulante de LH, mais égale-
ment de FSH, est indispensable à la maturation finale
du complexe cumulo-ovocytaire et à l’ovulation. En
effet, le follicule préovulatoire et l’ovocyte connais-
sent alors d’importantes transformations morpholo-
giques. L’expansion du cumulus est liée à la fois à la
FSH et à la LH. La LH est spécifiquement impliquée
dans la maturation nucléaire (reprise de la méiose) de
l’ovocyte.
Après la décharge ovulante, le follicule ovulatoire
présente des bouleversements de sa stéroïdogenèse
et de son angiogenèse. On passe d’une structure qui
produisait de l’estradiol (avant LH) à une structure qui
produit principalement de la progestérone (après LH).
La granulosa est envahie par des capillaires sanguins,
la LH stimulant l’expression du gène codant pour le
VEGF.
Ainsi, le développement du follicule s’accompagne
d’une sensibilité de plus en plus grande à la FSH et à
la LH, qui agissent de façon coordonnée. La stimula-
tion et le développement de la thèque interne sous le
contrôle de LH conduirait à l’atrésie s’il n’y avait pas,
simultanément, prolifération et acquisition de fonc-
tions spécifiques induites par la FSH.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%