Voir - ULB

La Traduction – Synthèse des protéines par l'ARN
Ribosomes : Machinerie de la synthèse protéique
Les ribosomes sont composés d'ARN ribosomal (40%) et de protéines (60%). Il y a deux sous-
unités : la grosse sous-unité (60s – unité svedberg) au dessus de l'ARNm et la petite sous-unité (40s)
en dessous de l'ARNm.
Les ribosomes sont fabriqués dans les nucléoles et synthétisent les protéines sur le réticulum
endoplasmique.
Les ribosomes sont des organites, soit liés au réticulum endoplasmique, soit retrouvés libres dans la
cellule (polysomes)
Le nucléole
Description : ± 2 μm, riche en protéines et en ARN.
Fonctions : Production de l'ARN ribosomal et Transcription d'ADNr en ARN ribosomal (ARNr)
Plusieurs types de Molécules d’ARN
ARN messager --> ARNm : Information - copie de l'ADN (3 à 5 % de l'ARN total). C'est le seul
ARN codant.
ARN ribosomal --> ARNr : Constituant du ribosome et catalyseur de la synthèse protéique (75 à
85 % de l'ARN total)
ARN de transfert --> ARNt : Adaptateur entre ARNm et Acides Aminés (10 à 20 % de l'ARN
total). Le messager porte le plan de la chaine polypeptidique sous la forme de codons. La chaine à
réaliser est une succession d'acides aminés. Pour passer du code à la réalisation effective, il faut une
machine de lecture. Elle est constituée par les ribosomes et les ARN de transfert.
Petits ARNs : il y en a plusieurs sortes. Ils ont un rôle important à jouer dans la traduction, il
détruisent le messager ce qui permet d'éteindre un gène. L'apoptose est très importante à
comprendre car dans certaines cellules, il faut « tuer » des morceaux. Exemple : ARNsi : ARN
interférant.
ARN/Ribosome des Pro- et Eucaryotes
Procaryotes :
Taille du ribosome : 70s : 50s pour la grosse sous-unité, 30s pour l'autre
ARNr : de la grosse unité : 5s et 28s --> synthèse de 34 protéines; de la petite unité : 16s -->
synthèse de 21 protéines
Eucaryotes :
Taille du ribosome : 80s : 60s pour la grosse sous-unité, 40s pour l'autre
ARNr : de la grosse unité : 5s, 28s et 5,8s --> synthèse de 50 protéines; de la petite unité : 18s -->
synthèse de 33 protéines
Outils biochimiques permettant l’étude du trafic vésiculaire
La Centrifugation Différentielle : séparation par différence de densité des compartiments
57

membranaires. La densité est exprimée en unité Svedberg.
Marquage par des acides aminés radioactifs (leucine tritiée)
Mesure des activités enzymatiques
Exemple : une fleur : Arabidopsis thaliana
Organisme « Modèle » en recherche dans le monde végétal.
Premier végétal séquencé.
Petite taille.
Millier de pieds sur un mètre carré.
Cycle de développement court, le cycle graine /plante /graine dure deux mois.
1 plant génère environ 40 000 graines.
C'est un des plus petits génomes connus dans le monde végétal (157 millions de paires de bases,
réparties sur 5 chromosomes)
25 498 gènes
Absence d'intérêts économiques pour cette espèce facilitant la diffusion des informations entre
laboratoires car pas de concurrence.
1ère démonstration en 1994 que l’introduction d’ARN « éteint » certains gènes.
Autre exemple : un ver : Caenorhabditis elegans
Caenorhabditis elegans est un ver transparent d'environ un mm ( appartenant au groupe des
nématodes).
Sert de modèle pour l'apoptose (mort programmé de certaines cellules), pour le vieillissement
cellulaire et pour le développement embryonnaire...
Durée de vie est d'environ trois semaines.
Modèle génétique de compréhension de l'élaboration d'un organisme pluricellulaire. (Sydney
Brenner, John Sulston et Bob Horvitz - Prix Nobel en 2002).
Possède un nombre fixe de cellules. L'adulte « mâle » est composé de 1090 cellules
Au cours de la vie du vers il y a multiplication cellulaire puis mort par apoptose de 131 cellules.
(environ 300 des cellules sont des cellules neuronales, permettant également l'étude du système
nerveux).
Génome : 13 500 gènes répartis sur six chromosomes.
58

L'introduction de molécules d’ARN double brin dans la cellule réduit spécifiquement l’expression
de protéines. Ce phénomène fut alors nommé « interférence ARN »
Les ARNsi ou ARN interférant
Les ARN double brins sont clivés toutes les 21 à 25 paires de bases par une ribonucléase de type III
appelée Dicer
Les ARNsi sont associés à un complexe multiprotéique (le RNA-Induced Silencing Complex-
RISC)
Reconnaissance ARNm et ARNsi --> Extinction
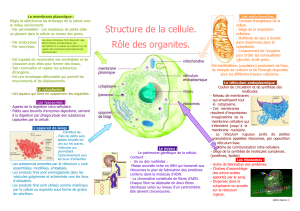
Les Ribosomes
Les ribosomes sont des organites cytoplasmiques qui permettent la synthèse de polypeptides. Ils
sont destinés à « traduire » l’ARN messager en « attachant » les AAs entre-eux, par liaison
peptidique. Ils synthétisent des protéines, en suivant le plan du messager qu’on leur fournit. Les
ribosomes sont des structures composées pour moitié de protéines, pour moitié d’ARN dit
ribosomal.
La microscopie électronique permet de voir que chaque ribosome est constitué de deux sous-unités
de volume et de masse inégales (évalué par la constante de sédimentation). On peut les dissocier par
centrifugation différentielle. On les désigne, ainsi que leurs ARN constitutifs, par leur constante de
sédimentation, exprimée en unités Svedberg.
ARN de transfert
Les ARN de transfert sont d’assez petites molécules d’ARN, dont les caractéristiques sont les
suivantes :
Il y a spécificité de reconnaissance pour un seul acide aminé : il existe autant d’ARN de transfert
différents que d’acides aminés, soit une vingtaine.
Tandis qu’un bout de la molécule est capable de fixer cet acide aminé, l’autre correspond à un
anticodon (séquence complémentaire du codon de l'ARN messager) qui est susceptible de
reconnaître par complémentarité des bases du codon "codant" pour cet acide aminé spécifique sur le
messager. Ils exhibent une forme telle que les ARN de transfert peuvent s’engrener dans un des
deux sites récepteurs prévus à leur intention dans le ribosome. La synthèse du polypeptide
(traduction) nécessite le rapprochement de trois formes d’ARN : le messager, qui porte le plan, le
ribosome, qui catalyse la liaison peptidique, et l’ARN de transfert qui « pêche l’AA » spécifié par le
59

codon du messager.
La traduction
L’ARN messager arrive au ribosome dans lequel viennent se positionner les ARN de transfert
chargés de leur AA spécifique. Chaque ARN de transfert trouve sa place sur un codon de l’ARN
messager. L’AA spécifique s’en détache, et forme un lien peptidique avec l’AA précédent (qui avait
été amené par l’ARN de transfert précédent). La chaîne polypeptidique est alors formée par la
succession des AAs, dans l’ordre imposé par l’ARN messager.
Finalement, la succession des AAs de la protéine correspond exactement à la succession des triplets
formant le gène correspondant de la partie codante de l’ADN.
8. Le réticulum endoplasmique – Golgi - Lysosomes
Réticulum Endoplasmique
Le réticulum endoplasmique est un espace membranaire (composés de membranes protéolipidiques)
ramifié sous forme d’un réseau de « galeries ». C’est le lieu de synthèse des protéines et des lipides.
Il est également un espace ou se concentre du calcium dont nous verrons l’importance, plus avant
dans le cours, dans les processus de « réponse » de la cellule à certains stimuli extracellulaires. Le
RE participe, associé au ribosome, à la synthèse des protéines, au transport et à certaines
modifications post-traductionnelle de celles-ci. Il existe deux types de RE:
Le RE granuleux (REG) participe à la synthèse les protéines et est situé près du noyau et est de fait
en continuité avec la membrane du noyau
Le RE lisse (REL) est plus éloigné du noyau (c’est le lieu de synthèse de certains type des lipides
(stéroïdes).
La surface totale est de 10 à 30 fois celle de la membrane plasmique
Les membranes du réticulum endoplasmique sont plus minces (5 à 6 nm) que celles de la membrane
plasmique (8 nm).
La membrane est enrichie en phosphatidylcholine
Il y a des nombreux enzymes associés à la membrane
C'est un système membranaire de ramifications constitués de chenaux aplatis (saccules) et de tubes
interconnectés
Proportion variable entre Rugueux ou granuleux (REG) et Lisse (REL) selon le type cellulaire
REG : Composé de 70% Protéines et 30 % Lipides, saccules aplaties, présence de ribosomes sur la
face cytoplasmique. C'est le lieu de synthèse et d'un début de maturation des protéines destinées à
l'exportation.
REL : citernes tubulaires. Il synthétise des stéroïdes, des lipides, il sert de lieu de stockage pour les
ions calcium et aide à la détoxyfication.
Les fonctions du REG :
Protéogénèse (Synthèse des protéines – Traduction) : protéines membranaires et protéines à
destinée extracellulaire. Les ribosomes ont l'équipement protéique et enzymatique permettant la
lecture de l'ARN messager conduisant à la synthèse des protéines.
Modification post-traductionelle --> maturation des protéines
60

Réservoir d’ions calcium Ca++ (rôle dans la signalisation cellulaire comme second messager). Il
est stocké sous une forme liée à une protéine.
Détoxification de divers composés toxiques (Ex: C2H5OH; Médicaments, ...) Principalement dans
le foie [Enzyme : cytochrome P450 ] transformation des substrats hydrophobes en composés
hydrophiles (oxydation) permettant leur excrétion (Rein)
Synthèse des stéroïdes et biosynthèse des phospholipides en collaboration avec le REL. Il est
associé aux enzymes nécessaires à cela.
Différences entre les ribosomes libres et ceux liés au REG
Les ribosomes liés produisent les protéines destinées à l'extra-cellulaire et les protéines
transmembranaires.
Les ribosomes non-liés (polysomes) produisent les protéines propres à la cellule pour le
cytosquelette, la mitochondrie, la membrane face cytoplasmique
REG - Synthèse Protéique
Les ribosomes s'associent au REG par le mécanisme suivant: un peptide signal est reconnu par une
particule de reconnaissance du signal (SRP) – Question d'examen! Le SRP se lie à son récepteur qui
le reconnait, celui-ci est localisé à la surface cytosolique du réticulum. Il attache le ribosome au
réticulum. On a la translocation du polypeptide à travers un canal transmembranaire (translocon) et
un clivage de la séquence signal. La protéine synthétisée est enfuie dans la cavité du réticulum.
Modification post-traductionnelle
Il y a ensuite des modifications comme la glycosylation, c'est-à-dire l'addition d’un motif glucidique
(un sucre) sur des Aparagine (Asn) (protéine). La protéine est transformée en glycoprotéine. Cela
modifie la solubilité, la stabilité et la charge des protéines. Le groupe glucidique sert de signal de
61
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%