Chapitre 2 : Identification des espèces chimiques par chromatographie

Chapitre 2 : Identification des espèces chimiques par chromatographie Terminale S Spécialité
1ère Partie : Extraire et identifier les espèces chimiques
Page 1 sur 2
P
h
HH
h
Rf=
Chapitre 2 : Identification des espèces chimiques par chromatographie
Objectifs :
- Connaître le principe de la chromatographie de partage et de la chromatographie d’adsorption ;
La chromatographie est une technique de séparation et d’identification des espèces chimiques
contenues dans un mélange.
Pour réaliser une chromatographie, on utilise :
¾ un solvant ou un mélange de solvants, appelé éluant, qui constitue la phase mobile ;
¾ un support fixe (du papier, de la silice fixée sur un support en aluminium …) qui constitue la phase
stationnaire.
Le mélange à analyser est faiblement dilué dans un peu d’éluant puis déposé en très petite quantité sur la
phase stationnaire : c’est l’étape de dépôt.
On met ensuite en contact la phase stationnaire avec l’éluant.
L’éluant migre par capillarité (chromatographie sur papier et chromatographie sur couche mince CCM) ou
par gravité (chromatographie sur colonne) le long de la phase stationnaire entraînant les différents
constituants du mélange : c’est l’étape d’élution.
La vitesse de migration des constituants du mélange donc leur séparation dépendra des affinités de
chacune des espèces chimiques avec la phase stationnaire et la phase mobile.
I. Un exemple de chromatographie de partage : la chromatographie sur papier
I.1. Principe de la chromatographie sur papier
La chromatographie sur papier fait partie des chromatographies de partage.
Cette technique est basée sur la différence de solubilité des espèces chimiques entre les deux phases.
La phase mobile (ou éluant) est constituée d’un solvant ou d’un mélange de solvants ;
La phase stationnaire correspond à de l’eau adsorbée sur la cellulose du papier.
L’éluant migre par capillarité le long du papier.
L’espèce chimique qui est plus soluble dans l’éluant migrera plus rapidement.
C’est une technique moins bonne que les autres ; elle ne permet pas une séparation quantitative.
Exemple : Séparation des colorants
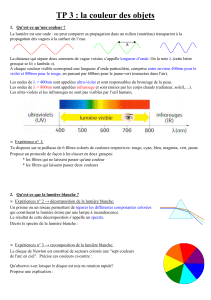
I.2. Le rapport frontal
Chaque espèce chimique est caractérisée par son
rapport frontal, noté Rf.
C’est le rapport entre la distance parcourue par l’espèce
chimique, notée h, et la distance parcourue par l’éluant, notée H.
Le rapport frontal est indépendant de la longueur de la plaque
utilisé, il ne dépend que de l’espèce chimique et des
conditions expérimentales. Il s’exprime sans unité.
J V B

Chapitre 2 : Identification des espèces chimiques par chromatographie Terminale S Spécialité
1ère Partie : Extraire et identifier les espèces chimiques
Page 2 sur 2
II. Deux exemples de chromatographie d’adsorption : la C.C.M. et la colonne
La chromatographie sur couche mince C.C.M. et la chromatographie sur colonne font parties des
chromatographies d’adsorption.
Dans cette technique les espèces chimiques peuvent se fixer momentanément sur la phase
stationnaire (interactions électrostatiques) : c’est le phénomène d’adsorption.
Les espèces chimiques sont également plus ou moins solubles dans l’éluant.
La vitesse de migration des espèces chimiques dépendra donc de ses interactions avec la phase
stationnaire et de leur solubilité dans l’éluant.
II.1. La chromatographie sur couche mince C.C.M.
La phase mobile est un solvant ou un mélange de solvants ;
La phase stationnaire est fixée sur une feuille de papier d’aluminium ou une plaque de verre.
L’éluant migre par capillarité le long de la phase stationnaire.
C’est une technique qui permet un contrôle simple et rapide de la pureté d’une substance
organique ; elle permet entre autre de suivre l’évolution d’une transformation chimique.
Exemple : Voir TP N°2 de Chimie Spécialité
II.2. La chromatographie sur colonne
La phase mobile est un solvant ou un mélange de solvants ;
La phase stationnaire (gel de silice ou d’alumine) remplit une colonne.
L’éluant migre par gravité le long de la phase stationnaire.
C’est une technique qui permet une séparation quantitative mais qui consomme beaucoup d’éluant !
Exemple : Voir TP N°2 de Chimie Spécialité
1
/
2
100%