Nom

Spécialité CHIMIE 2009/2010
Classe TS 4, 5 et 6
L
Ly
yc
cé
ée
e
J
Je
ea
an
n
X
XX
XI
II
II
I,
,
R
Re
ei
im
ms
s
1/2
Nom Prénom
Cours
PARTIE 4 EXTRAIRE ET IDENTIFIER
I- Les différentes extractions
a. Extraction solide-liquide : il s’agit de séparer une espèce chimique organique de la
matière solide dans laquelle elle est mélangée. Cette technique fait appel aux propriétés
des solvants.
i. Macération
ii. Infusion
iii. Décoction
b. Extraction liquide-liquide : technique qui consiste à transférer les espèces
chimiques présentes dans une phase (souvent aqueuse) vers une autre
phase (alors organique) dans laquelle ils sont solubles.
c. Hydrodistillation : technique qui permet
d’extraire à une température fixe et relativement
basse (voisine de 100°C), sous pression
atmosphérique normale, un mélange d’eau et de
composés organiques sans détruire ces derniers.
II- Les solvants
1) Définition : un solvant est un composé, le plus souvent liquide, qui a le pouvoir de dissoudre
des espèces chimiques.
2) Types de solvants :
Solvants apolaires (barycentre des charges négatives et des charges positives confondus) :
propanone, dichlorométhane, éthoxyéthane.
Solvants polaires (le barycentre des charges positives et des charges négatives sont distincts) :
eau, alcools, ammoniac, acides carboxyliques
Remarque : deux espèces chimiques de même polarité sont solubles entre elles ;
une substance chimique non polaire est insoluble dans un solvant polaire ( et inversement).
3) Choix d’un solvant d’extraction :
a. Miscibilité des solvants : le solvant d’extraction ne doit pas être miscible avec celui
dans lequel se trouve l’espèce chimique à extraire. Ils doivent former deux phases
distinctes lorsqu’ils sont mélangés.
Les espèces chimiques organiques à extraire doivent être plus solubles (le plus
possible) dans le solvant extracteur que dans celui où elles se trouvent initialement.

Spécialité CHIMIE 2009/2010
Classe TS 4, 5 et 6
L
Ly
yc
cé
ée
e
J
Je
ea
an
n
X
XX
XI
II
II
I,
,
R
Re
ei
im
ms
s
2/2
b. Coefficient de partage : on appelle coefficient de partage d’une espèce chimique E
entre deux solvants (l’un constituant la phase aqueuse, l’autre la phase organique) le
rapport :
aq
org
]E[
]E[
D
où:
org
]E[
est la concentration de l’espèce chimique E dans le solvant organique ;
aq
]E[
est la concentration de l’espèce chimique E dans la phase aqueuse.
Plus D est élevée, plus l’extraction est efficace.
III- Les chromatographies
La chromatographie permet de séparer les constituants d’un mélange.
Les substances migrent le long d’un support et atteignent des niveaux différents selon leur solubilité
(plus ou moins grande) dans l’éluant.
Pour un même éluant et un même support, une même espèce migre de la même façon qu’elle soit pure
ou dans un mélange. Elle est caractérisée par son rapport frontal :
Y
X
Rf
où X : hauteur franchie par l’espèce depuis la ligne de base ;
Y : hauteur franchie par l’éluant depuis la ligne de base.
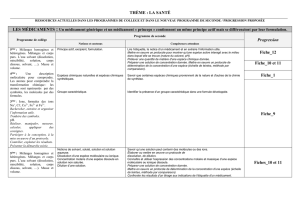
Interprétation :
B et C sont des mélanges qui contiennent plusieurs espèces différentes.
B contient, entre autres espèces, l’espèce A dont le rapport frontal est :
Y
X
R1
1f
.
B et C contiennent une même espèce chimique dont le rapport frontal est :
Y
X
R2
2f
.
1) Chromatographie sur papier : basée sur la différence de solubilité des espèces chimiques à
séparer entre deux phases : phase mobile (ou éluant) et phase stationnaire (ou fixe).
Les composants migrent à des vitesses différentes selon leur solubilité dans l’éluant, qui
migre par capillarité.
2) Chromatographie sur couche mince (CCM) :
La phase mobile (éluant) est un solvant (ou mélange de solvants) qui progresse le long
d’une phase stationnaire ;
La phase stationnaire est fixée sur une plaque.
3) Chromatographie sur colonne : la phase solde (alumine, silice) remplit une colonne de
longueur et de section variable ; l’échantillon (en solution concentrée) est déposée en haut de
la colonne.
A
B
C
A
B
C
Ligne de base
Ligne de front
Y
X1
X2
1
/
2
100%