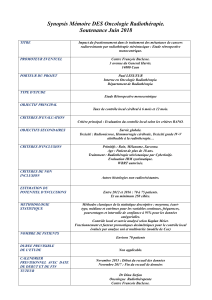
Concevoir la sécurité : la chaîne de production en radiothérapie

Société d'Ergonomie de Langue Française - 43
ème
congrès, Ajaccio 17-19 septembre 2008
Concevoir la sécurité : la chaîne de production en radiothérapie
Adelaide Nascimento, Pierre Falzon
CRTD - Laboratoire d’Ergonomie (Cnam) – 41 rue Gay-Lussac 75005 Paris, France
Sylvie Thellier, François Jeffroy
Institut de Radioprotection et Sûreté Nucléaire (IRSN) – Fontenay aux Roses, France
Résumé
La radiothérapie est un traitement à visée curative ou palliative, impliqué dans environ 60%
des traitements des patients atteints de cancer. La chaîne de traitement relève d’un processus
complexe associant 4 métiers (médecin, physicien médical, dosimétriste, manipulateur) dans
une succession d’étapes de préparation et d’administration de la dose. A partir de la
description de la chaîne de construction du traitement, seront mis en évidence dans ce texte
les potentielles sources de dérives et d’erreurs présentes à chaque étape. L’enjeu est de faire
en sorte que la production de la sécurité des soins en radiothérapie soit davantage vécue
comme une production collective. Dans ce sens, nous nous intéressons à la gestion de risques
en considérant les sources de défaillances humaines et organisationnelles, et cela dans toutes
les phases du processus, de la prescription à la délivrance de la dose de rayonnement
ionisant.
Mots-clé : radiothérapie ; sécurité ; coopération ; conception.
1. Introduction
La radiothérapie est un traitement à visée curative ou palliative, impliqué dans environ 60%
des traitements des patients atteints de cancer. Elle peut - seule ou associée à la chirurgie et/ou
la chimiothérapie - combattre un certain nombre de tumeurs malignes, mais aussi soulager les
algies dues à des métastases. Parmi les avantages de son utilisation, on retrouve une bonne
efficacité car 40% des malades guéris ont été traités par radiothérapie ; un traitement
conservateur, évitant les mutilations ; et, un bon rapport coût efficacité (en France, 12
milliards d’euros/an sont destinées au traitement des cancers, dont 0,9 pour la radiothérapie).
Etant donné la possibilité de traitements co-adjuvants (radiothérapie, chirurgie,
chimiothérapie), la décision thérapeutique pour le traitement d’un cancer, quel qu’il soit, doit
être prise en présence d’au moins un chirurgien, un oncologue médical et un oncologue
radiothérapeute : ce sont les réunions de concertation pluridisciplinaire (RCP) (Le Bourgeois,
2006). La décision prise d’une radiothérapie, l’oncologue radiothérapeute prend en charge le
patient et prescrit les doses et les techniques du traitement.
Ces prescriptions seront appliquées et/ou optimisées au fur et à mesure de la préparation du
traitement par différents intervenants : les dosimétristes, les physiciens médicaux, les
manipulateurs et les radiothérapeutes. Dans les situations les plus fréquentes les techniques de
traitement sont protocolaires, c’est-à-dire les paramètres d’irradiation font l’objet de
l’application des règles, aboutissant à une solution unique. Or dans certains cas, les choix
d’une solution de traitement ne résultent pas de la simples application des règles et cela pour
diverses raisons : taille de la tumeur, morphologie du patient, disponibilité des machines, etc.

Les différents acteurs de la chaîne doivent ainsi construire une solution optimale pour un cas
où la procéduralisation trouve ses limites.
On y identifie des caractéristiques d’une activité de conception, au sens où des praticiens
différents pourraient produire des solutions différentes, et d’une activité de coopération où la
distribution du travail se fait en fonction des connaissances et compétences d’acteurs qui
partagent le même but proximal – la délivrance des soins (Schmidt, 1991). Ces activités sont
parfois conjointes (physicien/dosimétriste-médecin ; physicien/dosimétriste-manipulateurs ;
médecin-manipulateurs) mais le plus souvent séquentielles, comportant des phases de
construction, proposition, évaluation et validation des solutions.
Le caractère collectif de la construction du traitement peut être à la fois une source de
défaillance (Nascimento & Falzon, 2008a, 2008b) et une ressource pour la sécurité (pour un
exemple en oncologie cf. Mollo, 2007). L’analyse choisie dans ce texte est plutôt la première :
à partir de la description de la chaîne de construction du traitement, seront mis en évidence les
potentielles sources de dérives et d’erreurs présentes à chaque étape. Les pistes d’amélioration
de la sécurité des soins sont présentées en section 4.
Cette recherche est menée dans le cadre d’un projet de partenariat entre l’Institut de
Radioprotection et Sûreté Nucléaire (IRSN) et le Laboratoire d’Ergonomie du Conservatoire
National des Arts et Métiers. L’enjeu est de faire en sorte que la production de la sécurité des
soins en radiothérapie (production dont l’amélioration est bien l’objectif général de la
recherche) soit davantage vécue comme une production collective. Dans ce sens, nous nous
intéressons à la gestion de risques en considérant les sources de défaillances humaines et
organisationnelles, et cela dans toutes les phases du processus, de la prescription à la
délivrance de la dose de rayonnement ionisant.
2. Méthodologie
Notre terrain de recherche est un établissement privé participant au service public hospitalier,
localisé en région Parisienne. Il s’agit de l'un des plus importants hôpitaux en Europe et le
plus important en France dédié à la cancérologie.
Une première phase de la recherche était destinée à la familiarisation avec le domaine de la
radiothérapie. Pour cette première approche, une méthodologie ethnographique a été
privilégiée, permettant de décrire l’ensemble de la chaîne ainsi que d’identifier les dérives et
erreurs potentielles à chacune de ses étapes. Elle a consisté :
• en 8 semaines d’observations ouvertes (48h) sur les divers postes du plateau technique
de radiothérapie de l’hôpital : simulateurs (2 semaines), scanner (3 jours), salles de
dosimétrie (2 semaines), salle de consultation médicale (2 jours) et postes
d’administration de la dose (3 semaines) ;
• à des entretiens informelles réalisés lors des observations avec les différents acteurs
responsables de la chaîne de traitement, et
• à la participation, en tant qu’observatrice, aux réunions mensuelles du groupe de
gestion des événements indésirables (GEI) (5 réunions observées).
Ce choix méthodologique nous a permis de repérer les problèmes les plus fréquents relatifs
aux dysfonctionnements humains et organisationnels de la chaîne de traitement en
radiothérapie, mais pas de les quantifier. Des observations systématiques sur le terrain sont
prévues à cette fin.

3. Résultats
3.1 La construction du traitement en radiothérapie
La chaîne de traitement relève d’un processus complexe associant 4 métiers (médecin,
physicien médical, dosimétriste, manipulateur) dans une succession d’étapes de préparation et
d’administration de la dose.
L’informatique y est omniprésente et permet des progrès sur les techniques de traitement, la
précision et l’efficacité de la dose. Dans ce processus, chaque étape et chaque interface porte
un risque de défaillance qui pourra aboutir à un écart entre la dose prescrite par le médecin et
celle que sera effectivement délivrée au patient.
En connaissance de ces risques imminents, les professionnels de radiothérapie mènent depuis
longtemps des démarches autour de l’assurance qualité, que ce soit de la mise en service d’un
nouveau système ou au titre des contrôles réguliers des plans de traitement individuels
(Rosenwald, 2002). Les accidents
1
survenus en radiothérapie au cours des dix dernières années
ont beaucoup marqué les professionnels du domaine, et ont mis en évidence – au-delà des
facteurs techniques – l’influence des facteurs humains et organisationnels dans la sécurité des
soins.
3.1.1 La phase de préparation : le flou, les pressions du réel et les déviations à la
prescription
Des études sur la fiabilité du collectif soulignent que celui-ci peut s’avérer comme un premier
facteur de fiabilité surajoutée aux individus, à la fois dans les situations d’entraide, de partage
des tâches, d’aide à la décision et dans les situations de détection et récupération d’un nombre
important d’erreurs et dérives (Sasou & Reason, 1999). D’une autre part, le collectif peut être
« une source d’infiabilité surajoutée à l’infiabilité de ses membres » (Marc et Amalberti,
2002). Dans ce dernier cas, les auteurs citent plusieurs facteurs bien connus depuis longtemps,
qui peuvent fragiliser la sécurité du groupe : la qualité et la quantité de la communication dans
le groupe, la taille du groupe, les ambiguïtés et le pluri-adressage de la communication, entre
autres.
La préparation des séances de traitement en radiothérapie se fait à travers une succession
d’étapes de natures différentes, engageant les professionnels de quatre métiers (médecins,
physiciens médicaux, dosimétristes et manipulateurs). Elle constitue une traduction successive
de la prescription médicale par chaque métier, et englobe 11 étapes
2
, comme suit :
1
L’accident d’Epinal, devenu public en septembre 2006, est considéré comme étant le plus grave de l’histoire de
la radiothérapie : les défaillances técnico-organisationnelles dateraient de 1989, depuis l’installation du service.
Environ 4500 patients traités pour le cancer de la prostate seraient susceptibles d’avoir reçu un surdosage de 7%,
i.e. 2% supérieur à la limite tolérée. Parmi eux 24 ont reçu un surdosage plus sévère (>20%) et 5 sont décédés.
2
Données issues du terrain
.
L’organisation des étapes peut différer selon les établissements de soins.

Etape Professionnel
1 Acquisition des données anatomiques et de positionnement du
patient Manipulateurs – poste de
simulation
2 Préparation du dossier informatique pour le médecin Dosimétriste
3 Choix du volume à irradier Médecin
4 Conception de la dosimétrie Dosimétriste
5 Evaluation et validation de la dosimétrie Médecin
6 Evaluation et validation de la dosimétrie Physicien médical
7 Transfert des données vers le poste de traitement Physicien médical
8 Ajout des données sur le positionnement du patient en poste de
traitement + appropriation du dossier
Manipulateurs – poste
d’administration
9 Deuxième contrôle sur la dosimétrie 2
ème
physicien médical
10 Image de contrôle de positionnement du patient en poste de
traitement - séance 0, sans irradiation
Manipulateurs - poste
d’administration
11 Evaluation et validation de l’image de contrôle Médecin
Tableau 1 : Phase de préparation du traitement
La méconnaissance du contenu et/ou rythme de l’ensemble des actions à réaliser pourra
conduire à des retards qui se répercuteront sur toute la chaîne de production. Il a été constaté
dans nos observations que la durée de 8 à 10 jours, théoriquement fixée pour la préparation du
dossier, n’est que rarement respectée. On retrouve des cas extrêmes où les 11 étapes sont
réalisées sur une seule journée. Cela peut être dû à l’introduction imprévue d’un nouveau
patient, à des pannes d’appareils ou à l’accumulation des retards. Le dernier exemple semble
le plus fréquent.
Les risques d’erreurs et dérives, déjà considérables en situation normale, se multiplient dans
ce type de situation dégradée. Toute la chaîne de traitement sera bouleversée, mobilisant les
divers acteurs sur une période de temps très courte et différente de celle initialement prévue.
La prise en charge du patient sera réalisée au détriment des conditions organisationnelles
établies au départ. Les dossiers seront remplis dans l’urgence, leurs contrôles successifs
seront réalisés rapidement, voire pas réalisés, l’étape d’appropriation du dossier par les
manipulateurs en poste (théoriquement fixée à 24 heures avant le début de traitement) ne sera
pas effectuée dans les bons délais. Les images de contrôle risquent de ne pas être validées à
temps par le médecin.
Ainsi, il apparaît clairement dans nos observations que la situation idéale pour l’application
des procédures explicites n’est pas celle quotidiennement vécue. Le grand nombre de patients
à traiter, la nécessité de court-circuiter certaines étapes afin de satisfaire les besoins
thérapeutiques, l’implication des personnels dans des tâches multiples obligent à des
déviations aux règles et ne favorisent pas le partage entre acteurs de la santé.
L’attribution des causes d’accidents à des facteurs organisationnels était déjà présente dans
l’ouvrage de Reason sur l’erreur humaine (Reason, 1990) et dans les travaux de Rasmussen
(1997) sur les migrations organisationnelles. Ce dernier propose un constat : au cours du
temps, tout système tend à dériver vers la violation des règles mises en place au moment de sa
création. Selon Rasmussen, la dérive provient d’une tendance générale à un accroissement de

la performance globale du système et la recherche de plus d’avantages individuels. A l’heure
actuelle, les migrations organisationnelles vers des pratiques risquées apparaissent comme le
nouvel horizon de la fiabilité.
Par ailleurs, il a été observé sur notre terrain que les procédures ne sont pas toujours bien
définies et/ou explicitées. Nous prenons l’exemple de la feuille d’irradiation, qui représente la
traçabilité de la construction collective de la thérapeutique. Celle-ci doit être soigneusement
remplie avant son arrivée en poste de traitement, car elle représente la prescription du
traitement et comporte des données complémentaires par rapport au logiciel informatique.
Néanmoins, cette feuille peut arriver vierge au poste de traitement : les opérateurs parfois se
reposent sur leurs collègues des étapes suivantes en ce que concerne le remplissage des
feuilles, puisque la procédure de remplissage ne spécifie pas clairement ni les acteurs ni les
étapes concernés.
Cette situation met en évidence deux autres questions sur l’implicite dans la prescription.
D’une part, au même temps que la feuille papier semble un élément important pour le
traitement, elle pourrait arrivée au poste d’administration sans contenir aucune donnée.
Devant cette situation, il n’existe pas un consensus sur le fait que les manipulateurs aient le
droit de réaliser les traitements fondés uniquement sur le dossier informatique (sans la feuille
d’irradiation). D’autre part, la double source d’information (dossier papier/dossier
informatique) peut en soi constituer une source d’erreur. Dans le service observé, dans les cas
où des divergences entre les données papier/logiciel échapperont aux contrôles de dossiers, il
n’existe pas une référence explicite sur l’information à suivre pour exécuter le traitement. En
effet, un manipulateur peut réaliser un traitement muni du dossier informatique mais sans
avoir la feuille d’irradiation.
Certes l’existence de procédures bien formalisées ne constitue pas une garantie de sécurité car
d’une part toute procédure comporte une part d’incomplétude liée au caractère imprévu des
situations, et d’autre part le non-suivi des procédures seul ne conduit pas nécessairement à
l’accident. Or en l’absence d’une règle explicite, en présence d’une nécessité fonctionnelle
immédiate, chacun aura tendance à construire ses propres règles, basées sur son expérience
professionnelle et/ou personnelle, son éthique, sa représentation du risque. Un problème de
gestion de la sécurité peut se poser lorsque l’opérateur ne connaît pas suffisamment les
résultats de son action d’invention, d’adaptation (Dekker, 2003), ou encore quand cet
ensemble de “normes” construites individuellement n’est pas mis en commun, discuté,
collectivement (Falzon, 2007).
3.1.2 La phase d’administration : entre automatismes et variabilité
Les manipulateurs sont les responsables de la délivrance des soins. Sur le poste
d’administration, ils suivent les procédures résultant de la prescription médicale. Le travail en
binôme est prescrit par l’organisation et vise au-delà du partage de tâches, le contrôle mutuel.
En début de séance, des contrôles sont réalisés sur le dossier afin de s’assurer que le
traitement à effectuer correspond bien à la prescription et aux données dosimétriques. Ces
vérifications servent également comme ressources pour l’action. Des images de contrôle de
positionnement sont réalisées lors des séances 1, 2 et 3, puis une fois par semaine.
Une séance de radiothérapie dure environ 15 minutes. Dix minutes sont destinées à la mise en
place du patient en salle d’irradiation. Les 5 minutes restantes concernent l’activation des
faisceaux programmés informatiquement. Cette manipulation se fait entre l’ordinateur et le
pupitre de la salle de commande. Pour la majorité des cas, entre chaque faisceau, les
manipulateurs reviennent en salle d’irradiation, l’objectif étant le réglage des paramètres
(position de la table, par ex.) pour le faisceau suivant.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%