les orbitales et les nombres quantiques

Fiche 30
LES ORBITALES
ET LES NOMBRES QUANTIQUES
L’équation de Schrödinger
Les différentes formes des nuages électroniques de chaque couche électronique est en
fait une solution de l’équation de Schrödinger.
La forme mathématique des solutions de cette équation est extrêmement complexe et
nécessite de solides compétences mathématiques. Nous nous contenterons de
mentionner les valeurs numériques possibles de quatre nombres spécifiques apparaissant
dans les solutions de l’équation de Schrödinger : les nombres quantiques.
Le nombre quantique principal n.
C’est un nombre entier : n = 1, 2, 3, ...
Ce nombre définit l’énergie de l’électron
Ce nombre correspond à la couche électronique.
Le nombre quantique secondaire (ou azimutal) l
C’est un nombre entier : l = 0, 1, 2, ... , n-1
Ce nombre définit les sous-couches électroniques
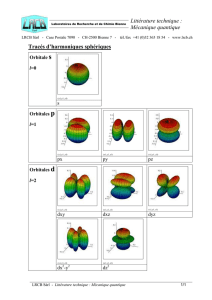
l = 0 : orbitales s,
l = 1 : orbitales p,
l = 2 : orbitales d,
l = 3 : orbitales f.
Le nombre quantique tertiaire (ou magnétique) m
C’est un nombre entier compris entre –l et + l.
Ce nombre définit l’orientation de l’orbitale atomique.
Le nombre quantique de spin s
C’est un demi-entier, la valeur pouvant être +1/2 ou –1/2.
Ce nombre définit la rotation de l’électron sur lui-même (moment cinétique
intrinsèque).

Fiche 30 Les orbitales et les nombres quantiques
- 2 -
Les solutions de l’équation de Schrödinger : les orbitales s, p, d, f
Nombres quantiques
n
l
m
s
Orbitales
1
0
0
+1/2 et –1/2
1 s
2
0
0
+1/2 et –1/2
2 s
1
-1
+1/2 et –1/2
0
+1/2 et –1/2
2 p
1
+1/2 et –1/2
3
0
0
+1/2 et –1/2
3 s
1
-1
+1/2 et –1/2
0
+1/2 et –1/2
3 p
1
+1/2 et –1/2
2
-2
+1/2 et –1/2
-1
+1/2 et –1/2
0
+1/2 et –1/2
3 d
1
+1/2 et –1/2
2
+1/2 et –1/2
Le principe « Aufbau »
À l'état fondamental d'un atome (l'état dans lequel il se trouve habituellement), la
configuration électronique suit le principe « Aufbau ». D'après ce principe, les électrons se
placent dans des états électroniques d'énergie croissante. Par exemple, le premier
électron se place dans l'état présentant le niveau d'énergie le plus bas, le second électron
dans l'état suivant de plus basse énergie, etc...

Fiche 30 Les orbitales et les nombres quantiques
- 3 -
L'ordre dans lequel les sous-couches sont remplies est défini selon la règle de
Klechkowski (cf. diagramme de Klechkowski ci-dessous) :
Diagramme de
Klechkowski
1
/
3
100%