Traitement du diabète de type 2

Dossier
Dossier
du CNHIM
Revue d’évaluation sur le médicament
ÉVALUATION
THÉRAPEUTIQUE
Traitement
du diabète de type 2 :
place des nouveaux
antidiabétiques oraux
Centre National Hospitalier d’Information sur le Médicament
ISSN 0223.5242
Publication bimestrielle
2001, XXII, 4 SOMMAIRE
2001, XXII, 4

Dossier du CNHIM
Dossier du CNHIM
2001Tome XXII, 3
Tous les articles publiés dans DOSSIER sont le fruit d'un travail collectif, sur
le fond et sur la forme, entre les Rédacteurs-Signataires, le Comité de
Rédaction, et la Rédaction du CNHIM d'une part, le Comité de lecture et cer-
tains experts, spécialistes du sujet traité, d'autre part. Sur chaque sujet, DOS-
SIER du CNHIM ne publie donc pas les opinions de tel ou tel, mais réalise
une analyse scientifique critique, la plus objective possible.
Directeur de la Publication :J.M. Kaiser
RÉDACTION
Rédactrice en chef :M.C. Husson
Secrétaire de rédaction :C. Fréville
Comité de rédaction :D. Dardelle (Suresnes), J.E. Fontan
(Paris), C. Guérin (Paris), I. Jolivet, (Paris), N. Rizzo, B.
Sarrut (Paris).
Secrétariat :M. Bouchot, N. Filomin
COMITÉ DE LECTURE : C. Advenier (Versailles), P. Assayag
(Paris), A. Baumelou (Paris), P. Beaufils (Paris), C. Buffet
(Bicêtre), D. Brossard (Saint-Germain en Laye), D. Cabrol (Paris),
A. Certain (Paris), A. Escousse (Dijon), J.M. Extra (Paris), P.
Faure (Paris), M. Feuilhade de Chauvin (Paris), P. Gayral (Paris),
P.M. Girard (Paris), J.C. Koffel (Strasbourg), P. Maire (Lyon), C.
Montagnier (Paris), M. Ollagnier (St Etienne), B. Quinet (Paris),
M. Samama (Bobigny), X. Sauvageon (Paris), E. Singlas (Paris),
G. Vedel (Paris), J.M. Vetel (Le Mans), T. Vial (Lyon).
IMPRESSION :Express Service Est - Zone industrielle, 2 rue Émile Zola
- 77 450 Montry - Rythme de parution: 6 numéros par an
N° ISSN 0223.5242. N° de commission paritaire : 71987
CENTRE NATIONAL HOSPITALIER
D'INFORMATION SUR LE MÉDICAMENT (CNHIM)
Hôpital de Bicêtre - 78, rue du Général Leclerc - B.P. 11
94272 Le Kremlin Bicêtre cedex
Tél : 01 56 20 25 50 - Fax : 01 46 72 94 56 -
Mél : [email protected]
Le CNHIM est une association indépendante à but non lucratif (loi 1901)
dont la vocation est de dispenser une information rigoureuse et scientifique
sur le médicament.
Président :J.M. Kaiser
Président fondateur :A. Mangeot †
Directrice :M.C. Husson
Promotion-Communication :N. Guillon
Secrétariat-Abonnement :M. Bouchot, N. Filomin
Conseil d'Administration : H. Allemand (Paris), P. Arnaud
(Rouen), F. Ballereau (Nantes), Barreteau H (St Cloud), A.
Baumelou (Paris), A. Becker (Paris), M.C. Bongrand
(Marseille), E. Boury (Lomme), O. Brault (Paris), S. Ferry
(Lyon), J.E. Fontan (Paris), F. Gimenez (Paris), A. Graftieaux
(Chalon sur Marne), C. Guérin (Paris), G. Hazebroucq (Paris),
G. Johanet (Paris), J.M. Kaiser (Paris), J.F. Latour (Lyon) , R.
Leverge (Paris), A.M. Liebbe (Compiègne), C. Penot-Ragon
(Marseille), S Raspaud (Le Kremlin Bicêtre), J.P. Reynier
(Marseille), P. Sado (Rennes), A. Sarfati (Ivry), B. Sarrut
(Paris), B. Van Bockstael (Lomme).
Les articles de Dossier du CNHIM sont indexés dans BIBLIO-
GRAPHIF ®. Le CNHIM a la propriété des textes publiés dans ce
numéro et se réserve tous les droits de reproduction (même partiel-
le), d’adaptation, de traduction, pour tous les pays et par quelque
procédé que ce soit (loi du 11 mars 1957, art. 40 et 41 du Code
Pénal art. 425).
Sommair
Sommaire
e
Échos du CNHIM Jean-Marie Kaiser
Évaluation thérapeutique
Traitement du diabète de type 2 : place des
nouveaux antidiabétiques oraux
Éditorial André Grimaldi
Le diabète de type 2
Introduction
Les différents diabètes
Diabète de type 1 - Diabète de type 2 - Diabètes secondaires
Régulation physiologique de la glycémie
Généralités - Absorption digestive du glucose - Transport du glucose -
Production du glucose - Métabolisme du glucose - Interaction glu-
cose et acides gras - Utilisation du glucose - Récepteur de l'insuli-
ne sur les cellules cibles - Sécrétion d’insuline
Étiologie du diabète de type 2
Physiopathologie du diabète de type 2
Généralités - Anomalies de la sécrétion du pancréas exocrine
Traitements du diabète de type 2
Traitement pharmacologique (antidiabétiques oraux) -Traitement non
pharmacologique
Stratégie
Prise en charge pharmacologique de l’hyperglycémie - Mesures
hygiéno-diététiques - Éducation du patient - Prise en charge des fac-
teurs de risque associés au diabète
Surveillance du patient diabétique de type 2
Suivi biologique - Suivi clinique
Lediabète et ses complications
Description - Dépistage - Nécessité d'une prise en charge intensive précoce
Nécessité d'une prise en charge intensive précoce : les enseigne-
ments de l’UKPDS
Monographies et stratégie thérapeutique
Répaglinide
Rosiglitazone
Acarbose
Miglitol
Perspectives thérapeutiques
Natéglinide et pioglitazone - Autres médicaments en développement
Conclusion
Bulletin d’abonnement
2
4
5
5
6
10
11
13
17
22
23
27
30
41
50
70
79
87
92
Dossier du CNHIM participe à l’ISDB,
réseau international de revues indépendantes
de formation thérapeutique

Dossier du CNHIM 2001, XXII, 4 2
É
Échos du CNHIM
chos du CNHIM
PROPRIETE DE L’INFORMATION : UNE PROTECTION S’IMPOSE
La dématérialisation des supports modifie-t-elle les règles sociales, éthiques, culturelles que se sont données au fil des
siècles les sociétés dites évoluées ?
Le possible est-il souhaitable, acceptable, justifiable ?
Nous voyons tous les limites du droit s’effilocher sous nos yeux, avec ou sans l’accord du législateur, dans des domaines
tels que la propriété littéraire, musicale, ou intellectuelle.
Que deviendront les droits d’auteur dans la société du " p to p ", c’est-à-dire de la communication d’ordinateur à ordina-
teur, sans intervention humaine entre le point de départ et le résultat final ?
Cette hypothèse n’est pas du tout un scénario futuriste destiné à se faire peur, c’est une question que tout créateur et auteur
de bases de données doit se poser.
Nous devons anticiper sur l’utilisation qui va être faite – qui est peut-être déjà faite à notre insu – de nos ordinateurs et des
connaissances que nous y avons placées.
Pouvons-nous ignorer ces risques, ou, les connaissant, laisser faire ?
Non. Nous devons protéger nos données, et ce pour plusieurs raisons.
Tout d’abord pour une raison d’ordre économique, qui est que l’auteur du travail doit être rémunéré. L’un des mythes de
l’internet est de laisser croire que toute information est gratuite, ou devrait l’être. Or,si nous sommes dépositaires d’un
savoir, celui de nos pairs, nous en sommes comptables. Ceci ne signifie pas que nous devions en tirer bénéfice, ceci signi-
fie simplement que ceux qui ont travaillé à mettre en forme ce savoir (les salariés du CNHIM par exemple) seront juste-
ment rémunérés, et que les organismes qui financent le système ne verront pas le produit de leur investissement détourné
par des intérêts contradictoires.
Si un courant de pensée défend actuellement la gratuité de l’information administrative, il ne s’agit pas de mettre cette
information à la disposition d’intérêts privés mais directement à la disposition du public.
Il est donc très différent de faire un site gratuit ouvert au public, et d’alimenter en données gratuites une société qui déve-
lopperait des prestations payantes à partir de ces données.
L’autre raison de garder un œil jaloux sur le produit du travail intellectuel, c’est la responsabilité de l’auteur.
Nous devons contrôler et valider les utilisations dérivées de notre base de connaissance, nous devons être informés en per-
manence des logiciels qui intègrent nos données, et nous devons nous assurer de la qualité du résultat pour l’utilisateur.
Il existe à ce titre un énorme travail à venir pour une association telle que le CNHIM, de manière à rester au cœur d’un
système de connaissances en tant qu’acteur responsable, et non le jouet de " récupérateurs ", qui se comporteraient comme
des " prédateurs ".
Une jurisprudence récente nous a montré que les poursuites judiciaires n’étaient pas toujours efficaces, car le point de vue
du juge ne peut se résumer à celui du moraliste.
Il existe donc un espace légal pour le pillage des données informatisées, mais nous sommes résolus à traquer l’usage illé-
gal de nos données et à sécuriser les produits qui les intègrent.
Jean-Marie KAISER
Président du CNHIM

Traitement du diabète de type 2 :
place des nouveaux antidiabétiques oraux
Jean-Paul Fagot* et la participation du comité de rédaction
*Pharmacien, INSERM U 444, Faculté de médecine Saint-Antoine, 75 012 Paris
Remerciements : B Estour (Saint-Étienne), A Grimaldi (Paris), L Perlemuter (Créteil), A Salle (Angers), C Verny (Bicêtre).
Dossier du CNHIM 2001, XXII, 4
Évaluation
thérapeutique
3
Résumé.
Le diabète de type 2 ou diabète non-insulino-dépendant constitue un important problème de santé publique en raison des
nombreuses complications qu’il entraîne. Son étiologie est diverse.
C'est l'activité endocrine du pancréas, celle-ci impliquant l'insuline surtout (cellules ß) et le glucagon (cellules α), qui assu-
re la stabilité de la glycémie en équilibrant la production (glycogénolyse et néoglucogenèse) et la consommation de glu-
cose par la cellule musculaire. La régulation de la sécrétion de l'insuline est assurée par un “détecteur de glucose”, situé sur
la membrane des cellules ß, qui intervient dès que la glycémie dépasse 6 mmol/l.
La physiopathologie du diabète de type 2 se caractérise par une perturbation de la sécrétion des hormones pancréatiques
(diminution de la sécrétion d'insuline, augmentation de la sécrétion de glucagon) et une insulino-résistance se traduisant
par une diminution du captage de glucose par les muscles et par une augmentation de la production hépatique de glucose.
Ces défauts sont amplifiés chez les diabétiques obèses. Le défaut de la sécrétion d'insuline s’expliquerait par une gluco-
toxicité (effets délétères de l’hyperglycémie) et une lipotoxicité chez le patient obèse. L’hyperglucagonémie résulterait de
la glucotoxicité.
Les antidiabétiques oraux, associés à des mesures hygiénodiététiques, représentent le traitement initial et essentiel du dia-
bète de type 2. Les sulfamides et les glinides, en se liant à un récepteur spécifique de la cellule β, stimulent la sécrétion
d'insuline.La metformine agit essentiellement en diminuant la production hépatique de glucose mais potentialiserait aussi
l'action de l'insuline au niveau musculaire. Les thiazolidinediones ou glitazones stimulent l'adipogénèse ce qui conduit à
une diminution des acides gras libres circulants et améliore la captation du glucose. Les inhibiteurs des alphaglucosidases
(acarbose, miglitol) retardent l'hydrolyse des glucides en monosaccharides et donc leur absorption ; ils ont essentiellement
une action sur la glycémie post-prandiale. Sulfamides, glinides, glitazone et metformine diminuent l’insulino-résistance.
La prise en charge du diabète doit être globale, intensive et précoce, pour prévenir les complications micro et macrovas-
culaires. Les objectifs glycémiques se traduisent en objectifs d'hémoglobine glyquée (HbAlc). L'éducation du patient est
àlabase de la prise en charge du diabète de type 2 et de son suivi : conseils individualisés pour une diététique et pour une
activité physique appropriées. Aucun hypoglycémiant n’est nécessaire si l'HbA1c est ≤6,5 % avec régime seul. Une mono-
thérapie hypoglycémiante orale est nécessaire en cas d'échec du régime et d’HbAlc > 6,5 %. En cas d’échec, une bithéra-
pie orale, associant deux médicaments de deux classes différentes est instaurée. En cas d'échec de la bithérapie orale maxi-
male, l’administration d'insuline est recommandée, sauf cas particuliers. La prise en charge des facteurs de risque doit être
d'autant plus active que le risque cardio-vasculaire global du patient est élevé. L'arrêt d’un éventuel tabagisme est impé-
ratif. La pression artérielle recherchée est de 140-80 mmHg. Une thérapeutique hypolipidémiante est recommandée.
Répaglinide, rosiglitazone, acarbose, miglitol, natéglinide et pioglitazone font l’objet de monographies détaillées.
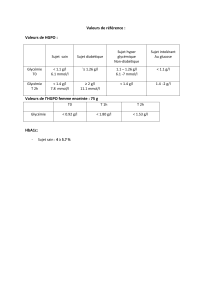
Le suivi biologique repose essentiellement sur la détermination de l’HbA1c effectuée tous les 3 à 4 mois. D'autres dosages
sont éventuellement utiles : fructosamine, peptide C et insulinémie qui permettent d'apprécier l'état d'insulinorésistance.
Le suivi clinique consiste dans le dépistage et la prise en charge des complications du diabète.
Les complications du diabète de type 2 peuvent être : 1) d’ordremétabolique :coma acido-cétosique (rare) ; coma par aci-
dose lactique ; coma hyperglycémique hyperosmolaire non cétosique ; hypoglycémie, 2) d’ordre dégénérative :micro-
angiopathie (néphropathie, rétinopathie, neuropathie périphérique) et macro-angiopathie ( maladie coronaire, artériopathies
des membres inférieurs), 3) d’ordre infectieux (appareil urinaire).
Le dépistage du risque vasculaire nécessite un examen clinique, un électrocardiogramme, un suivi de la pression artériel-
le et un bilan lipidique Un bilan ophtalmologique, rénal et neurologique régulier est recommandé.
Mots clés :acarbose, diabète type 2, antidiabétique oral, hémoglobine glyquée, hyperglycémie, insuline, metformine,
miglitol, natéglinide, pioglitazone, régime, répaglinide, revue, rosiglitazone.
Évaluation thérapeutique Traitement du diabète de type 2

Diabète de type 2 : quelle stratégie thérapeutique ?
Alors que nous allons disposer de 5 classes pharmacologiques d’hypoglycémiants oraux, se pose avec acuité la question
de la stratégie thérapeutique optimale du diabète de type 2. En effet, si l’étude du DCCT a permis de définir la stratégie
optimale du traitement du diabète de type 1, il n’en a pas été de même de l’étude UKPDS (United Kingdom perspective
diabetes study) pour le diabète de type 2. Cette étude avait été à l’origine conçue pour comparer des monothérapies, à la
suite de l’ancestrale UGDP, qui avait jeté la suspicion sur le risque cardio-vasculaire induit par les sulfamides hypoglycé-
miants. Il faut donc d’abord s’interroger sur les grandes leçons de l’UKPDS, qui à notre avis, sont au nombre de trois.
1°) abaisser la glycémie est efficace pour réduire les complications de micro et de macroangiopathie. Plus précisément,
abaisser de un point l’hémoglobine glyquée (HbA1c) permet de diminuer sur 5 à 10 ans de 30 % les complications de
microangiopathie et de 10 à 15 % les complications de macroangiopathie. En la matière, il n’y a pas de seuil mais un conti-
nuum à partir des valeurs normales, si bien que l’objectif théorique idéal est la normalisation de l’HbA1c.
2°) le diabète est une maladie silencieuse, diagnostiquée souvent trop tardivement, si bien que dans 30 % des cas, il exis-
te déjà des complications de micro et de macroangiopathie lors du diagnostic.
3°) le diabète est une maladie évolutive avec une détérioration progressive de l’insulino-sécrétion expliquant que chaque
année, 5 % environ des patients ne répondent plus aux sulfamides hypoglycémiants. La cause de cette défaillance insuli-
no-sécrétoire, la part de l’inné et de l’acquis, restent inconnues : s’agit-il d’une altération fonctionnelle ou d’une réduction
du nombre de cellules ß ? quel est l’origine de cet " épuisement " : l’hyper-insulinisme lui même, l’hyperglycémie ou l’hy-
perlipidémie ?
Ces leçons, à défaut d’apporter des preuves, entraînent les convictions et suscitent les interrogations du clinicien :
-il faut traiter tôt, dès que l’HbA1c dépasse la normale,
- il faut recourir rapidement à des associations de médicaments insulino-sécréteurs et insulino-sensibilisateurs au lieu d’at-
tendre l’échec de la monothérapie à posologie maximale,
-dans la mesure où aucune trithérapie n’a démontré à ce jour son bénéfice, il ne faut pas retarder l’heure de l’insulino-
thérapie en commençant par une injection d’insuline retard au coucher, associée aux hypoglycémiants oraux dans la jour-
née. Dès que la glycémie à jeun dépasse 1,60 ou 1,80 g/l, en tout cas dès que l’HbA1c dépasse 8 % selon les recomman-
dations de l’ANAES.
Quelle sera la place des glinides, ces " sulfamides like " de durée d’action courte, à risque hypoglycémique diminué mais
àpuissance inférieure au glibenclamide ? Sûrement la trouveront-ils au début de la maladie, vraisemblablement en asso-
ciation précoce à la metformine, peut être préférentiellement chez le sujet âgé, ou encore chez l’insuffisant rénal à haut
risque hypoglycémique.
Quelle pourra être la place des glitazones, seule vraie nouveauté pharmacologique, dont le bénéfice thérapeutique à long
terme n’est pas encore évalué ? Vraisemblablement, leur indication élective sera le diabète avec insulino-résistance pré-
dominante, en association avec la metformine, en raison de leur synergie d’action. De plus, les glitazones apportent l’espoir
d’une protection de la cellule ß. En attendant les résultats des études de morbi-mortalité et de stratégie thérapeutique …
Pr. André Grimaldi
Service de diabétologie et métabolisme
Groupe hospitalier La Pitié-La Salpétrière
75 651 Paris cedex 13
Dossier du CNHIM 2001, XXII, 4 4
É
Éditorial
ditorial
Évaluation thérapeutique Traitement du diabète de type 2
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
1
/
90
100%