Deux innovations diagnostiques majeures dans la prise en charge

Au-delà de l’examen clinique, limité pendant des millénaires au
seul toucher rectal , deux innovations majeures ont radicalement
modifié la prise en charge diagnostique du cancer de la prostate
et ont dicté les stratégies codifiées que la plupart des urologues
appliquent dorénavant.
BIOPSIES PROSTATIQUES
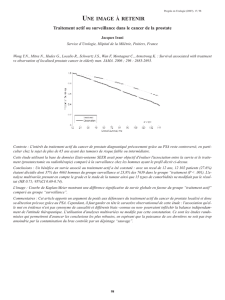
Initiées en 1951, les biopsies périnéales de la prostate, puis
transrectales deux ans plus tard, ont permis de poser formellement
le diagnostic de cancer [1, 2]. Leur mode de réalisation était alors
rudimentaire, basé sur la clinique, et utilisait l’archaïque repérage
au doigt avec biopsie à l’aiguille (Figure 1). Le rendement
diagnostique était alors faible puisqu’il s’agissait seulement de
confirmer histologiquement des tumeurs cliniquement évidentes.
Les inconvénients étaient nombreux, avec notamment le spectre
de l’infection iatrogène, toujours grave avant l’ère des antibiotiques.
La technique a ensuite évolué avec l’introduction progressive de
la cytoponction prostatique en 1960 [3].
L’innovation diagnostique majeure dans le cadre du diagnostic
histologique est apportée par l’échographie, mise à profit pour
guider les biopsies prostatiques. Depuis son invention en 1958,
l’échographie a d’abord été utilisée dans les explorations
abdominales [4]. Il faudra attendre 1974, pour que l’échographie
transrectale soit décrite et utilisée dans l’étude spécifique de la
glande prostatique [5]. L’analyse morphologique de la prostate
s’avèrera a posteriori peu rentable pour le diagnostic. Le couplage
simultané de l’échographie et des biopsies systématisées des zones
suspectes à l’image, met en lumière la sensibilité médiocre de
l’échographie pour le diagnostic [6]. Elle sera donc finalement
utilisée pour le repérage des zones de biopsies, afin de les
systématiser dans l’espace pour effectuer une étude cartographique
plus rigoureuse de la glande [7]. D’un point de vue strictement
anatomopathologique, l’innovation majeure provient des travaux
de Gleason, dont le score histo-pronostique, rapporté en 1966,
est devenu un facteur pronostique incontournable [8-10].
ANTIGÈNE PROSTATIQUE SPÉCIFIQUE (PSA)
La recherche dans le domaine biologique a mené à la découverte
du PSA, un marqueur incontournable aujourd’hui dans le prise en
charge du cancer de la prostate. Découverte en 1950, cette protéine
de la famille des kallicréines spécifique de l’organe prostatique
connaît un regain d’intérêt en 1969, lorsque sont mis en évidence
des anticorps dirigés spécifiquement contre le “Prostate Specific
Antigen ou PSA” dans le sérum des patients [11, 12]. L’existence
de ces anticorps a également été prouvé dans le sperme, avant de
devenir un dosage sanguin en pratique courante [13, 14].
L’identification de cette glycoprotéine de 240 acides aminés,
ayant un rôle dans la liquéfaction du sperme, a fait couler beaucoup
d’encre avant de devenir un outil diagnostique essentiel [15]. Le
PSA intégre le bilan systématique du cancer de la prostate après
la conférence de consensus sur la stratégie de prise en charge
proposée en 1992 [16, 17].
Depuis, le dosage du PSA est devenu l’élément central du bilan
du cancer de la prostate tant dans le bilan d’extension initial que
dans le suivi thérapeutique [18-21]. Son utilisation s’est encore
accrue avec l’utilisation du ratio PSA libre/PSA total, et, plus
récemment de la « densité » ou de la « vélocité » du PSA
(accroissement annuel) [22-24]. In fine,le PSA permet de
déterminer le risque de cancer de la prostate, en fonction d’un seuil
international retenu à 4 ng/ml, mais dont la valeur fait toujours
l’objet de discussion d’experts [21, 25, 26].
Progrès en Urologie (2007), 17 285-286
Deux innovations diagnostiques majeures dans la prise
en charge du cancer de la prostate
Jean-Dominique DOUBLET, Jean-Nicolas CORNU, Morgan ROUPRÊT
285
Figure 1. Biopsie prostatique par voie transrectale

L’association systématique du couple “dosage sérique du PSA et
biopsies de la prostate” a conduit progressivement à élaborer une
stratégie de diagnostic et de suivi consensuelle telle que nous la
connaissons aujourd’hui. Dans un second temps, les travaux de
Partin ont aidé à la stadification des cancers de la prostate, associant
les paramètres de ces nouveaux outils pour affiner l’évaluation de
la pathologie [27]. L’utilité des tables de Partin est désormais
reconnue par la communauté et peut conforter le clinicien dans
son évaluation pronostique. La définition des caractéristiques
évolutives des tumeurs en fonction de multiples paramètres (stade
clinique, PSA, différenciation tumorale) permet d’identifier, au sein
de cette maladie très hétérogène, des sous-groupes de tumeurs
de pronostics différents, permettant de porter des indications
thérapeutiques appropriées au profil moléculaire de chaque
individu.
REFERENCES
1. GRABSTALD H, ELLIOTT JL. Transrectal biopsy of the prostate.
JAm Med Assoc, 1953; 153: 563-5.
2. RINKER JR, SHUMAN WG. Perineal punch biopsy of the prostate
with statistical analysis. Trans Southeast Sect Am Urol Assoc, 1951;
19: 113-8.
3. FRANZEN S, GIERTZ G, ZAJICEK J. Cytological diagnosis of
prostatic tumours by transrectal aspiration biopsy: a preliminary
report. Br J Urol, 1960; 32: 193-6.
4. DONALD I, MACVICAR J, BROWN TG. Investigation of abdominal
masses by pulsed ultrasound. Lancet, 1958; 1: 1188-95.
5. WATANABE H, IGARI D, TANAHASI Y, HARADA K, SAITO
M. Development and application of new equipment for transrectal
ultrasonography. J Clin Ultrasound, 1974; 2: 91-8.
6. FORNAGE BD, TOUCHE DH, DEGLAIRE M, FAROUX MJ,
SIMATOS A. Real-time ultrasound-guided prostatic biopsy using a
new transrectal linear-array probe. Radiology, 1983; 146: 547-8.
7. HODGE KK, MCNEAL JE, TERRIS MK, STAMEY TA. Random
systematic versus directed ultrasound guided transrectal core biopsies
of the prostate. J Urol, 1989; 142: 71-4; discussion 74-5.
8. ROACH M, 3RD, WEINBERG V, SANDLER H, THOMPSON I.
Staging for prostate cancer: time to incorporate pretreatment prostate-
specific antigen and Gleason score? Cancer, 2006.
9. SOULIE M, BARRE C, BEUZEBOC P, CHAUTARD D, CORNUD
F, ESCHWEGE P, et al. Cancer de la prostate. Prog Urol, 2004; 14:
913, 915-55.
10. VILLERS A, MOUTON D, REBILLARD X, CHAUTARD D,
RUFFION A, STAERMAN F, et al. Conditions de réalisation et
schéma de ponctions lors d’une première série de biopsies prostatiques.
Prog Urol, 2004; 14: 144-53.
11. ABLIN RJ, BRONSON P, SOANES WA, WITEBSKY E. Tissue- and
species-specific antigens of normal human prostatic tissue. J Immunol,
1970; 104: 1329-39.
12. ABLIN RJ, PFEIFFER L, GONDER MJ, SOANES WA. Precipitating
antibody in the sera of patients treated cryosurgically for carcinoma
of the prostate. Exp Med Surg, 1969; 27: 406-10.
13. KURIYAMA M, WANG MC, PAPSIDERO LD, KILLIAN CS,
SHIMANO T, VALENZUELA L, et al. Quantitation of prostate-
specific antigen in serum by a sensitive enzyme immunoassay.Cancer
Res, 1980; 40: 4658-62.
14. WANG MC, VALENZUELA LA, MURPHY GP, CHU TM.
Purification of a human prostate specific antigen. Invest Urol, 1979;
17: 159-63.
15. WANG MC, PAPSIDERO LD, KURIYAMA M, VALENZUELA
LA, MURPHY GP, CHU TM. Prostate antigen: a new potential
marker for prostatic cancer. Prostate, 1981; 2: 89-96.
16. PARRA RO. The present role of prostatic specific antigen (PSA) as
atumor marker in carcinoma of the prostate. Mo Med, 1991; 88:
349-52.
17. SHETTY SD, CERNY JC. The current role of prostatic acid
phosphatase and prostate-specific antigen in the management of
prostate cancer. Henry Ford Hosp Med J, 1992; 40: 93-8.
18. BAUVIN E, MOLINIER L, DERVAUX B, SOULIE M,
LATORZEFF I, BACHAUD JM, et al. Cout et efficacité des stratégies
de prise en charge thérapeutiques du cancer localisé de prostate:
étude de faisabilité en population générale. Prog Urol, 2003; 13:
618-23.
19. REBILLARD X, DAVIN JL, SOULIE M. Traitement par HIFU du
cancer de la prostate: revue de la littérature et indications de traitement.
Prog Urol, 2003; 13: 1428-56.
20. RICHAUD P, MOREAU JL, BEUZEBOC P, REBILLARD X,
VILLERS A, PEYROMAURE M, et al. Suivi du cancer de la prostate.
Recommandations du comité de cancérologie de l’Association
Française d’Urologie. Prog Urol, 2005; 15: 586-92.
21. SOULIE M, REBILLARD X, VILLERS A. Dépistage du cancer de
la prostate. Prog Urol, 2003; 13: 1272-5.
22. BENSON MC, WHANG IS, PANTUCK A, RING K, KAPLAN SA,
OLSSON CA, et al. Prostate specific antigen density: a means of
distinguishing benign prostatic hypertrophy and prostate cancer. J Urol,
1992; 147: 815-6.
23. CARTER HB, MORRELL CH, PEARSON JD, BRANT LJ, PLATO
CC, METTER EJ, et al. Estimation of prostatic growth using serial
prostate-specific antigen measurements in men with and without
prostate disease. Cancer Res, 1992; 52: 3323-8.
24. PRESTIGIACOMO AF, STAMEYTA. Clinical usefulness of free and
complexed PSA. Scand J Clin Lab Invest Suppl, 1995; 221: 32-4.
25. AMLING CL. Prostate-specific antigen and detection of prostate
cancer: What have we learned and what should we recommend for
screening? Curr Treat Options Oncol, 2006; 7: 337-45.
26. NEAL DE, LEUNG HY, POWELL PH, HAMDY FC, DONOVAN
JL. Unanswered questions in screening for prostate cancer. Eur J
Cancer, 2000; 36: 1316-21.
27. PARTIN AW, KATTAN MW, SUBONG EN, WALSH PC, WOJNO
KJ, OESTERLING JE, et al. Combination of prostate-specific antigen,
clinical stage, and Gleason score to predict pathological stage of
localized prostate cancer. A multi-institutional update. JAMA, 1997;
277: 1445-51.
286
1
/
2
100%