EGZAMIN MATURALNY Z CHEMII DLA KLAS DWUJĘZYCZNYCH

ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU
ROZPOCZĘCIA EGZAMINU!
Miejsce
na naklejkę
MCH-R2_1F-082
EGZAMIN MATURALNY
Z CHEMII
DLA KLAS DWUJĘZYCZNYCH
Arkusz w języku francuskim
Czas pracy 80 minut
Instrukcja dla zdającego
1. Sprawdź, czy arkusz egzaminacyjny zawiera 10 stron (zadania
1 – 20). Ewentualny brak zgłoś przewodniczącemu zespołu
nadzorującego egzamin.
2. Rozwiązania i odpowiedzi zapisz w miejscu na to
przeznaczonym przy każdym zadaniu.
3. W rozwiązaniach zadań rachunkowych przedstaw tok
rozumowania prowadzący do ostatecznego wyniku oraz
pamiętaj o jednostkach.
4. Pisz czytelnie. Używaj długopisu/pióra tylko z czarnym
tuszem/atramentem.
5. Nie używaj korektora, a błędne zapisy wyraźnie przekreśl.
6. Pamiętaj, że zapisy w brudnopisie nie podlegają ocenie.
7. Możesz korzystać z karty wybranych tablic chemicznych, linijki
oraz kalkulatora.
8. Na karcie odpowiedzi wpisz swoją datę urodzenia i PESEL.
Nie wpisuj żadnych znaków w części przeznaczonej
dla egzaminatora.
Życzymy powodzenia!
MAJ
ROK 2008
Za rozwiązanie
wszystkich zadań
można otrzymać
łącznie
50 punktów
Wypełnia zdający przed
rozpoczęciem pracy
PESEL ZDAJĄCEGO
KOD
ZDAJĄCEGO

Egzamin maturalny z chemii dla klas dwujęzycznych
Arkusz w języku francuskim
2
Questionnaire à choix multiples
Dans les exercices de 1 à 8, entourez la lettre correspondant à la réponse correcte.
Exercice 1. (1 point)
Une caractéristique, parmi les suivantes, ne s’applique pas aux (électrolytes) solides
ioniques. Laquelle ?
A. Ils libèrent des ions en solution.
B. Ils sont insolubles dans l’eau.
C. Ils conduisent le courant en solution aqueuse.
D. Ils sont dissociés en solution aqueuse.
Exercice 2. (1 point)
Lequel des composés chimiques suivants ne possède pas de liaison covalente ?
A. H2S
B. NH3
C. KCl
D. O2
Exercice 3. (1 point)
La formule générale d’un acide carboxylique saturée est :
A. CnH2n+1 O
B. CnH2n O2
C. CnH2n+2 O2
D. CnH2n O
Exercice 4. (1 point)
Lequel de ces ions ne donne pas de précipité avec les ions hydroxyde OH– ?
A. Fe2+
B. Al3+
C. Cu2+
D. Na+
Exercice 5. (1 point)
Sachant que le sodium possède un électron de valence et que l’ iode en possède 7, quelle
formule représente un composé stable ?
A. NaI
B. Na3 I4
C. Na I7
D. Na7 I

Egzamin maturalny z chemii dla klas dwujęzycznych
Arkusz w języku francuskim
3
Exercice 6. (1 point)
Quelle est la formule du corps pur composé d’ aluminium et de sulfate (VI) ?
A. Al(SO4)3
B. 2 Al 3(SO4)
C. Al2 (SO4)3
D. Al SO4
Exercice 7. (1 point)
Quelle est la valence du fer dans Fe(OH)2 ?
A. I
B. II
C. III
D. IV
Exercice 8. (1 point)
Quand la seule différence entre deux atomes est leur nombre de neutrons, ces atomes sont
appelés :
A. isomères.
B. isobares.
C. isothermes.
D. isotopes.
Exercice 9. (6 points)
Compléter le tableau suivant sur le modèle de la première ligne :
Nom de l’atome Symbole
A et Z
Composition
du noyau
Structure
électronique
Période
(ou ligne de la
classification)
Ion qu’il aura
tendance
à former
Fluor 19
9F 9 protons,
10 neutrons K2 L7 II F–
19 protons,
20 neutrons
14 neutrons
K2 L8 M3

Egzamin maturalny z chemii dla klas dwujęzycznych
Arkusz w języku francuskim
4
Informations pour les exercices 10 à 20
L’alcool benzylique, le benzaldéhyde et l’acide benzoïque sont trois espèces chimiques très
utilisées qu’ on peut extraire de certains végétaux où ils sont présents en faible quantité.
Pour faire face à une demande croissante, on les prépare industriellement par oxydation
ménagée du toluène C6H5 – CH3 .
L’alcool benzylique, avec l’un de ses esters l’acétate de benzyle, contribue au parfum des fleurs
de narcisse et de jasmin. Il est présent dans les abricots, les amandes ou les asperges.
Le benzaldéhyde est responsable de l’odeur caractéristique des amandes, des noyaux de cerises
ou du sirop d’orgeat.
L’acide benzoïque est utilisé comme conservateur alimentaire. On le trouve aussi dans certaines
baies rouges ou dans l’encens très odorant des églises orthodoxes, fabriqué à partir de gomme
benjoin, d’où il tire son nom. Il apparaît aussi au cours de la fabrication des fromages.
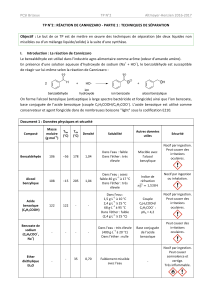
Espèce chimique Alcool benzylique Benzaldéhyde Acide benzoïque
Masse molaire M ( g.mol–1 ) 108 122
Formule :
Semi développée
Topologique
C6H5 – CH2 OH
Densité à 20°C 1,04 1,06 1,32
Température de fusion (°C) – 15,3 –26,0 122,0
Température d’ébullition (°C) 205 179 249
Solubilité dans l’eau à 20°C (en g.L–1) 34 0,13 2,1
On donne les masses molaires atomiques :
MH = 1,0 g.mol–1 ; MC = 12,0 g.mol–1 ; MO = 16,0 g.mol–1
Exercice 10. (1 point)
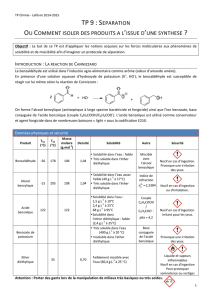
Formules topologiques et semi développées :
On donne la formule topologique du benzaldéhyde :
Ecrire sa formule semi développée : ………………………………………….
Exercice 11. (1 point)
Retrouver par le calcul la masse molaire de benzaldéhyde :
Calcul :
Réponse :

Egzamin maturalny z chemii dla klas dwujęzycznych
Arkusz w języku francuskim
5
Exercice 12. (4 points)
12.1. (3 points)
Ecrire sous quel état physique (solide, liquide ou gaz) se trouve à 20°C :
- L’alcool benzylique : ………………………………………………………….………………..
- Le benzaldéhyde : ………………………………………………………………………………
- L’acide benzoïque : ……………………………………………………………………………..
12.2. (1 point)
Ecrire dans quel intervalle des températures ces composés sont liquides ?
…………………………………………………………………………………………………...….
Exercice 13. (3 points)
Ecrire le nom de l’espèce chimique :
- qui donne un précipité rouge brique avec la liqueur de Fehling (réactif de Trommer) chauffée :
………………………………………………………………………………………………………
- dont la solution donne une teinte rouge sur du papier pH : ……………………………………….
- dont la solubilité dans l’eau est la plus élevée : ……………………………………………...……
Exercice 14. (2 points)
On place une éprouvette vide sur une balance et on règle le zéro avec la fonction « tare ».
On y verse avec précaution un volume V = 20,0 mL de benzaldéhyde.
Quelle valeur de la masse affichera la balance ?
Calcul :
Réponse :
Exercice 15. (6 points)
On veut préparer un volume V= 500 mL d’une solution aqueuse d’ alcool benzylique
de concentration c = 3,0.10 –2 mol.L-1 .
15.1. (2 points)
Calculer le nombre de mole d’ alcool benzylique à apporter :
Calcul :
Réponse :
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%