sciences de la vie ue 3v513 travaux pratiques

2015-2016
LICENCE DE SCIENCES ET TECHNOLOGIES
MENTION : SCIENCES DE LA VIE
UE 3V513
TRAVAUX PRATIQUES :
ETUDE ENZYMATIQUE ET STRUCTURALE DE LA
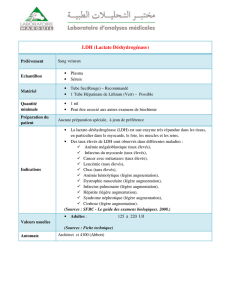
LACTATE DESHYDROGENASE
Vous disposez d’une version du polycopié sur les sites de documents de cours de l’UPMC.
Une version papier vous sera distribuée le jour du TP ou pendant les cours.
Début des TP : 8h30.
APPORTER LE JOUR DU TP :
Une blouse en coton.
Un marqueur fin permanent ;
Une calculatrice
Une clé USB (utile pour sauvegarder vos courbes et vos données après traitement
informatique)
LIEU du TP de BIOCHIMIE :
Bâtiment B, 2ème étage

2
2
Organisation des TP
Ces travaux pratiques sont organisés sur une journée de 8h30 à 18h:
- la journée se décomposant comme suit:
Matinée : Etude de l’activité enzymatique de la LDH (dosage de l’activité
enzymatique par chacun des étudiants puis étude de la fonction de
saturation).
Pause déjeuner de 1 heure
Après-midi : Traitement des données à l’aide du logiciel Kaleidagraph
Visualisation de la structure 3D de la LDH avec le logiciel PyMOL
Vous manipulerez dans la mesure du possible en binôme (exceptionnellement en
trinôme).

3
3
Introduction et but des travaux pratiques.
1. Etude de l’activité enzymatique
Les lactates déshydrogénases (LDHs) sont des enzymes largement distribuées dans la plupart
des tissus animaux, des microorganismes et des plantes. Elles catalysent en anaérobiose la
dernière étape de la glycolyse : la réduction du pyruvate en lactate (fermentation lactique).
De nombreux microorganismes fermentent le glucose en acide lactique. Dans les tissus
animaux, lorsque l’apport d’oxygène est insuffisant pour assurer une oxydation aérobie du
NADH produit dans la glycolyse, le NAD+est régénéré à partir du NADH par la réduction du
pyruvate en lactate. Cependant certains tissus ou types cellulaires (rétine, cerveau, érythrocytes)
produisent du lactate à partir du glucose dans des conditions aérobies normales.
Le lactate produit par les tissus musculaires lors d’une activité intense (anaérobie) est excrété
dans le flux sanguin puis récupéré par le foie pour régénérer du glucose par gluconéogenèse. Le
cycle des réactions qui comprend la conversion du glucose en lactate dans le muscle et la
conversion du lactate en glucose dans le foie est appelé cycle de Cori.
Au cours de ces travaux pratiques, vous apprendrez à doser l’activité de la LDH dans le
sens de la production du lactate et vous étudierez la fonction de saturation de la LDH par
le pyruvate : Vi = f([Pyruvate])
2. Etude de la structure quaternaire de la LDH
Les LDHs de mammifères sont des protéines oligomériques qui existent sous plusieurs
formes moléculaires (isoenzymes), avec deux gènes de structure correspondant à deux types de
sous-unités appelées M (pour muscle) et H (pour cœur). En combinant une analyse des LDH
par électrophorèse sur gel de polyacrylamide en présence de SDS (ou SDS-PAGE) et par
chromatographie d’exclusion moléculaire, vous pourrez calculer la masse moléculaire d’une
sous-unité ainsi que celle de l’enzyme native. Vous déduirez le nombre de sous-unités
constituant la structure IVaire de la protéine.
3. Visualisation de la structure de la LDH à l’aide du logiciel PyMOL
Les structures tridimensionnelles des LDHs de plusieurs sources sont connues et déposées dans
une banque de donnée accessible à tous : la Protein Data Bank (ou PDB). Nous nous
intéresserons particulièrement à la structure de la LDH de muscle de lapin.
Apres avoir effectué l’exercice proposé sous forme de tutoriel, vous aurez à répondre au
questionnaire présent en fin de polycopié
Pyruvate + NADH + H+ Lactate + NAD+

4
4
1. Etude de l’activité enzymatique
PROTOCOLE DE DOSAGE DE L’ACTIVITE LDH
L’activité de la LDH est dosée dans le sens de la réduction du pyruvate en lactate par le NADH
+ H+ :
La réaction sera suivie par la modification d’absorbance due à l’oxydation du NADH. Le
substrat NADH absorbe à 340 nm avec un coefficient d’extinction molaire εM = 6220 M-1cm-1.
Le NAD+ n’absorbe pas à cette longueur d’onde.
MATERIEL :
- Spectrophotomètre UV-visible.
- Solutions mères :
Tampon phosphate de sodium 200 mM, pH 7
Pyruvate : 20 mM
NADH : 16 mM
- Solution d’enzyme : concentration communiquée le jour des TP
- Cuves en plastique de 1 cm de largeur
MODE OPERATOIRE
Dans une cuve de 1 mL, déposez:
500 µL de tampon phosphate de sodium 200 mM, pH 7
430 µL d’eau distillée (volume suffisant pour 1 mL)
50 µL de pyruvate à 20 mM
-------------------------------------------------------------------------------
Mélanger et régler le zéro du spectrophotomètre à 340 nm.
-------------------------------------------------------------------------------
Ajouter 10 µL de NADH à 16 mM
--------------------------------------------------------------------------------
Mélanger et vérifier que l’absorbance lue soit proche de 0,9
--------------------------------------------------------------------------------
Ajouter 10 µL de LDH
--------------------------------------------------------------------------------
Mélanger et enregistrer la cinétique sur 2 minutes
Après 2 minutes, le spectrophotomètre donnera automatiquement la pente de la droite obtenue
(en ΔA.min-1) qui sera la vitesse initiale Vi de la réaction. Vous verrez avec les enseignants
comment extraire ces données du spectrophotomètre
Pyruvate + NADH + H+ Lactate + NAD+

5
5
NB : - Le NADH pouvant s’oxyder au cours de la journée, il sera conservé sur la glace.
- l’eau est ajoutée de façon à obtenir un volume final de 1 mL : le volume est donc
calculé en prenant en compte tous les autres volumes de réactifs ajoutés par la suite, notamment
les 10 µL de NADH et les 10 µL de LDH. Ici : Vol d’eau = 1000 -500 -50 -10 -10 = 430 µL.
- Il est important de bien mélanger les réactifs en inversant 3 ou 4 fois la cuve
préalablement bouchée avec du Parafilm
- Chaque étudiant devra faire 3 fois le dosage de façon à calculer la valeur moyenne de
la Vi ainsi que l’écart-type et consigner ses résultats dans la feuille se trouvant en fin de
polycopié qu’il devra rendre avec le compte-rendu.
FONCTION DE SATURATION DE LA LDH PAR LE PYRUVATE
Lors de cette expérience, le protocole de dosage de l’activité sera identique au précédent,
excepté que vous ferez varier la concentration de pyruvate (substrat) dans chacune des cuves
que vous préparerez.
Choix de la gamme de concentrations de pyruvate : Cette gamme comportera 18
concentrations (voir tableau ci-après). Le but de cette expérience est donc de mesurer la vitesse
initiale de la réaction pour chaque concentration de pyruvate testée afin de tracer la fonction de
saturation Vi = f([pyruvate])
Vous devrez compléter le tableau suivant en calculant les volumes de pyruvate et d’eau à
prélever et montrez vos valeurs à l’un de vos enseignants avant de commencer les dosages
d’activité.
Concentration
de pyruvate dans
l’essai (mM)
0,02
0,04
0,06
0,08
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
1
1,5
2
4
6
8
Volume de
Tampon (µL)
500
Volume d’H2O
(µL)
479
Volume de
NADH (µL)
10
Volume de
solution mère de
Pyruvate à
20mM (µL)
1
Volume
d’enzyme (µL)
10µl
Enregistrement des cinétiques pendant 30 s
Vi (ΔA.min-1)
Le traitement des résultats se fera en salle d’informatique en utilisant le logiciel Kaleidagraph.
Vous aurez donc à reporter dans un tableur les valeurs des vitesses initiales pour chaque
concentration de pyruvate testée puis représenter vos points expérimentaux Vi = f([pyruvate]).
Le logiciel se chargera d’ajuster automatiquement une courbe « idéale » passant par un
maximum de point expérimentaux et d’extraire les paramètres cinétique de la LDH (Vmax, KM,
etc.).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%