Chimie - TS - Chapitre n°9 - Exemple de transformations forcées

Terminale S
Chimie – Partie C – Chapitre 9 : Exemples de transformations forcées
– Page 1 sur 2
mA
COM
21.77
I
I
électrons
anions
cations
électrode
de cuivre
électrode
de graphite
G
+
–
I
mA
COM
–0.89
I
I
électrons
cations
anions
électrode
de cuivre
électrode
de graphite
1. Qu’est-ce qu’une transformation forcée ?
1.1. Évolution spontanée
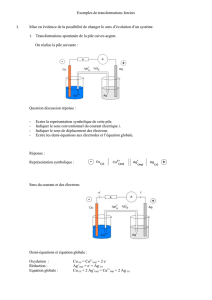
Plaçons dans un tube en U, un mélange d’une solution de dibrome Br2(aq) et de sulfate
de cuivre (Cu
aq + SO–
aq).
Une électrode de graphite plonge dans la solution, par l’une des ouvertures du tube en
U. Une électrode de cuivre plonge dans la solution, par l’autre ouverture. On branche
un ampèremètre aux bornes des électrodes. Ce dernier indique un courant électrique
circulant de l’électrode de graphite vers l’électrode de cuivre.
Le déplacement des charges positives s’effectue dans le sens du courant (cations).
Le déplacement des charges négatives s’effectue dans le sens contraire du sens du
courant (anions en solutions et électrons dans les fils et les électrodes).
Le système fabriqué est une pile :
– l’électrode de cuivre génère des électrons, c’est une oxydation : Cu(s) = Cu2+
(aq) + 2 e–
– l’électrode de graphite est une électrode passive. À sa surface a lieu une réduction
avec le dibrome présent en solution : Br2(aq) + 2 e– = 2 Br–
aq.
Le système chimique évolue spontanément jusqu’à la situation d’équilibre. L’équation
de la réaction est : Cu(s) + Br2(aq) = Cu2+
(aq) + 2 Br–
aq (K = 1025).
1.2. Évolution forcée
La réaction d’équation Cu2+
(aq) + 2 Br–
aq = Cu(s) + Br2(aq) est la réaction inverse de la réaction spontanée mise en
évidence précédemment. Sa constante d’équilibre est donc K’ = 1/K = 10–25.
Il est donc légitime de penser que la réaction entre les ions cuivre II Cu2+
(aq) et les ions
bromure Br–
aq est très limitée, puisque la constante d’équilibre est très faible.
En plaçant, dans un tube en U une solution de sulfate de cuivre et d’ions bromure, on
n’observe effectivement aucune transformation à l’échelle macroscopique. Entre une
électrode de graphite et une électrode de cuivre, un ampèremètre ne détecte aucun
courant (le système chimique ainsi constitué est l’équivalent d’une pile usée !).
Plaçons un générateur entre les bornes du système chimique : on remarque qu’un
courant circule de l’électrode de cuivre vers l’électrode de graphite : c’est un courant
qui circule dans le sens contraire du sens observé précédemment.
Rem. : toutes les réactions chimiques ne peuvent pas être inversées par apport
d’énergie électrique.
Rem. : c’est parfois le solvant qui subit une transformation.
Les électrons sont forcés à quitter l’électrode de graphite : 2 Br–
aq = Br2(aq) + 2 e–.
C’est une oxydation : cette électrode siège d’une oxydAtion est appelée Anode.
Les électrons sont forcés à rejoindre l’électrode de cuivre : Cu2+
(aq) + 2e– = Cu(s).
C’est une réduction : cette électrode siège d’une réduCtion est appelée Cathode.
Le quotient de réaction est Qr = [Braq]
[Cu2+
(aq)].[Br–
aq]2. Dans l’état initial Qr = K : le système
est à l’équilibre. Au cours de la transformation la concentration en Br2(aq) augmente tandis que les concentrations en
Cu2+
(aq) et Br–
aq diminue : le quotient de réaction Qr augmente : il s’éloigne de la constante d’équilibre K.
ou
K’
Qr
Q’r,i
0
Évolution forcée
K’
Qr
Q’r,i
0
Évolution forcée
Lors d’une transformation forcée, le quotient de réaction Qr s’éloigne toujours de la constante d’équilibre K.
Il est possible, pour certains système chimiques, d’inverser le sens d’évolution
spontanée à l’aide d’un apport d’énergie extérieur.
Chapitre 9 : Exemples de transformations forcées

Terminale S
Chimie – Partie C – Chapitre 9 : Exemples de transformations forcées
– Page 2 sur 2
I
I
anions
cations
électrodes
de graphite
Anode
Cathode
dichlore
dihydrogène
G
+
–
2. Application à l’électrolyse
2.1. Définitions
2.2. Bilan de matière
Lors d’une électrolyse effectuée à intensité constante, la charge (ou quantité d’électricité) passant d’une électrode à
l’autre est : Q = I.t. Cette charge correspond à N(e–) circulant, sous l’action du générateur, d’une électrode à
l’autre : Q = N(e–).e. Or N(e–) = n(e–).NA, donc Q = n(e–).NA.e. En utilisant la constante de faraday : Q = n(e–).F.
Si l’on souhaite déterminer la quantité de matière d’une espèce produite ou consommée sur l’une des électrodes, on
utilise la demi-équation électronique s’effectuant, lors de l’électrolyse, à cette électrode : on en déduit la relation
entre la quantité de matière de l’espèce chimique considérée et le nombre n(e–) d’électrons échangés.
2.3. Électrolyse d’une solution aqueuse de chlorure de sodium
Lorsque l’on réalise l’électrolyse d’une solution aqueuse de chlorure de sodium (eau
salée) les espèces chimiques présentes sont : Na+
aq, Cl–
aq et H2O(l).
L’expérience montre que les ions sodium Na+
aq n’interviennent pas chimiquement.
On observe un dégagement gazeux à l’anode et à la cathode. Les couples mis en jeu
font intervenir les ions chlorure et l’eau : Cl2(g)/Cl–
aq et H2O(l)/H2(g).
2 Cl–
aq = Cl2(g) + 2e– : c’est une oxydAtion, le dichlore est produit à l’Anode.
2 H2O(l) + 2e– = H2(g) + 2 HO–
aq : réduCtion, le dihydrogène est produit à la Cathode.
Le bilan de cette transformation est : 2 H2O(l) + 2 Cl–
aq = H2(g) + 2 HO–
aq + Cl2(g).
La phénolphtaléine rosit : le milieu devient basique (apparition d’ion HO–
aq).
L’indigo se décolore : c’est une preuve de l’apparition du dichlore.
Rem. : lorsqu’on ne sépare par le dichlore des ions hydroxyde HO–, on obtient de l’eau
de Javel par réaction de dismutation : Cl2(g) + 2 HO–
aq = Cl–
aq + ClO–
aq + H2O(l)
2.4. Principe de l’accumulateur au plomb
Activité documentaire page 248.
Lors de la charge de l’accumulateur : c’est une transformation forcée
Lors de la décharge de l’accumulateur : c’est une transformation spontanée
2.5. Purification de métaux
2.6. Dépôt d’une couche métallique
– La galvanoplastie : on dépose par électrolyse, une fine couche métallique sur un objet dans le but d’obtenir un
moule (fabrication des CD et DVD par galvanoplastie) pour reproduire des objets. http://fr.wikipedia.org/wiki/Galvanoplastie
– La galvanostégie : on dépose par électrolyse, à la surface d’objets conducteurs, une fine couche métallique. Ce
dépôt permet d’améliorer la résistance à la corrosion (chromage ou nickelage) ou l’aspect esthétique des pièces
traitées (dorure, argenture).
3. Autre transformation forcée
D’autres domaines dans la vie, font appel à des transformations forcées. C’est le cas, par exemple, de la
photosynthèse. La source d’énergie permettant d’inverser le sens de la transformation spontanée (respiration) est le
rayonnement lumineux. La nuit, seule la transformation spontanée s’effectue. Le jour, la transformation forcée
s’ajoute à la transformation spontanée.
http://xxi.ac-reims.fr/clemenceau/PhysiqueChimie/simul_ostralo/electrolyse.swf
http://myweb.tiscali.co.uk/chemteach/swf/electrolysis2.swf
On utilise fréquemment l’électrolyse pour obtenir des métaux presque purs. À partir d’une solution contenant un
cation métallique, une réduCtion a lieu à la Cathode : Mn+ + n e– = M(s).
On peut également purifier un métal par électrolyse : l’anode est constituée de ce métal non pur. On impose un
courant électrique entre la cathode et l’anode. Le métal constituant l’anode se dissout dans la solution par oxydation.
On récupère à la cathode le métal quasi pur (par ex. dans le cas du cuivre utilisé dans les câbles électriques on
récupère du cuivre pur à 99,95 % !). L’essentiel des « impuretés » restant dissout dans le bain électrolytique.
Une électrolyse est une transformation forcée, au cours de laquelle un générateur de tension continue impose le
sens du courant électrique, et ainsi les réactions d’oxydoréduction s’effectuant aux électrodes.
L’électrode siège d’une oxydAtion est l’Anode ; l’électrode siège d’une réduCtion est la Cathode.
eau de Javel
Un accumulateur peut être rechargé.
Une pile n’est pas rechargeable !
1
/
2
100%