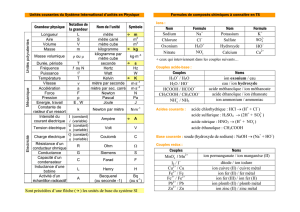
Thermodynamique chimique – Chapitre 2 : Acides et bases en

Exercices d’application (feuille C05)
Lycée Hoche – BCSPT1A – A. Guillerand
Thermodynamique chimique – Chapitre 2 : Acides et bases en solution aqueuse Page 1
Thermodynamique chimique – Chapitre 2 : Acides et bases en
solution aqueuse
Exercices d’application
1
Réactions acido-basiques
1. Dans une solution aqueuse de chlorure dammonium
()
()
acido-basique ayant lieu une fois le solide dissout.
2.
) est une espèce
ampholyte. Donner les deux couples acido-basiques
auquel il appartient et écrire la réaction acido-basique
Remarque : cette réaction est responsable de la
précipitation de la calcite ayant lieu dans des conditions
géologiques particulières (fontaines pétrifiantes,
stromatolithes, etc.)
2
Constante d’acidité et de basicité
Soit le couple acido-basique ion ammonium/ammoniac
(
).
1. dont la constante
standard de réaction est .
Quelle relation vérifie-t- ? ,
en déduire la valeur de .
2.
standard de réaction est la constante de basicité .
Quelle relation vérifie-t- ? En
reprenant la valeur du donnée précédemment,
déterminer la valeur du .
3
Classement des acides et des bases
), un triacide dont les
:
; ;
1. Donner les couples acido-basiques successifs
correspondant aux trois acidités.
2. Calculer les successifs correspondant aux trois
3.
devient un acide moins fort (règle à retenir), attribuer
les aux différents couples et construire une
échelle de permettant de classer les différentes
espèces acido-basiques entre elles.
4
Acide/base fort(e)
1.
.
1.1.
1.2. Quelle est la concentration en ion oxonium une
?
2. De late de sodium () solide a été
éthanolate (base forte), une fois la dissolution
complète du solide est de .
2.1. Écrire la réaction de protonation de la base dans
2.2. Quelle est la concentration en ion hydroxyde une
?
2.3. Comment en déduire la concentration en ion
oxonium en solution ? Faire lapplication
numérique.
5
pH d’une solution acide
1. À partir de la concentration en ion oxonium calculée
déterminer le de la solution.
sulfurique
(à la même concentration). On considèrera l
sulfurique comme un diacide fort.
2. Donner léquation de réaction de dissociation de
lacide sulfurique dans leau. Calculer la nouvelle
concentration en ion oxonium et en déduire la
nouvelle valeur du .
3.
4. Connaissez-vous deux autres grandeurs en physique
utilisant une échelle logarithmique ?

Exercices d’application (feuille C05)
Lycée Hoche – BCSPT1A – A. Guillerand
Thermodynamique chimique – Chapitre 2 : Acides et bases en solution aqueuse Page 2
6
Diagramme de prédominance
Soit le couple acido-basique acide éthanoïque/ion
éthanoate de .
1. Tracer le diagramme de prédominance simple de ce
couple.
2. Tracer le diagramme de prédominance à de ce
couple.
3. Question bonus : tracer le digramme de prédominance
pour lequel on néglige une espèce face à une autre si
et non
plus .
7
Diagramme de prédominance pour un
polyacide
est un tétraacide dont les
sont : ; ; ;
1. Tracer le diagramme de prédominance simple des
espèces acido-
diphosphorique.
2. Tracer le diagramme de prédominance pour lequel on
néglige une espèce face à une autre si leurs
-on
dire du cas du triacide ?
8
Diagramme de courbes de répartition
Le diagramme de courbes de répartition des espèces acido-
basiques a été calculé par un logiciel de
simulation. Il est présenté figure 1.
Figure 1 : Diagramme de répartition des espèces acido-
basiques d’un tétraacide
1. Attribuer à chaque courbe la concentration
représente.
2. Certains
diagramme, expliquer comme les retrouver.
3. Existe-t-il un pH pour lequel le milieu contient
majoritairement et presque quantitativement (
) dihydrogéno-diphosphate
?
4. Existe-t-il un pH pour lequel le milieu contient
hydrogéno-diphosphate
? Existe-t-il un pH pour lequel le milieu
contient presque quantitativement (
hydrogéno-diphosphate
?
1
/
2
100%