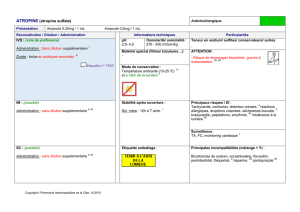
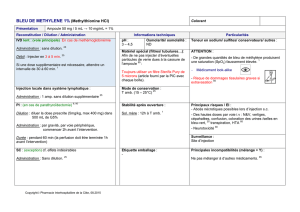
Introduction

Effet de la lumière bleue sur la composition biochimique et
la réponse photosynthétique d’Isochrysis affinis galbana
J. Marchetti*1, T. Jauffrais1, G. Bougaran 1, S. Lefèbvre2, B. Saint-Jean 1, E. Lukomska1, R. Robert 3, J.P. Cadoret 1
1 Laboratoire Physiologie et Biotechnologies des Algues, IFREMER, Rue de l’île d’Yeu BP 21105 44311 Nantes cedex 3, France
2Laboratoire d’Océanographie et Géosciences, UMR CNRS 8187, Station Marine de Wimereux, 28 avenue Foch, 62930 Wimereux, France
Laboratoire Physiologie des Invertébrés, UMR100, IFREMER, Station d’Argenton, Presqu’île du vivier 29840 Argenton en Landunvez, France
Introduction
Isochrysis affinis galbana,
! " #$ % &
% %'
(%
)
Matériels et méthodes
1 – Procédure expérimentale
* +
,-.-/ %
!0.$'%
1+2+.-/
2 – Cultures et suivis
3% !//+ ,-.-/$
T-isoCCAP 927/14 (0/$
&4( !5$
' "
2. 6 +/ &7.
.86/9&&
!D$
!X$ % !8:+ :++ $
(
3 – Mesures et analyses
3;!'$1
P = X . D
T-iso1
!/<*8$
% 0
/<*2
=!.++*$
( a >
?!/<82$!&$?
!)$>(&")!@A3BAC++$
(
&D !" E ($
(% + *++
,-.-/
%"
0/F&
Isochrysisaffinis
galbana! /++$
0 . F
%
T-iso
Résultats
%G qualité spectrale%
T-iso!0$A
(a!0H$!0*$
!IJ*K$ % %
(!08LIJ*K$A
?%
' le taux de dilution T-iso
!IJ*K$ 3
G!IJ*K$
? ( !0 * 8$
!0 H$ A
M
combinaison donnée de taux de dilution et de type de lumière 3
%
N %
(a
0F'@-
(%
0HFO(
(%
0*F&T-iso
(%
08FO&!O&$
?!O)$T-iso
(%
02F3(T-iso
H1 !$
( -(L
%"
Conclusion
En conclusion, cette étude a montré que des modifications sensibles du métabolisme
et de la composition biochimique de T-iso peuvent être induites par l’utilisation d’une
source de lumière de spectre bleu, et amplifiées selon le taux de dilution choisi.
L’orientation métabolique des microalgues offre ainsi une alternative aux régimes par
substitution d’espèces, utilisés classiquement dans les études sur la nutrition des
mollusques bivalves.
'=3
1
/
1
100%