Dépliant du Produit

MONOGRAPHIE DE PRODUIT
Pr OMEPRAZOLE-20
Capsules d’oméprazole à libération retardée
Oméprazole à 20 mg
Norme maison
Inhibiteur de l’H+, K+-ATPase
Sivem Produits Pharmaceutiques ULC DATE DE RÉVISION :
4705 rue Dobrin 8 mars 2017
Saint-Laurent, Québec, Canada
H4R 2P7
www.sivem.ca
Numéro de contrôle : 202693

TABLE DES MATIÈRES
MODE D’ACTION ET PHARMACOLOGIE CLINIQUE ................................................ 3
INDICATIONS ET USAGE CLINIQUE ........................................................................ 9
CONTRE-INDICATIONS............................................................................................. 10
MISES EN GARDE ..................................................................................................... 10
PRÉCAUTIONS .......................................................................................................... 11
RÉACTIONS INDÉSIRABLES .................................................................................... 18
SYMPTÔMES ET TRAITEMENTS DE LA SURDOSE ..................................................19
POSOLOGIE ET ADMINISTRATION .......................................................................... 20
INFORMATIONS PHARMACEUTIQUES .................................................................... 22
FORMES PHARMACEUTIQUES OFFERTES ............................................................ 23
PHARMACOLOGIE .................................................................................................... 24
TOXICOLOGIE ........................................................................................................... 29
BIBLIOGRAPHIE ........................................................................................................ 32
RENSEIGNEMENTS DESTINÉS AUX PATIENTS...................................................... 34

Monographie de produit OMEPRAZOLE-20 Page 3 de 40
MONOGRAPHIE DE PRODUIT
NOM DU MÉDICAMENT
Pr OMEPRAZOLE-20
Capsules d’oméprazole à libération retardée
Oméprazole à 20 mg
Norme maison
CLASSE THÉRAPEUTIQUE
Inhibiteur de l’H+, K+-ATPase
NOTE : Lorsqu’on utilise OMEPRAZOLE-20 en association avec l’amoxicilline, la
clarithromycine ou le métronidazole, il faut consulter la monographie de ces médicaments et en
observer les consignes.
MODE D’ACTION ET PHARMACOLOGIE CLINIQUE
L’oméprazole inhibe l’enzyme gastrique H+, K+ -ATPase (ou pompe à protons), qui catalyse
l’échange des ions H+ et K+. L’oméprazole inhibe efficacement la sécrétion d’acide gastrique,
basale ou stimulée. Le degré d’inhibition est proportionnel à la dose. L’administration orale
quotidienne de 20 mg et plus d’oméprazole procurait une maîtrise efficace et constante de
l’acidité gastrique. On obtenait une réduction moyenne de l’acidité gastrique de 24 heures
d’environ 80 % avec des doses répétées de 20 mg par jour.
Il est démontré que l’oméprazole en monothérapie inhibait Helicobacter pylori (H. pylori,
bactérie fortement associée aux maladies acido-peptiques) sans l’éradiquer. Environ 90 à
100 % des patients atteints d’ulcère duodénal et 80 % des patients atteints d’ulcère gastrique
sont infectés par H. pylori. L’expérience clinique a révélé une synergie entre l’oméprazole et
certains antibiotiques dans l’éradication de H. pylori. L’éradication de la bactérie est associée au
soulagement des symptômes, à la guérison des lésions muqueuses, à une fréquence réduite de
récidive d’ulcère duodénal, à une rémission prolongée de l’ulcère peptique et à un besoin moins
fréquent d’utiliser un traitement antisécrétoire à long terme.
On n’a signalé aucun changement cliniquement significatif de la biodisponibilité (SSC, Cmax) de
l’amoxicilline lors d’association avec l’oméprazole chez des volontaires sains.
La biodisponibilité (SSC) et la demi-vie de l’oméprazole, ainsi que la biodisponibilité (SSC) et la
Cmax de la clarithromycine augmentaient lorsque ces produits étaient associés chez des
volontaires sains.

Monographie de produit OMEPRAZOLE-20 Page 4 de 40
On n’a signalé aucun changement cliniquement significatif de la biodisponibilité (SSC, Cmax) du
métronidazole lors d’association avec l’oméprazole chez des volontaires sains.
L’oméprazole est rapidement absorbé. Après une première dose orale, 35 % environ du
médicament sont absorbés du tractus digestif. Après une semaine de traitement, le
pourcentage absorbé est de 43 %. Ni la nourriture ni l’acidité n’ont d’effet sur la biodisponibilité.
Le pic plasmatique est atteint en 4 heures environ.
La demi-vie plasmatique terminale est d’environ 40 minutes. L’effet antisécrétoire de
l’oméprazole est directement proportionnel à la SSC, et ne dépend pas de la concentration
plasmatique du moment. L’oméprazole est lié à 95 % aux protéines plasmatiques.
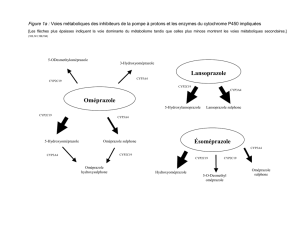
L’oméprazole est soumis à un effet de premier passage par les cytochromes P450,
principalement dans le foie, sous l’effet des CYP 2C19 et 3A4. L’isozyme CYP 2C19, qui
participe à la biotransformation de tous les inhibiteurs de la pompe à protons existants, existe
sous plusieurs formes. Environ 3 % des Caucasiens et 15-20 % des Asiatiques sont appelés
métaboliseurs lents, car leur enzyme CYP 2C19 est non fonctionnelle.
Après administration intraveineuse ou orale, environ 80 % de la dose sont retrouvés sous forme
de métabolites urinaires, les 20 % restants étant excrétés dans les selles.

Monographie de produit OMEPRAZOLE-20 Page 5 de 40
Biodisponibilité comparée
Une étude de biodisponibilité comparative à l’insu, croisée en deux phases, avec répartition
aléatoire et à dose unique a été menée chez des volontaires masculins en bonne santé et à
jeun. Les résultats obtenus chez les 18 volontaires ayant terminé l’étude sont résumés dans le
tableau ci-dessous. La vitesse et le degré d’absorption de l’oméprazole ont été mesurés et
comparés après l’administration d’une dose orale unique (2 capsules de 20 mg)
d’OMEPRAZOLE-20 (oméprazole) à 20 mg (Sivem Produits Pharmaceutiques ULC) et de
capsules Losec® (oméprazole) à 20 mg (Astra Pharma).
Tableau 1
Oméprazole
(2 x 20 mg)
D’après les données mesurées
Moyenne géométrique
Moyenne arithmétique (CV en %)
Paramètre
Test*
Référence
†
Rapport des
moyennes
géométriques
# (%)
Intervalle de
confiance à 90 %
(%)
ASCT (ng•h/mL) 1 194
1 503 (77) 1 161
1 425 (73) 103,6
96,1 – 111,7
ASCI (ng•h/ml) 1 215
1 526 (77) 1 190
1 468 (75) 102,8
95,4 – 110,7
Cmax (ng/ml) 682
795 (58) 671
764 (54) 102,5
87,5 – 120,2
Tma
§
(h)
x
2,15 (36)
2,48 (52)
T½
§
(h)
0,80 (40)
0,82 (45)
* Capsules d’OMEPRAZOLE-20 (oméprazole) à 20 mg (Sivem Produits Pharmaceutiques ULC)
† Les capsules de Losec® (oméprazole) à 20 mg (Astra Pharma) ont été achetées au Canada.
# Fondé sur l’estimation des moindres carrés de la moyenne géométrique.
§
Exprimée sous forme de moyennes arithmétiques (CV %) seulement.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
1
/
40
100%