Dosage du dioxyde de soufre

15/04/2017 840899243 1/1
TS
Thème 1 : L’eau - Eau et environnement
TP
Spécialité
Dosage du dioxyde de soufre
Chap.1
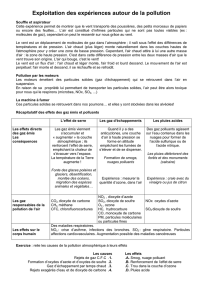
But du TP : Le dioxyde de soufre est principalement émis par les industries et les centrales thermiques. Les
combustibles (fuel ou charbon) contiennent du soufre qui se transforme en dioxyde de soufre lors de leur
combustion. C’est un gaz irritant, traceur de la pollution industrielle. Soluble dans l’eau, il contribue à
l’acidification des eaux de pluie par formation d’acide sulfurique. Il faut donc évaluer sa concentration.
I. Préparation de la solution
Vous devez préparer 100,0 mL de solution de dioxyde de soufre en dissolvant 0,40 g de sulfite de sodium Na2SO3
dans de l’acide chlorhydrique à 1,0 10-1 mol.L-1.
Proposer un protocole expérimental pour cette préparation.
Le mettre en œuvre après accord du professeur.
II. Dosage du dioxyde de soufre
1. Etude qualitative
1.1. Expérience 1
Dans un tube à essais contenant quelques millilitres de la solution de dioxyde de soufre, ajouter goutte à
goutte et en agitant une solution de permanganate de potassium de concentration C1 = 10 mmol.L-1.
Poursuivre cette introduction tant que la décoloration est rapide.
Identifier les espèces présentes dans ce mélange :
1.1.1 Prélever quelques gouttes du mélange et les introduire dans une solution d’hydroxyde de sodium
(Na+(aq) + HO-(aq)). Observer.
1.1.2 Verser dans le mélange restant, quelques gouttes d’une solution de chlorure de baryum
(Ba2+(aq) + Cl-(aq)). Observer.
Remarques :
Les ions manganèse Mn2+(aq) réagissent avec les ions hydroxyde HO-(aq) pour donner un précipité marron
jaunâtre d’hydroxyde de manganèse Mn(OH)2
Les ions baryum Ba2+(aq) réagissent avec les ions sulfates SO42-(aq) pour donner un précipité blanc de
BaSO4
1.1.3 Pourquoi peut-on affirmer qu’une réaction se produit lors de l’ajout de la solution de permanganate de
potassium ?
1.1.4 Identifier les espèces produites lors de cette réaction en utilisant les résultats des tests d’identification
effectués.
1.1.5 La réaction qui se produit est une réaction d’oxydoréduction. Identifier le couple relatif au dioxyde de
soufre SO2 (aq) et celui relatif à l’ion permanganate MnO4-(aq). En déduire l’équation de la réaction.
1.2. Expérience 2
Dans un tube à essais contenant quelques millilitres de la solution de dioxyde de soufre, ajouter la solution de
permanganate de potassium jusqu’à la recoloration permanente du mélange réactionnel.
1.2.1 Pourquoi la solution ne se décolore-t-elle plus lorsque l’on poursuit l’addition du permanganate ?
1.2.2 Justifier que cette réaction peut être utilisée comme support d’un titrage.
2. Etude quantitative
Elaborer un protocole expérimental pour déterminer la concentration en dioxyde de soufre d’un volume V=
10 mL de solution par dosage colorimétrique
Le mettre en œuvre après accord du professeur.
2.1. En utilisant l’équation établie précédemment et un tableau d’avancement, exprimer la quantité de dioxyde de
soufre de la prise d’essai en fonction de la quantité de permanganate de potassium versée.
2.2. En déduire la concentration en dioxyde de soufre de la solution initialement préparée.
1
/
1
100%