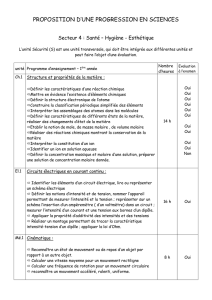
Quantité de matière et concentration molaire

Classe de 2nde – TP de CHIMIE – NOM :
Quantité de matière et concentration molaire
Deux formules fondamentales en Chimie :
n=
m
M
nquantité de matière en mol
mmasse en g
M masse molaire en g/mol
c=
n
V(cconcentration (molaire) en mol/L
nquantité de matière en mol
V volume de solution en L
1–Introduction
On part d’un exemple :
On dissout 0,36 g d’aspirine dans 400 mL d’eau.
La formule topologique de l’aspirine est :
O OH
O
O
1. Écrire la formule semi-développée de cette molécule à côté de la formule topologique.
2.
Cette molécule fait partie de 2 catégories de composés organiques oxygénés
1
. Entourer les 2 groupes caractéristiques
oxygénés et donner pour chacun le nom de la catégorie ainsi mise en évidence.
3. Quelleestlaformulebrute?...........................................................................................
4. Quelle est la masse molaire de l’aspirine? Détailler. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5. Quelle est la quantité de matière d’aspirine dans 0,36 g d’aspirine?
.........................................................................................................................
.........................................................................................................................
6.
Quelle est la concentration molaire de la solution d’aspirine fabriquée en dissolvant 0,36 g d’aspirine dans 400 mL
d’eau?
.........................................................................................................................
.........................................................................................................................
2–Fabrication d’une solution titrée de soude
Attention! la soude est dangereuse pour la peau, les yeux et les habits.
1. La soude s’appelle aussi hydroxyde de sodium. Quelle est sa formule brute? . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
2. Quelleestlamassemolairedelasoude?..............................................................................
3.
À l’aide d’une balance précise au décigramme, peser environ 2 g de soude. Quelle est la masse pesée (au dg près)?
m=....................................................................................................................
4. En déduire la quantité de matière de soude :
.........................................................................................................................
.........................................................................................................................
5.
Mettre une hauteur d’environ 1 cm d’eau dans une fiole jaugée de 200 mL. Ajouter avec précaution la soude pesée,
mettre le bouchon et agiter jusqu’à dissolution. Compléter avec de l’eau distillée jusqu’au trait de jauge. Mettre le
bouchon et bien agiter. Calculer la concentration molaire de soude.
.........................................................................................................................
.........................................................................................................................
1
. Les composés organiques oxygénés sont : alcool, aldéhyde, cétone, acide carboxylique, ester et éther. Prendre la fiche «Nomenclature IUPAC
des composés organiques»
1

3–Dosage de la soude par l’acide chlorhydrique
Attention! l’acide chlorhydrique est aussi dangereux pour la peau, les yeux et les habits.
1. La soude est une base. La soude est un composé ionique. Quels sont les 2 ions qui la composent? . . . . . . . . . . . . . . . . .
2.
La formule brute de l’acide chlorhydrique est
HC`
. C’est un composé ionique. Quels sont les 2 ions qui la com-
posent?................................................................................................................
3.
Au cours de la réaction entre un acide et une base, un ion fourni par l’acide réagit avec un ion fourni par la base
pour donner de l’eau.
(a) Quel est l’ion fourni par la base et qui produira l’eau? . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
(b) Quel est l’ion fourni par l’acide et qui produira l’eau? . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
(c) Écrire l’équation de la réaction qui produit l’eau :
...................................................................................................................
4.
Remplir une burette avec de l’acide chlorhydrique (flacon marqué
HC`
H
+
,
C`–
ou H
3
O
+
,
C`–
). En bas, l’acide doit
remplir la partie en dessous du robinet jusqu’à l’embouchure et en haut, bien régler jusqu’au 0.
5. Verser une partie de la fiole jaugée dans un bécher.
Prendre une pipette de 10 mL. Bien regarder si la pipette est à 1 ou 2 traits.
À l’aide d’une propipette (poire) vidée de son air, aspirer 10 mL de soude (donc jusqu’au trait du haut) et vider le
contenu jusqu’au trait du bas (s’il existe, sinon jusqu’en bas) dans un petit bécher ou un erlenmeyer.
Ajouter 2 gouttes BBT (bleu de bromothymol).
Placer ce récipient sous la burette, sur l’agitateur magnétique et mettre en route une agitation modérée.
Verser par petites quantités l’acide contenu dans la burette jusqu’au changement de couleur.
Attention : le changement de couleur a lieu brutalement.
Pour quel volume précis (appelé volume équivalent) le changement de couleur a-t-il eu lieu? . . . . . . . . . . . . . . . . . . . . .
4–Questions
1. Quelle est la concentration de l’acide chlorhydrique indiquée sur le flacon? . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
2. Quelle est la couleur du BBT :
— enmilieubasique,...............................................................................................
— enmilieuneutre,.................................................................................................
— enmilieuacide...................................................................................................
3. On démontre que
cA·VA=cB·VB
avec cAconcentration molaire de l’acide
VAvolume d’acide versé
cBconcentration molaire de base
VBvolume de base dosée
On suppose que la valeur calculée au §2 est approximative et on souhaite la vérifier avec ce dosage.
Exprimer cBen fonction de cA, VAet VB:
.........................................................................................................................
.........................................................................................................................
Calculer cB
.........................................................................................................................
.........................................................................................................................
2
1
/
2
100%