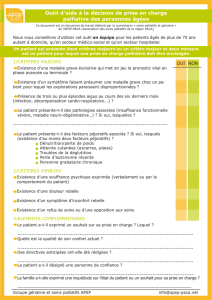
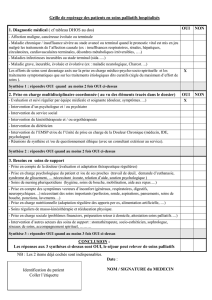
Chimiothérapie palliative ou plutôt soins palliatifs?

ARTICLE DE REVUE
Markus Bornera, Daniel Rauchb
Introduction

ARTICLE DE REVUE
Une chimiothérapie palliative
doit-elle être mise en place?
Patient Reported Outcomes
Assessment Tools
Cas clinique 1

ARTICLE DE REVUE
Cas clinique 2
Communiquer sur le pronostic
et les espoirs
Figure 1:

ARTICLE DE REVUE
(forecas-
ting)
Jonctions entre les soins palliatifs
et la chimiothérapie palliative

ARTICLE DE REVUE
Perspective
Figure 2:
A
B
C
A
B
C
 6
6
 7
7
 8
8
1
/
8
100%