Une analyse complémentaire de l`étude ATHENA montre

1 / 3
Communiqué de presse Sanofi-aventis
Sanofi-aventis www.sanofi-aventis.com
Relations Presse : Tél. : (+) 33 1 53 77 44 50 - E-mail : [email protected]
Relations Investisseurs : Tél. : (+) 33 1 53 77 45 45 - E-mail : [email protected]
Une Analyse Complémentaire de l’étude ATHENA
Montre que Multaq® (dronédarone) Réduit
le Risque d’Accident Vasculaire Cérébral chez des
Patients atteints de Fibrillation Auriculaire
- Cette analyse a montré que Multaq® (dronédarone) réduisait le risque d’accident
vasculaire cérébral de 34% chez des patients atteints de fibrillation auriculaire ou de
flutter auriculaire recevant déjà un traitement antithrombotique adapté -
Paris, France, le 3 Septembre 2008 – Les résultats d’une analyse post-hoc des données de
l’étude ATHENA ont été présentés aujourd’hui lors d’une session scientifique du congrès 2008 de
la Société Européenne de Cardiologie à Munich en Allemagne. Les précédents résultats de l’étude
ATHENA ont montré que Multaq®, un médicament en cours de développement, réduisait
significativement de 24 % (p = 0,00000002) le risque d’hospitalisations cardiovasculaires ou de
décès toutes causes (critère de jugement principal de l’étude) comparé au groupe placebo, en
complément des traitements conventionnels.
Une analyse post-hoc des résultats de l’étude ATHENA portant sur un critère d’évaluation
secondaire non pré-spécifié, révèle que Multaq® réduit le risque d’accident vasculaire cérébral
(ischémique ou hémorragique) de 34 % (46 vs 70 événements respectivement, p = 0,027) chez des
patients qui présentaient une fibrillation auriculaire ou un flutter auriculaire et faisaient déjà l’objet
d’un traitement adapté par antithrombotiques.
La réduction significative du risque d’accident vasculaire cérébral (AVC) s’est ajoutée à l’effet du
traitement antithrombotique (anticoagulant oral et/ou antiagrégant plaquettaire). De même que pour
le critère de jugement principal de l’étude qui rassemblait hospitalisations cardiovasculaires et
décès, cet effet s’est manifesté tôt et s’est maintenu tout au long de la période de suivi de l’étude
(12 à 30 mois).
‘’Les données de l’étude ATHENA marquent un changement de paradigme dans la prise en charge
de la fibrillation auriculaire, puisque c’est la première fois qu’un antiarythmique a un impact sur le
risque d’hospitalisation cardiovasculaire ou de décès toutes causes confondues. L’accident
vasculaire cérébral est une complication fréquente et grave de la fibrillation auriculaire. Il représente
une cause majeure de décès et de handicap à long terme. Ces nouveaux résultats démontrent le
profil unique de Multaq®, au-delà de son activité intrinsèque sur le maintien du rythme sinusal et le
contrôle de la fréquence cardiaque’’ a déclaré le Professeur Stuart Connolly, du Service de
Cardiologie de l’université Mc Master, Hamilton Canada, et co-investigateur principal de l’étude
ATHENA.

2 / 3
Les effets indésirables les plus fréquemment rapportés, comparativement au placebo, et mis en
évidence par le critère secondaire pré-spécifié de tolérance, sont de type digestif (26 % contre
22 %), et cutané (10 % contre 8 %, essentiellement des éruptions).
Une légère élévation de la créatinine sanguine (4,7 % contre 1 %) due à l’inhibition de la sécrétion
tubulaire de la créatinine dans les reins a également été observée. Le mécanisme lié à
l’augmentation de la créatinine sanguine a été bien défini lors d’une étude distincte réalisée chez
des volontaires sains. Le profil de tolérance cardiovasculaire de Multaq® établi par l’étude ATHENA
révèle un faible risque d’effet pro-arythmique et pas d’augmentation du nombre d’hospitalisations
pour insuffisance cardiaque congestive. Le taux d’arrêt prématuré de traitement pendant l’étude
était comparable dans les deux groupes étudiés.
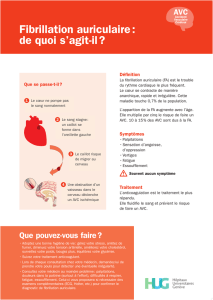
A propos de la fibrillation auriculaire, du flutter auriculaire et de l’accident vasculaire
cérébral
La fibrillation auriculaire (FA) est l’arythmie cardiaque la plus courante en pratique clinique et elle
est un des facteurs de risque indépendants d’AVC les plus importants. Souvent responsable de
handicap neurologique permanent et de décès, l’AVC est un problème de santé publique majeur.
La fibrillation auriculaire multiplie par 5 le risque d’AVC. De plus, elle est responsable de 15 à 20 %
de l’ensemble des AVC, la probabilité que le patient reste grabataire étant alors 2,2 fois plus
importante comparativement à d’autres causes d’AVC.
La fibrillation auriculaire est un motif d’hospitalisation important et une cause majeure de mortalité,
et touche environ 2,5 millions de personnes aux États-Unis et 4,5 millions dans l’Union européenne.
Selon les prévisions de l’ ‘’Atrial Fibrillation Foundation’’, le nombre de patients atteints de FA
devrait doubler dans les 20 prochaines années. Sans traitement adapté, la FA peut entraîner des
complications graves comme un AVC ou une insuffisance cardiaque congestive.
A propos de l’étude ATHENA
ATHENA est la seule étude de morbi-mortalité évaluant en double aveugle un antiarythmique chez
des patients présentant une fibrillation auriculaire. Elle a été menée dans plus de 550 centres dans
37 pays et a porté sur un total de 4628 patients.
Les patients étudiés étaient âgés de 75 ans ou plus (avec ou sans facteurs de risque
cardiovasculaires) ou plus de 70 ans avec au moins un facteur de risque cardiovasculaire
supplémentaire (hypertension artérielle, diabète, antécédent d’accident vasculaire cérébral, taille de
l’oreillette gauche supérieure à 50 mm ou fraction d’éjection ventriculaire gauche inférieure à 40 %).
Les patients étaient répartis par randomisation entre un groupe recevant Multaq® 400 mg deux fois
par jour et un groupe recevant un placebo, et la durée maximale du suivi était de 30 mois.
L’étude ATHENA avait pour objectif de démontrer un bénéfice potentiel de Multaq® vis-à-vis du
critère d’évaluation principal composite associant mortalité toutes causes confondues et
hospitalisations cardiovasculaires, comparativement à un placebo. Les critères d’évaluation
secondaires pré-spécifiés dans le protocole incluaient les décès toutes causes confondues, les
décès d’origine cardiovasculaire et les hospitalisations pour raison cardiovasculaire. Un autre
critère d’évaluation secondaire prédéfini était l’incidence des effets indésirables observés pendant
le traitement (entre la première et la dernière prise du produit à l’étude plus 10 jours) et qui
comprenaient : tous les effets indésirables, les effets indésirables graves et les effets indésirables
ayant conduit à l’arrêt du traitement pendant l’étude.
Une analyse post-hoc des AVC portant sur un critère d’évaluation secondaire non précisé au
protocole a été effectuée pour confirmer le bénéfice apporté par Multaq® chez les patients atteints
de fibrillation auriculaire ou de flutter auriculaire, à savoir la réduction de complications
cardiovasculaires majeures comme l’AVC qui est une cause importante d’hospitalisation
cardiovasculaire et de décès dans cette population de patients.

3 / 3
A propos de Multaq® (dronédarone)
Multaq® est un médicament en développement et le seul antiarhythmique qui a montré une
réduction de la morbidité et de la mortalité chez les patients atteints de fibrillation auriculaire ou
flutter auriculaire avec un profil de tolérance favorable et un faible risque d’effet pro-arythmique
(incluant les torsades de pointe) et de toxicité organique extra cardiaque.
Multaq®, découvert et développé par la recherche de sanofi-aventis, a été étudié dans le cadre d’un
développement clinique où ont participé plus de 7000 patients. Multaq® représente l’une des
innovations thérapeutiques majeures des vingt dernières années dans la fibrillation auriculaire.
La Food and Drug Administration américaine (FDA) a accordé une revue prioritaire à Multaq® et un
dossier d’enregistrement est également examiné par l’Agence européenne des médicaments.
A propos de sanofi-aventis
Sanofi-aventis, un leader mondial de l’industrie pharmaceutique, propose des solutions adaptées
aux enjeux locaux de santé publique grâce à une offre complète de médicaments et de vaccins,
pour améliorer la vie.
Déclarations prospectives
Ce communiqué contient des déclarations prospectives (au sens du U.S. Private Securities Litigation Reform Act of
1995). Ces déclarations ne constituent pas des faits historiques. Ces déclarations comprennent des projections relatives
au développement de produits et à leur potentiel et des estimations ainsi que les hypothèses sur lesquelles celles-ci
reposent, des déclarations portant sur des projets, des objectifs, des intentions et des attentes concernant des
événements, des opérations, des produits et des services futurs ou les performances futures. Ces déclarations
prospectives peuvent souvent être identifiées par les mots « s'attendre à », « anticiper », « croire », « avoir l’intention
de », « estimer » ou « planifier » , ainsi que par d’autres termes similaires. Bien que la direction de sanofi-aventis estime
que ces déclarations prospectives sont raisonnables, les investisseurs sont alertés sur le fait que ces déclarations
prospectives sont soumises à de nombreux risques et incertitudes, difficilement prévisibles et généralement en dehors du
contrôle de sanofi-aventis, qui peuvent impliquer que les résultats et événements effectifs réalisés diffèrent
significativement de ceux qui sont exprimés, induits ou prévus dans les informations et déclarations prospectives. Ces
risques et incertitudes comprennent notamment les incertitudes inhérentes à la recherche et développement, les futures
données cliniques et analyses, y compris postérieures à la mise sur le marché, les décisions des autorités
réglementaires, telles que la FDA ou l’EMEA, d’approbation ou non, et à quelle date, de la demande de dépôt d’un
médicament, d’un procédé ou d’un produit biologique pour l’un de ces produits candidats, ainsi que leurs décisions
relatives à l’étiquetage et d’autres facteurs qui peuvent affecter la disponibilité ou le potentiel commercial de ces produits
candidats, l’absence de garantie que les produits candidats s’ils sont approuvés seront un succès commercial,
l’approbation future et le succès commercial d’alternatives thérapeutiques ainsi que ceux qui sont développés ou
identifiés dans les documents publics déposés par sanofi-aventis auprès de l'AMF et de la SEC, y compris ceux
énumérés dans les rubriques « Facteurs de risque » et « Déclarations prospectives » du document de référence 2007 de
sanofi-aventis ainsi que dans les rubriques « Risk Factors » et « Cautionary Statement Concerning Forward-Looking
Statements » du rapport annuel 2007 sur Form 20-F de sanofi-aventis, qui a été déposé auprès de la SEC. Sanofi-aventis
ne prend aucun engagement de mettre à jour les informations et déclarations prospectives sous réserve de la
réglementation applicable notamment les articles 223-1 et suivants du règlement général de l’autorité des marchés
financiers.
CONTACT :
Philippe BARQUET
Tél : +33 (0)6.70.48.61.28
E-mail : [email protected]
1
/
3
100%