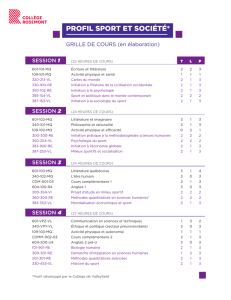
etude oracle

ObservatoiRe des modalités de prescription de l’Audc dans
la prise en charge des ChoLEstases
ETUDE ORACLE
COMITÉ SCIENTIFIQUE
Pr JP. Bronowicki
Pr O. Chazouillères
Pr S. Erlinger
Dr H. Hagège
Dr B. Hanslik
Pr P. Mathurin
Dr A. Pariente
PROMOTEUR
LABORATOIRE MAYOLY SPINDLER
6, avenue de l’Europe
BP 51
78401 Chatou Cedex (France)
Référent Médical :
MONITEUR
VIVACTIS INSIGHT
2, rue Sainte Marie
92418 Courbevoie (France)
ANALYSE STATISTIQUE
Alexis Bonis
B3TSI

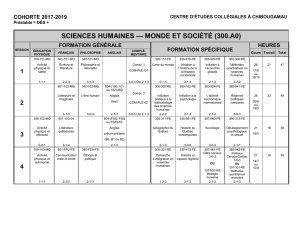
PROTOCOLE DE L’ENQUETE
Titre ObservatoiRe des modalités de prescription de l’Audc dans la prise en charge des
ChoLEstases
Nom de l’étude ETUDE ORACLE
Population
Patients diagnostiqués et traités par AUDC pour une cholestase chronique
Une cholestase est diagnostiquée si et seulement si
- la concentration en phosphatases alcalines est supérieure ou
égale à 1,5N
- Et la concentration en gamma GT est supérieure ou égale à 3N
Echantillon
interrogé Etude menée auprès de 100 gastroentérologues hospitaliers, mixtes ou libéraux
ayant des patients atteints de maladie cholestatique
Objectifs de
l'étude
Objectif principal
− Décrire les patients traités pour une cholestase et leur prise en charge
Profils des patients
Bilans réalisés (clinique, biologique, imagerie, fibroses…)
Origine de la cholestase ; pathologie associée
Par qui le patient est-il adressé pour un diagnostic ?
Qui pose le diagnostic de cholestase ?
Sur quels critères (bilan biologique ou autre…) ?
Qui initie le traitement par AUDC ?
Objectifs secondaires
− Décrire les modalités de traitement
Les produits prescrits
Posologie initiale et réévaluation des posologies
Durée du traitement réelle ou estimée
Motif d’arrêt du traitement
− Décrire les motifs d’arrêt ou de modifications de traitement
Selon les critères biologiques, cliniques, radio …
− Evaluer la part des cholestases inexpliquées parmi la population de patients
traités pour une cholestase
Recrutement et
nombre de
médecins
Le Comité Scientifique présente l’étude aux membres des sociétés savantes et
aux autres composantes professionnelles de l’hépato-gastroentérologie.
Les médecins souhaitant participer à cette étude s’inscrivent sur un site en ligne
pour recevoir leurs codes de connexion.
Sont attendus a priori 100 inscriptions
Nombre de
patients
Chaque médecin recueillera les données de 2 patients en mode prospectif et d’1
patient en mode rétrospectif
Objectif :
200 patients en mode prospectif
100 patients en mode rétrospectif
Durée Durée totale du recueil rétrospectif: 6 mois (mars 2012 à septembre 2012)
Durée totale du recueil prospectif: 18 mois (mars 2012 à septembre 2013)
Critères
d’inclusion
Etude rétrospective :
Patient diagnostiqué et traité par AUDC pour une cholestase chronique depuis au
moins 6 mois vu en consultation pour l’évaluation de son traitement entre 9 et 12
mois après l’initiation
OU
Etude prospective :
Patient nouvellement diagnostiqué chez qui un traitement par AUDC est initié le
jour de la consultation

Critères
d’exclusion
Transplantation hépatique
Age < 18 ans
Grossesse
3 questionnaires
par patient
1. Questionnaire consultation d’initiation du traitement
2. Questionnaire évaluation de la maladie à 6 mois
3. Questionnaire évaluation de la maladie à 12 mois
Etude rétrospective :
Les 3 questionnaires peuvent être complétés en une fois
Etude prospective :
Les 3 questionnaires sont complétés en 3 temps : au moment de l’initiation du
traitement, lors de son évaluation à environ 6 mois et lors de son évaluation à
environ 12 mois
Méthodologie
statistique
Analyse descriptive et explicative
Population décrite : tous les patients inclus
Variables décrites :
1. Questionnaire d’initiation du traitement
Données sociodémographiques
Antécédents du patient
Découverte de la cholestase
Données biologiques (Gamma GT, phosphatases alcalines, ASAT, ALAT,
bilirubines, gamma globulines, albumine, anticorps, TP, plaquettes,
cholestérol, triglycérides et glycémie)
Données d’imageries
Données sur les fibroses et lésions hépatiques
Maladie responsable de la cholestase
Traitement initial du patient (produit, posologie, associations)
2. Questionnaire d’évaluation à 6 mois
Données cliniques
Données biologiques (Gamma GT, phosphatases alcalines, ASAT, ALAT,
bilirubines, gamma globulines, albumine, anticorps, TP)
Effets secondaires ?
Modification du traitement ?
Arrêt du traitement ?
3. Questionnaire d’évaluation à 12 mois
Données cliniques
Données biologiques (Gamma GT, phosphatases alcalines, ASAT, ALAT,
bilirubines, gamma globulines, albumine, anticorps, TP)
Effets secondaires ?
Modification du traitement ?
Arrêt du traitement ?
Variables quantitatives : effectif, moyenne ± écart type, médiane, valeurs
extrêmes et données manquantes.
Variables qualitatives : effectif, pourcentage et données manquantes.
Intervalles de confiance bilatéraux à 95% si le critère est considéré comme pertinent

Vos contacts
pour l’étude
Christine FERRET
Présidente
01.46.67.84.01
Lauren Hiribarne
Chargée d’études
01.46.67.84.02
l.hiribarne@vivactis-insight.com

Planning de l’étude
Mars 2011 Mars 2012 Mars 2013Septembre
2012
Inclusion des
patients
Collecte des
données
Initiation du tt
Septembre
2011 Septembre
2013
Inclusion des
patients
Consultation
d’initiation
Mode
rétrospectif
Mode
prospectif
Évaluation à 6 mois Évaluation à 12 mois
Évaluation à 6 mois Évaluation à 12 mois
Collecte
des données
Début du
terrain Fin du terrain
prospectif
Fin du terrain
rétrospectif
Inclusion des
patients
Initiation du
traitement
Inclusion des
patients
Initiation du
traitement
Collecte
des données
1
/
5
100%