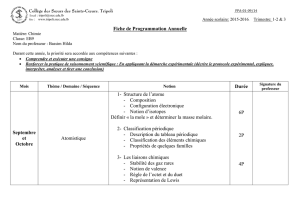
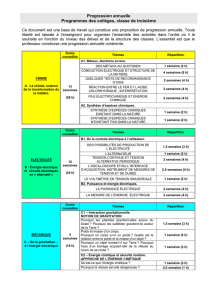
corrigé - Site Maintenance in progress

NOTE : .….../ 200
OLYMPIADES NATIONALES DE LA CHIMIE
EPREUVES REGIONALES 2011
ACADEMIE RESTE DU MONDE
CORRIGE - BAREME
D ’ après Académie de Nancy-Metz

Olympiades de la Chimie 2011
Epreuve écrite régionale
Partie 1 : Analyse des eaux
1. Dureté totale
La dureté totale d’une eau est un indicateur de la teneur globale en ions calcium et
magnésium. Si une eau dure n’est pas dangereuse pour la santé humaine, en revanche elle
présente des inconvénients d’ordre domestique.
Quel est le principal inconvénient d’une eau dure ?
Formation de tartre par précipitation des carbonates de calcium et magnésium 1
Comment appelle-t-on l’indice qui mesure la dureté de l’eau ?
titre hydrotimétrique ou T.H. 1
Pour déterminer la concentration en ions calcium et magnésium, on effectue un dosage
volumétrique.
Quel est généralement l’agent titrant utilisé et pourquoi ?
L’EDTA qui forme des complexes très stables avec le calcium et le magnésium 1+1
Quel indicateur est alors utilisé pour repérer l’équivalence et pourquoi?
NET ou noir ériochrome T
Le NET forme avec le calcium et le magnésium des complexes de couleur rose-rouge
(accepter violet)
A l’équivalence les deux cations sont intégralement complexés avec l’EDTA. Il n’y a plus de
complexes avec le NET d’où le passage du rose au bleu, couleur de l’indicateur libre au pH
de travail
1+1
2. Mesure de la pollution organique d’une eau
2.3.1. Pour évaluer la pollution organique d’une eau brute, on souhaite mesurer la demande
d’oxygène (exprimée en mg de O2 par litre d’eau) que le milieu exerce afin d’oxyder et donc
de minéraliser ces matières organiques. Plusieurs paramètres sont mesurables. Ils
correspondent aux sigles suivants : IP, DBO5, DCO, COT.
IP indice permanganate
DBO5 demande biochimique en oxygène en 5 jours
DCO demande chimique en oxygène
COT carbone organique total
2.3.2. Mesure de l ’ IP
A une prise d’essai E = 200 mL d’eau brute, on ajoute en milieu acide, une quantité connue
et en excès de solution de permanganate de potassium de concentration C0 égale à
2,00×10-2 mol.L-1. La solution est violacée. Puis après 10 minutes de chauffage à l’ébullition,
Page 2 Total page

Olympiades de la Chimie 2011
Epreuve écrite régionale
on ajoute une quantité connue d’une solution d’oxalate de sodium et on observe la
décoloration de la solution. On titre alors le milieu réactionnel par la solution de
permanganate de potassium précédente jusqu’à coloration rose pâle.
Le volume de solution de permanganate de potassium versé à l’équivalence est Ve = 8,0 mL.
On réalise par ailleurs un témoin en suivant le même mode opératoire mais en remplaçant
l’eau brute par le même volume d’eau déminéralisée. Le volume de solution de
permanganate de potassium versé à l’équivalence est alors Vt = 3,0 mL
Ecrire les demi-équations redox correspondant aux couples MnO4-/Mn2+ et CO2/C2O42- (l’ion
C2O42-est l’ion oxalate), puis l’équation de la réaction entre MnO4-et C2O42-.
MnO4- + 8 H++ 5 e- = Mn2+ + 4 H2O 1
2 CO2 + 2 e-= C2O42- 1
2 MnO4- + 16 H+ + 5 C2O42- = 10 CO2 + 2 Mn2+ + 8 H2O
Ou 2 MnO4- + 6 H+ + 5 H2C2O4 = 10 CO2 + 2 Mn2+ + 8 H2O1
Donner l’expression littérale de la quantité de matière n de permanganate ayant réagi avec
l’échantillon d’eau brute.
2
IP est exprimé en utilisant comme oxydant le dioxygène.
Ecrire la demi-équation redox correspondant au couple O2/H2O.
O2 + 4 H++ 4 e- = 2 H2O 1
Exprimer la quantité de matière n’ de dioxygène « équivalente » à la quantité n de
permanganate.
1 mole de permanganate peut capter 5 moles d’électrons.
1 mole de dioxygène peut capter 4 moles d’électrons
1 mole de permanganate de potassium équivaut donc à 1,25 moles de dioxygène (5/4) donc
n’= 1,25 n
1
IP représente la masse de dioxygène qui serait consommée par litre d’eau brute (en mg de O2/L).
Exprimer la quantité de dioxygène consommée par litre d’eau brute en fonction de C0, Ve, Vt et E.
1
Montrer que , sachant que M(O2) = 32 g.mol-1.
Pour obtenir IP, il suffit de multiplier ce terme par la masse d’une mole de dioxyène (en mg) 2
L’eau brute étudiée a-t-elle une oxydabilité inférieure à 10 mg/L ?
Pour l’eau étudiée I.P = 20 mg/L : elle ne respecte pas la limite d’oxydabilité de 10 mg/l 1
2.2. COT : Certains composés organiques résistent à l’oxydation chimique et ne sont donc pas
comptabilisés dans la DCO. Pour les oxyder complètement, il faut une méthode plus
énergique : ils subissent une combustion totale à 950 °C par le dioxygène gazeux.
Page 3 Total page

Olympiades de la Chimie 2011
Epreuve écrite régionale
La quantité de dioxyde de carbone formée est déterminée par photométrie à 2400 cm -1
.
A quelle longueur d’onde correspond ce nombre d’onde ?
λ= 1/σ = 1/2400 cm soit environ 4×10-4cm soit 4×10-6 m ou 4000 nm 2
Dans quel domaine du spectre lumineux se trouve cette longueur d’onde ?
Infra-rouge 1
Avant de déterminer le carbone organique contenu dans un échantillon, à froid, on l’acidifie
tout d’abord (pH inférieur à 2) puis on dégaze l’échantillon (par exemple en faisant barboter
de l’azote qui n’absorbe pas à 2400 cm-1). On détecte une absorption à 2400 cm-1.
(Le pKa du couple est de 6,4 et celui du couple 10,3).
Pour étalonner un COT-mètre, on peut utiliser une solution d’éthylène-glycol dont vous avez
ci-dessous la formule topologique :
OH
OH
Données : Masses molaires en g.mol-1 : H : 1 C : 12 O : 16
Donner le nom de cette molécule en nomenclature recommandée par l’IUPAC ainsi que sa
formule brute et sa masse molaire.
Ethane-1,2-diol C2H6O2M = 62 g.mol-1. 3
Ecrire l’équation de la réaction de combustion totale de l’éthylène-glycol dans le dioxygène.
C2H6O2 + 5/2 O2= 2 CO2 + 3 H2O 1
On souhaite préparer une solution d’éthylène-glycol ayant un COT de 480 mg/L (le COT est
exprimé en mg de carbone par litre de solution).
Quelle devra être la concentration molaire de cette solution ?
1 mole d’éthylène glycol peut libérer 2 moles de carbone (sous forme de CO2) soit 24 g de
carbone.
Pour obtenir une solution ayant un COT de 480 mg de carbone/L, il faut donc que la
concentration de la solution soit de : C = (1 × 480/24 000) = 0,0200 mol.L-1
1
+1
+1
Partie 2 : Les techniques de traitement de l’eau
1. Les besoins et les usages en eau
1.1. Les usages de l’eau sont très variés. On peut néanmoins les classer en 3 grandes
catégories.
Quelles sont ces 3 catégories ?
Usages alimentaires, domestiques et industriels 3
Quels procédés pouvant être qualifiés de thermique, nucléaire, hydraulique nécessitent des
quantités d’eau considérables ?
Page 4 Total page

Olympiades de la Chimie 2011
Epreuve écrite régionale
Les procédés de production d’énergie électrique 1
Le stress en eau est de plus en plus important, en particulier autour de l’équateur.
Dans les 40 prochaines années, quel phénomène va conduire à des besoins en eau toujours
plus considérables ?
L’explosion démographique (population passant de 6 à 9 milliards entre 2010 et 2050) 1
Deux raisons justifient le développement des techniques de dessalement de l’eau de mer.
Lesquelles ?
97% de l’eau provient des océans et des mers et
environ 1/3 de la population vit en bord de mer 2
Quelle alternative au dessalement est envisagée pour couvrir les besoins en eau ?
Sa réutilisation (aujourd’hui - de 50% de l’eau est traitée et seulement 5% est recyclée) 1
1.2. Les objectifs du traitement de l’eau sont nombreux. On distingue globalement 5 grands
objectifs à atteindre isolément ou simultanément.
Quels sont les 5 objectifs du traitement de l’eau ?
Eliminer les risques chimiques ou biologiques 1
Respecter des critères organoleptiques 1
Diminuer l’impact environnemental 1
Diminuer les phénomènes de corrosion et d’entartrage 1
Adapter la composition de l’eau au procédé 1
On distingue généralement les techniques biologique et physico-chimique, les deux pouvant
éventuellement être couplées.
Quel critère primordial sur la pollution est considéré pour envisager l’une ou l’autre des techniques ?
La plus ou moins grande biodégradabilité de la pollution 1
2. Techniques d’extraction de la pollution non dissoute
2.1. Comment appelle-t-on une eau débarrassée de sa pollution non dissoute ?
Une eau clarifiée 1
2.2. Selon que les polluants sont moins denses ou plus denses que l’eau, on privilégie une
séparation respectivement par flottation et par décantation.
Quelles sont les trois forces mises en jeu dans ces 2 techniques de séparation ?
Poids (pesanteur), poussée d’Archimède, forces de frottements 3
Page 5 Total page
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%