Intérêts et enjeux de la recherche sur les cellules souches

imprimer la page
Colonie de cellules souches
embryonnaires (Yacine
Laâbi © Inserm/AbCys)
Intérêts et enjeux de la recherche sur les cellules
souches embryonnaires humaines
Cette dernière décennie a vu la recherche sur les cellules souches
embryonnaires humaines (hES) se développer considérablement. En effet,
ces cellules ne cessent de susciter l’intérêt des scientifiques, notamment pour
leur immense potentiel thérapeutique. L’Inserm ne fait pas exception à la
règle et tente de se faire une place dans ce domaine.
Il y a tout juste dix ans, une lignée de cellules souches embryonnaires
humaines était réalisée pour la première fois au monde par une équipe
américaine*. Depuis lors, les recherches menées sur les cellules hES n’ont
cessé de se développer, en raison notamment des enjeux thérapeutiques
considérables qu’elles suscitent. Néanmoins, l’élargissement de ce domaine
de recherche a dû faire face à un obstacle majeur : la législation, qui
interdisait, dans de nombreux pays, l’accès aux cellules d’embryons humains
dits « surnuméraires », issus de la fécondation in vitro et voués à la
destruction. En France, les chercheurs ont dû attendre fin 2004 pour obtenir
les dérogations nécessaires pour pouvoir travailler sur les cellules
embryonnaires humaines. Depuis, plusieurs équipes se sont formées et ont
développé différents projets, avec l’envie de rattraper le retard accumulé ces
dernières années.
Pourquoi travailler sur des cellules ES ?
Les cellules souches embryonnaires proviennent de l’embryon humain aux
tout premiers stades de son développement, quelques jours seulement après
la fécondation. Ces cellules sont dites « pluripotentes » : elles peuvent se
répliquer indéfiniment (autorenouvellement), proliférer en culture et se
différencier en plus de 200 types de tissus. Au cours du développement, elles
ont vocation à former tous les tissus de l’organisme. C’est notamment sur
cette capacité que reposent les espoirs actuels en termes d’applications
biologiques et médicales. Elles pourraient en effet constituer un réservoir
Inserm−Actualités
1

permanent de cellules pour réparer les organes malades ou endommagés.
Dans certains cas, elles pourraient même remplacer la greffe d’organes.
(I−Stem, unité Inserm 861 −
Auteur : Laurent Audinet)
Mais qu’en est−il des cellules souches adultes ? N’ont−elles pas autant de
potentiel que les cellules ES ? L’interdiction législative et les nombreux
débats éthiques sur les cellules hES ont poussé les chercheurs à travailler
intensément sur les cellules souches adultes. Présentes dans la plupart de
nos tissus, ces cellules sont dites « multipotentes ». Elles sont également
capables de s’autorenouveler et de se différencier en plusieurs autres types
de tissus, mais elles sont déjà engagées dans une certaine direction, donc
déjà déterminées. Par exemple, les cellules hématopoïétiques des
mammifères donnent des globules rouges, des plaquettes, des lymphocytes
T ou B, des macrophages, mais elles ne peuvent pas donner de cellules
musculaires. Les cellules souches adultes offrent donc un potentiel plus
restreint que les cellules ES, tant sur le plan de la différenciation que de la
prolifération (les cellules souches hématopoïétiques cultivées in vitro ne se
divisent qu’une demi−douzaine de fois).
Les chercheurs plaçaient cependant beaucoup d’espoir dans les cellules
souches adultes, d’autant que leur utilisation ne pose aucun problème
éthique. Mais, au cours des dix dernières années, les travaux menés ont
montré leurs limites. Pour ces raisons, les scientifiques reviennent aujourd’hui
vers les cellules ES, ou tentent par modification génétique de donner toutes
les "qualités" (multipotence et auto−renouvellement) des cellules ES à des
cellules souches adultes.
Des applications porteuses d’espoirs
La thérapie cellulaire est certainement le champ d’application le plus
attrayant, avec des enjeux médicaux considérables. Quel médecin n’a jamais
espéré pouvoir réparer entièrement les tissus endommagés de ses patients ?
Cette médecine régénérative pourrait se substituer à terme aux traditionnelles
greffes d’organes.
Inserm−Actualités
2

(I−Stem, unité Inserm 861 −
Auteur : Laurent Audinet)
Mais la recherche sur les cellules hES permet également de progresser dans
la connaissance du développement humain. Grâce au criblage de génomique
fonctionnelle et au criblage pharmacologique, les chercheurs espèrent
notamment mieux comprendre le développement de certaines maladies
génétiques et identifier les molécules susceptibles de restaurer un
développement normal. Par ailleurs, l’étude des mécanismes altérant
l’autorenouvellement des cellules ES pourraient à terme permettre d’élucider
certains mécanismes moléculaires à l’origine de la formation des tumeurs.
Enfin, il existe un autre champ d’application qui émerge : la toxicologie
prédictive. L’objectif est de développer des lignées de cellules hES afin de les
utiliser pour des tests cellulaires in vitro. Elles permettraient alors de prédire
les éventuels effets délétères de substances chimiques et d’identifier les
risques pour la santé humaine, mais aussi d’évaluer l’efficacité et l’innocuité
de molécules à visée thérapeutique. Avec un objectif : limiter
l’expérimentation animale.
Plusieurs équipes de l’Inserm s’intéressent à ces différents champs
d’application. Dans ce dossier, certaines d’entre elles nous présentent leurs
travaux, afin d’illustrer et de mieux saisir tous les enjeux et les espoirs placés
dans les cellules hES.
Pour terminer, un retour est nécessaire sur la loi de bioéthique votée en
2004, et encadrant les recherches sur les cellules embryonnaires, afin de
mieux comprendre le cadre très strict dans lequel sont menés ces travaux en
France. Une réforme de la législation étant prévue pour 2009, on peut
également se demander ce que les chercheurs peuvent en espérer.
* Thomson JA, et al. Embryonic stem cells lines derived from human
blastocysts. Science 1998 ; 282 : 1145−7.
Liens utiles :
− Dossier "Cellules souches", Inserm actualités n° 196 (février 2006)
− Dossier d'information Inserm "Cellules souches"
− Programme national de recherche sur les Cellules Souches (PNRCS)
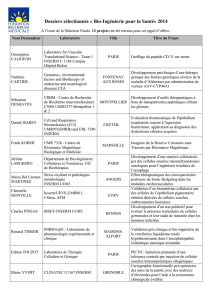
Diversité des recherches Inserm consacrées aux cellules ES humaines
Inserm−Actualités
3

En France, la majorité des équipes ayant reçu de l'Agence de la biomédecine l’autorisation de
travailler sur les cellules hES appartiennent à la recherche académique, et pour une très
grande part à l’Inserm (22 protocoles sur 35, et 15 des 26 équipes autorisées).
La figure ci−dessous, réalisée avec le concours de Laure Coulombel (unité Inserm 602),
présente l'ensemble de ces équipes, ainsi que l'objectif de leur projet de recherche.
Appartenance des équipes
1 : unité Inserm 602, Villejuif ; 2 : unité Inserm 782, Clamart ; 3 : unité Inserm 846, Bron ; 4 :
unité Inserm 847, Montpellier ; 5 : unité Inserm 861, Evry ; 6 : unité Inserm 596, Strasbourg ; 7
: unité Inserm 790, Villejuif ; 8 : CNRS UMR 1142, Montpellier ; 9 : CNRS UMR 9922, Paris ;
10 : unité Inserm 661, Montpellier ; 11 : unité Inserm 898, Nice ; 12 : unité Inserm 894, Paris ;
13 : unité Inserm 804, Le Kremlin−Bicêtre ; 14 : unité Inserm 632, Montpellier ; 15 : unité
Inserm 903, Reims ; 16 : unité Inserm 893, Paris ; 17 : unité de Biologie des populations
lymphocytaires, Institut Pasteur, Paris ; 18 : unité Inserm 841, Evry.
Bibliographie des équipes
− Assou S, Le Carrour T, Tondeur S, Ström S, Gabelle A, Marty S, Nadal L, Pantesco V, Réme
T, Hugnot JP, Gasca S, Hovatta O, Hamamah S, Klein B, De Vos J. A meta−analysis of
human embryonic stem cells transcriptome integrated into a web−based expression atlas.
Stem Cells 2007 ; 25 : 961−73.
− Tomescot A, Leschik J, Bellamy V, Dubois G, Messas E, Bruneval P, Desnos M, Hagège
AA, Amit M, Itskovitz J, Menasché P, Pucéat M. Differentiation in vivo of cardiac committed
human embryonic stem cells in postmyocardial infarcted rats. Stem Cells 2007 ; 25 : 2200−5.
− Aberdam E, Barak E, Rouleau M, de LaForest S, Berrih−Aknin S, Suter DM, Krause KH,
Amit M, Itskovitz−Eldor J, Aberdam D. A pure population of ectodermal cells derived from
human embryonic stem cells. Stem Cells 2008 ; 26 : 440−4.
− Wianny F, Bernat A, Huissoud C, Marcy G, Markossian S, Cortay V, Giroud P, Leviel V,
Kennedy H, Savatier P, Dehay C. Derivation and cloning of a novel rhesus ES cell line stably
expressing Tau−GFP. Stem Cells 2008 ; Mar 20.
Intérêts et enjeux de la recherche sur les cellules souches
embryonnaires humaines
•
De la particularité des cellules souches : Autorenouvellement et
différenciation
•
Modéliser les maladies les plus rares en créant des lignées de cellules
souches
•
Rôle potentiel des cellules souches dans la régénération d’organes• Criblage génomique et pharmacologique : deux techniques exploitant
les cellules souches
•
Prédire les effets délétères dans les cultures de cellules• Loi de bioéthique : des recherches sous haute surveillance• Entretien avec Marc Peschanski, Directeur scientifique de l'Istem•
Inserm−Actualités
4

Premier symposium FISH−ESC*
Organisé sous l’égide du programme Ingecell du pôle de compétitivité
Medicen, le premier symposium international sur la recherche sur les cellules
souches embryonnaires humaines s’est tenu du 31 janvier au 2 février 2008
au Genopole d’Evry, avec le soutien de l’Inserm, de l’AFM, du PRES
UniverSud et du Conseil Régional d’Ile de France. Des scientifiques du
monde entier se sont rassemblés pour exposer et échanger leurs idées dans
ce domaine d’avant−garde. Ils ont notamment évoqué les nombreuses
difficultés auxquelles sont confrontées les équipe travaillant sur les cellules
souches embryonnaires, qu'elles soient éthiques ou pratiques. En tout, 29
présentations ont été proposées au cours de trois sessions successives :
recherche fondamentale et différenciation, expériences des sociétés de
biotechnologie et programme européen.
Lors de ce symposium, plusieurs intervenants ont présenté leurs travaux
concernant les différents gènes impliqués dans la différenciation cellulaire,
dont une meilleure connaissance permettrait d’améliorer la production de
cellules pluripotentes induites (iPS) à partir de cellules adultes. D’autres
chercheurs ont exposé les données qu’ils avaient recueillies sur les
différentes anomalies génétiques qui engendrent des cellules cancéreuses et
favorisent l’effet « boule de neige » entraînant l’apparition de tumeur. Autres
thèmes évoqués, la potentialité des cellules souches dans la modélisation
des maladies rares et les futures applications thérapeutiques de ce matériel
vivant.
Retrouvez le compte−rendu complet du symposium FISH−ESC dans le
dernier numéro de Médecine/Sciences (avril 2008, volume 24, n° 4,
419−426, disponible en ligne sur BiblioInserm).
* First International Symposium on Human Embryonic Stem Cell Research.
Inserm−Actualités
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%