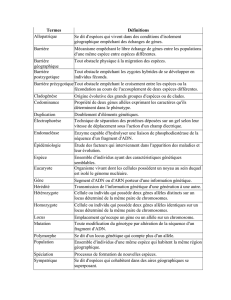
Cartographie génétique des génomes eucaryotes

Références bibliographiques
Ouvrages
•An introduction to genetic analysis, 6th ed. A.F. Griffiths et al., 1998.
Editeur: W.H. Freeman and Company, New York
•Genetics the continuity of life. D.J. Faibanks and W.R. Andersen, 1999.
Editeur: Brooks/Cole Publishing Company, Pacific Grove, CA
•Gene V. B. Lewin, 1995
Editeur: Oxford University Press Inc, New York
•Biologie moléculaire et médecine, 2ème ed. J.C. Kaplan et M. Delpech, 1998
Editeur: Flamarion Médecine-sciences, Paris
•Génétique; gènes et génomes. J.L. Rossignol et al., 2000
Editeur: Dunod, Paris
•Génétique. A. Oulmouden et al., 1999
Editeur: Dunod, Paris
•Analyse de génomes, transcriptomes et protéomes, 3ème ed.. A. Bernot,
2001. Editeur: Dunod (collection Biotech. Info), Paris

Cartographie génétique des génomes eucaryotes
Construction de cartes génétique
1. Marqueurs génétiques
2. Types de descendances
3. Méthodes d'établissement des cartes génétiques
4. Caractéristiques des cartes génétiques

Exemple de pénétrance et d'expressivité incomplète :
•pigmentation des graines chez le pois, sous le contrôle d'un gène
majeur avec A dominant/a
En cas de pénétrance et d'expressivité totale:
Génotype A•→phénotype , Génotype aa →phénotype
Phénotype des individus A•
Fond génétique (milieu) 1
Pénétrance incomplète (56%)
Fond génétique (milieu) 2
Expressivité incomplète
Fond génétique (milieu) 3
Pénétrance et expressivité incomplète
Pénétrance incomplète: impossible d'associer le phénotype à un
génotype sans risque de se tromper

Structure d'un gène d'eucaryotes et de son promoteur
Site d'initiation
de la transcription
Substitution
nucléotidique Site d'initiation
de la traduction
Site de terminaison
de la transcription
promoteur exon 1 intron 1 intron 2
exon 2 exon 3
Site donneur
Site
donneur
Site
accepteur Site
accepteur
Site de
polyadénylation
Insertion
courte/E.T.
délétion
Substitution
nucléotidique
Site d'arrêt de la
traduction (stop)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
1
/
63
100%