1. DENOMINATION DU MEDICAMENT Tardyferon 80 mg

Résumé des Caractéristiques du Produit
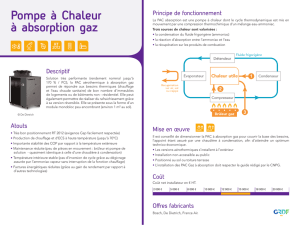
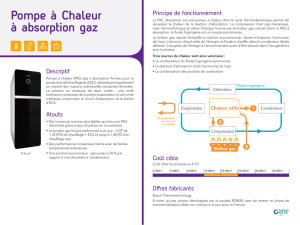
1. DENOMINATION DU MEDICAMENT
Tardyferon 80 mg, comprimés enrobés
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Sulfate ferreux sesquihydrate : 256,30 mg (correspondant à 80 mg de fer)
Excipients à effet notoire : Saccharose et huile de ricin hydrogénée
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé enrobé
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Prévention et traitement de l’anémie ferriprive.
4.2 Posologie et mode d’administration
Posologie
Le Tardyferon est destiné aux adultes.
La dose quotidienne habituellement administrée en cas d’anémie ferriprive est de l’ordre de 100 à 200
mg de Fe++ c'est-à-dire 1 à 2 comprimés enrobés par jour. Chez la femme enceinte, la posologie sera de
1 comprimé enrobé par jour.
Les besoins quotidiens en fer sont :
- chez l’homme : 0,5 à 1 mg
- chez la femme : 0,7 à 2 mg
Chez la femme enceinte au premier, deuxième et troisième trimestre de la grossesse, les besoins
quotidiens sont respectivement de 13, 18 et 23 mg.
Il est communément reconnu que des doses de 40 mg à 100 mg par jour sont efficaces en ce qui
concerne la prévention d’une insuffisance en fer chez 80% à 90% chez la femme enceinte.
- Femmes allaitantes : 10-15 mg
Durée du traitement : chez l’adulte, les réserves de fer sont de 600 mg pour la femme et 1.200 mg pour
l’homme. L’anémie par carence martiale s’accompagnant d’une déplétion des réserves, le traitement
devra corriger l’anémie et reconstituer ces réserves.
Le traitement substitutif doit être poursuivi jusqu’à normalisation de l’hémoglobinémie et restauration
des réserves en fer, déterminées par un contrôle des taux sériques du fer et de la ferritine. Par voie
orale, on observe généralement après 4 à 6 semaines de traitement, une augmentation des taux
d’hémoglobine et, après 10 semaines, une hémoglobinémie normale.
En règle générale, on prescrira un traitement d’attaque par Tardyferon d’une durée non inférieure à 4,
voire 6 semaines afin de normaliser les taux d’hémoglobine. La thérapie sera poursuivie durant au
moins 6 semaines afin de combler les réserves en fer.
La reconstitution de la teneur en fer de l’organisme peut nécessiter 3 à 6 mois de traitement.
1/6

Résumé des Caractéristiques du Produit
Mode d’administration
Les comprimés ne doivent pas être sucés, mâchés ou gardés dans la bouche, mais avalés entiers avec
de l’eau.
Les comprimés doivent être pris avant ou pendant les repas, en fonction de la tolérance gastro-
intestinale.
4.3 Contre-indications
- Hypersensibilité à la substance active ou à l’un des excipients ou des résidus mentionnés à la
rubrique 6.1.
- Toutes les formes d’anémies autres que l’anémie ferriprive.
- Tout état caractérisé par une hypersidérémie
4.4 Mises en garde spéciales et précautions d’emploi
Il est important en cas d’anémie de poser un diagnostic préalablement à l’instauration du traitement.
La sidéropénie associée aux syndromes inflammatoires n'est pas sensible au traitement martial.
Le traitement martial doit, dans la mesure du possible, être associé au traitement de la cause.
Ne pas administrer Tardyferon à des enfants.
Conserver le médicament hors de portée des enfants.
Interrompre le traitement par Tardyferon quelques jours avant un test à la benzidine, en raison d’un
risque de faux positifs.
Poursuivre le traitement jusqu’à correction de l’anémie (Hb et VGM normaux) et reconstitution des
réserves en fer (normalisation du fer sérique et de la saturation de la sidérophylline), ce qui peut
demander plusieurs mois.
Ce médicament contient du saccharose. Des patients avec des affections héréditaires rares comme
intolérance au fructose, une malabsorption de glucose-galactose ou un déficit en sucrase-isomaltase ne
doivent pas prendre ce médicament.
En raison de la présence d’huile de ricin, ce médicament peut provoquer des troubles digestifs (maux
d’estomac et diarrhée).
En raison du risque de coloration dentaire et d’ulcération buccale, les comprimés ne doivent pas être
sucés, croqués ou gardés dans la bouche mais ils doivent être avalés entièrement avec un grand verre
d’eau.
4.5 Interactions avec d’autres médicaments et autres formes d’interaction
Associations déconseillées :
Les sels de fer injectables causent une lipothymie, voire un choc attribué à la libération rapide du fer
de sa forme complexe et à la saturation de la sidérophiline.
Associations faisant l’objet de précautions d’emploi :
Les sels de fer administrés par voie orale réduisent l'absorption digestive des médicaments suivants :
- cyclines (formation de complexes),
- pénicillamine (augmentation du risque de toxicité de la D-penicillamine quand le traitement avec le
sulfate ferreux est stoppé),
- bisphosphonates,
- fluoroquinolones (ciprofloxacine, lévofloxacine, norfloxacine, ofloxacine, témafloxacine),
2/6

Résumé des Caractéristiques du Produit
- méthyldopa, lévodopa et carbidopa,
- hormones thyroidiennes (conduisant à une hypothyroxinémie).
En conséquence, ces médicaments doivent être administrés à distance des sels de fer (par exemple 2
heures).
Les antiacides, la cholestyramine, le calcium et le zinc diminuent l’absorption du fer.
Pour les antiacides, le calcium et le zinc, veiller à laisser un intervalle de deux heures minimum avant
l'administration orale de sels de fer. Les cholestyramines doivent être données une à deux heures avant
ou quatre heures après la prise des sels de fer.
Autres formes d’interaction
Les acides phytiques (céréales complètes), polyphénols (thé, café, vin rouge), le calcium (lait, produits
laitiers) et quelques protéines (œufs) inhibent significativement l’absorption du fer.
Prendre les sels de fer à distance de ces aliments (plus de 2 heures si possible).
4.6 Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas d’études suffisamment pertinentes chez la femme enceinte.
Cependant, les analyses de données cliniques bibliographiques disponibles ne montrent aucune
anomalie congénitale du fœtus chez les femmes enceintes traitées avec un supplément de fer.
De plus les études animales n’indiquent pas de toxicité pour la reproduction.
Les besoins quotidiens en fer de la femme enceinte (30-50 mg) ou qui allaite (15 mg), sont
difficilement couverts par les seuls apports alimentaires. L’administration de Tardyferon en permet le
complément.
Allaitement
Le fer apparaît dans le lait maternel, mais il n’y a pas d’études sur les effets adverses possibles du fer
dans le lait maternel.
Les données de littérature montrent qu’un supplément de fer excrété dans le lait maternel est d’environ
0,25 mg/jour pendant un allaitement normal.
Aucun effet de Tardyféron n’a été montré chez les nouveau-nés allaités / nourrissons dont les mères
sont traitées.
Fertilité
Les études animales n’indiquent aucun effet sur la fertilité mâle et femelle.
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Tardyferon n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
4.8 Effets indésirables
Le tableau ci dessous présente les effets indésirables observés sur 7 études cliniques, comptabilisant au
total 1.051 patients dont 649 patients sous Tardyferon, et pour lesquels le lien de causalité ne peut pas
être exclu avec le produit.
Les effets indésirables sont répertoriés selon la classification de systèmes d’organes MedDRA et
énumérés ci-dessous comme : très fréquent (≥ 1/10), fréquent (≥ 1/100 à <1/10), peu fréquent
(≥ 1/1.000 à <1/100), rare (≥ 1/10.000 à <1/1.000), très rare (<1/10.000), fréquence indéterminée (ne
peut être estimée sur la base des données disponibles).
3/6

Résumé des Caractéristiques du Produit
Fréquent
(≥ 1/100 à
<1/10)
Peu fréquent
(≥ 1/1.000 à
< 1/100)
Fréquence
indéterminée
(ne peut être estimée
sur la base des
données disponibles)
Affections du système
immunitaire
Hypersensibilité,
urticaire
Affections respiratoires,
thoraciques et
mediastinales
Oedème laryngé
Affections gastro-
intestinales
Constipation,
diarrhée,
distension
abdominale,
douleur
abdominale,
selles décolorées,
nausée
Fèces anormales,
dyspepsie, vomissement,
gastrite
*Dyschromie
dentaire,
ulcération buccale
Affections de la peau et
du tissu sous cutané
Prurit, éruption
érythémateuse
Depuis la commercialisation, les effets indésirables hypersensibilité, urticaire, ulcération buccale et
dyschromie dentaire sont maintenus dans le tableau des fréquences indéterminées (ne pouvant être
estimées sur la base des données disponibles).
*En cas de mésusage quand les comprimés sont croqués, sucés ou gardés dans la bouche.
Les patients âgés et les patients présentant des troubles de la déglutition peuvent, en cas de fausse
route, présenter un risque de lésion œsophagienne ou de nécrose bronchique.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle
permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de
santé déclarent tout effet indésirable suspecté via l’Agence fédérale des médicaments et des produits
de santé, Division Vigilance, EUROSTATION II, Place Victor Horta, 40/40, B-1060 Bruxelles. Site
internet : www.afmps.be – e-mail : [email protected]
4.9 Surdosage
Surdosage aigu
Après ingestion massive, des cas de surdosage avec les sels de fer ont été rapportés, en particulier chez
l’enfant de moins de 2 ans ; la symptomatologie comporte des signes d’irritation et de nécrose gastro-
intestinale accompagnés dans la plupart des cas de nausées, vomissements et état de choc.
Surdosage chronique
L’hémochromatose ou l’hémosidérose est la conséquence d’une toxicité chronique survenant chez des
individus prédisposés génétiquement ou chez des polytransfusés.
Traitement
Faire vomir le patient et le diriger vers un centre hospitalier. Effectuer un lavage gastrique avec une
solution de bicarbonate de sodium à 1% et éventuellement procéder à un traitement symptomatique, si
nécessaire. Le traitement doit intervenir le plus tôt possible.
4/6

Résumé des Caractéristiques du Produit
L’utilisation d’un agent chélateur comme la déféroxamine est efficace, principalement lorsque la
concentration en fer sérique est supérieure à 5 µg/ml. L’état de choc, la déshydratation et les
anomalies acido-basiques sont traités de façon classique. L’hospitalisation est nécessaire en cas
d’intoxication par le fer.
5. PROPRIETES PHARMACOLOGIQUES
5.1 Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Antianémiques, code ATC : B03AA07
Le fer est un nutriment minéral essentiel qui présente un rôle physiologique clé et qui est nécessaire
dans de nombreuses fonctions telles que le transport de l’oxygène, la production d’ATP, la synthèse
d’ADN et le transport des électrons. Le fer contenu dans le Tardyferon est libéré grâce à un procédé
galénique particulier ; la libération du fer, lente et continue, en l’espace de 7 heures permet un taux
élevé d’absorption.
Mécanisme d’action
Le fer est l’atome central de l’hème. Elément nécessaire à la formation de l’hémoglobine et aux
processus d’oxydation dans les tissus vivants, le fer est aussi un constituant essentiel de la myoglobine
nécessaire à l’exploitation de l’oxygène par les muscles, ainsi que de nombreux enzymes impliqués
dans la respiration cellulaire ou la biotransformation comme les cytochromes, la catalase et les
oxydases.
Effets pharmacodynamiques :
Le fer se distingue des autres minéraux parce que son équilibre dans le corps humain est régulé
seulement par son absorption parce qu’il n’y a pas de mécanisme physiologique d’excrétion. La prise
de sulfate ferreux (FeSO4) est facilitée par le transporteur du fer (DMT1) dans la partie proximale de
l’intestin grêle (duodénum et proximal jéjunum).
La capacité d’absorption des patients anémiques peut être augmentée de plusieurs fois par rapport aux
sujets sains, de sorte que la surface d'absorption est considérablement étendue. Le processus
d’absorption est sensible à divers facteurs diététiques et autres qui peuvent entraver le processus
conduisant à une absorption insuffisante et en conséquence une carence en fer.
Efficacité et sécurité clinique :
Les essais cliniques ont montré que la réponse hématologique (modification de l’hémoglobine) et la
reconstruction des réserves de fer (normalisation de la ferritine) étaient satisfaites par l’administration
orale de sulfate ferreux.
La formulation pharmaceutique particulière de Tardyféron (sulfate ferreux) permet de s’adapter aux
changements de conditions d’absorption du corps humain en cas d’anémie.
5.2 Propriétés pharmacocinétiques
Absorption
L’absorption de fer est un procédé actif qui se passe principalement au niveau du duodénum et de la
partie proximale du jéjunum.
Après la prise orale d’une dose de sulphate de fer la concentration sérique maximale est atteinte en 2
heures et est proportionnelle à la dose de sulfate de fer; la demi-vie est de 6 heures.
Normalement 10 à 35% de la dose orale est absorbée, mais en cas de carence en fer ce taux augmente
jusqu’à 80 à 95%.
La libération graduelle de fer permet une absorption qui s’étend dans le temps.
La biodisponibilité du fer administré – comprimé TARDYFERON – est d’environ 25% comme le
démontre le test d’incorporation du 54 Fe dans l’hémoglobine.
5/6
 6
6
 7
7
1
/
7
100%