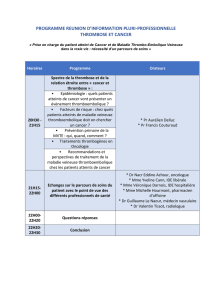
1 - polys-ENC

Polycopié National des Enseignants de Cardiologie / 2002-2003
1
THROMBOSES VEINEUSES PROFONDES
Pierre DJIANE, Alec VAHANIAN
I - INTRODUCTION
C’est l’oblitération plus ou moins complète d’une veine profonde par un thrombus résultant d’une
coagulation intravasculaire localisée. Cette pathologie est indissociable de sa complication
immédiate qu'est l'embolie pulmonaire (EP) ce qui justifie le concept de maladie thromboembolique
veineuse (MTEV). Plus de 80 % des EP sont dues à une thrombose veineuse profonde (TVP) des
membres inférieurs. La MTEV présente un risque immédiat potentiellement vital l'EP, alors qu'à
distance de l'épisode aigu le risque est lié au développement d'une maladie post-thrombotique et
plus rarement à l'évolution vers une pathologie pulmonaire chronique.
II - DONNEES GENERALES
1 – Epidémiologie
Les estimations concernant l'incidence de la MTE sont très imprécises faute d'éléments
diagnostiques fiables puisque même le diagnostic post-mortem est soumis à discussion. En France
l'incidence annuelle de la MTE est de l'ordre de 50 à 100 000 cas responsables de 5 à 10 000 décès.
On constate une augmentation régulière de l'incidence de la MTEV notamment en milieu médical.
Cette augmentation est liée à la proportion de plus en plus importante de sujets âgés dans les
services de médecine.
La MTEV est une pathologie d'accompagnement c'est-à-dire qu'elle vient le plus souvent
compliquer l'évolution d'une autre pathologie ou un geste chirurgical. De ce fait, il s'agit très
fréquemment d'une pathologie acquise en milieu hospitalier. La moitié des patients présentant une
MTEV ont une espérance de vie de l'ordre de 1 an, la mortalité étant essentiellement liée à la
pathologie initiale. La mortalité d'une MTEV non traitée est de l'ordre de 30 %.

Polycopié National des Enseignants de Cardiologie / 2002-2003
2
2 - Physiopathologie et histoire naturelle
La thrombose veineuse est induite par trois facteurs principaux (triade de Virchow) :
• l'altération de la paroi veineuse (facteur pariétal) qui reste un facteur mineur, sauf dans
certaines situations (cathéter veineux central, foyers septiques loco-régionaux...) ;
• la stase veineuse liée à l'alitement ou à l'immobilisation prolongés, à l'insuffisance veineuse
chronique, aux compressions extrinsèques (adénopathies, cancers digestifs ou pelviens) ;
• l’activation des facteurs de la coagulation favorisée par les traumatismes, l’accouchement, la
chirurgie, les déficits acquis ou congénitaux en certains facteurs protecteurs.
Sous l'influence d'un ou plusieurs de ces facteurs, le thrombus se forme dans veines drainées par les
systèmes caves. La majorité des thromboses débute dans les membres inférieurs parce qu’ils sont
plus souvent et plus facilement immobilisés que les membres supérieurs. Le thrombus prend
naissance en général dans un nid valvulaire souvent au niveau des veines du mollet ; il est alors
asymptomatique et peut le rester plusieurs jours.
Lorsque les capacités de lyse physiologique du patient sont dépassées, il y a un risque d'extension
qui se fait en amont et surtout en aval avec un thrombus non adhérent à la paroi comportant un
risque important d'embolie pulmonaire. Secondairement, le thrombus va adhérer à la paroi et
obstruer complètement la lumière vasculaire entraînant un syndrome obstructif responsable des
phénomènes douloureux et de l’oedème. L'évolution se fait à long terme vers la formation d’un
tissu de granulation aboutissant à la rétraction et à l’épaississement de la paroi veineuse avec
éventuellement une recanalisation et la réendothélisation de la veine. Cela aboutit à la destruction
des valvules dont l’incontinence est à l'origine de la maladie post-thrombotique.
3 - Facteurs étiologiques
C’est le plus souvent l’association d’un facteur déclenchant (situation à risque) et de facteurs
favorisants propres au patient qui est à l’origine d’une TVP.
a - Etats favorisant la stase :
• Alitement prolongé : La stase est particulièrement marquée chez l’hémiplégique et
l’insuffisant cardiaque ; les suites d’infarctus du myocarde associent stase et libération de
facteurs prothrombotiques.

Polycopié National des Enseignants de Cardiologie / 2002-2003
3
• Longs voyages en avion, voiture ou train, sans mobilisation des membres inférieurs.
• Varices, séquelles de thrombose veineuse
• Syndrome de Cockett (compression de la veine iliaque primitive gauche par l’artère iliaque
primitive droite, favorisant les thromboses veineuses du membre inférieur gauche).
• Matériel endoveineux (cathéters, filtre cave…).
• Grossesse (la compression utérine et l’hyperoestrogénie favorisent la thrombose), le risque de
maladie thrombo-embolique est 5 fois supérieur chez la femme enceinte.
Le sujet âgé combine plusieurs états favorisant la stase (moindre mobilité, prévalence augmentée
des varices,…).
La femme jeune a un risque plus élevé de thrombose veineuse que l’homme jeune en raison de la
prévalence plus élevée des varices, de la contraception oestro-progestative, des grossesses…
b -Etats favorisant un déséquilibre des facteurs de l’hémostase
• Traumatismes, chirurgie, accouchement : dans ces situations la libération de facteurs
prothrombotiques est souvent associée à la stase. Le risque de TVP post-chirurgicales, en
l'absence de prophylaxie, varie, selon le type de chirurgie, de 10 % en chirurgie générale à
plus de 50% en chirurgie orthopédique d'urgence. La chirurgie carcinologique est à plus haut
risque de thrombose. La thrombose veineuse peut se développer avant, pendant ou après le
geste chirurgical. Ces chiffres doivent être modulés en fonction des facteurs de risque propres
au patient : âge, obésité, antécédents thrombo-emboliques, insuffisance veineuse.
• Cancers : ils associent souvent activation de la coagulation et obstacles au retour veineux. Le
risque thrombogène est maximum pour les cancers du Pancréas, de la Prostate, du Poumon
(P.P.P.), du côlon, du rein, de l'utérus et du sein (rôle des thromboplastines tissulaires). La
TVP complique souvent un cancer connu mais peut en être la première manifestation dans 5 à
10 % des cas, nécessitant des investigations minimales dans certains cas sélectionnés. Les
hémopathies : leucémies, lymphomes, polyglobulies, anémies, hypochromes
hyposidérémiques et thrombocytémies sont aussi génératrices de TVP.
• Médicaments favorisant un état prothrombotique : l'héparine lorsqu’elle est responsable d’une
thrombopénie (< 1 %), les contraceptifs oraux de type oestroprogestatifs (risque relatif
multiplié par 6 si la dose d’oestrogène est supérieure à 50 µg et les antioestrogènes
(Tamoxifène).

Polycopié National des Enseignants de Cardiologie / 2002-2003
4
• Maladies intestinales inflammatoires (rectocolite ulcéro-hémorragique…) : elles favorisent
diverses modifications de l’hémostase.
• Thrombophilie : elle peut être d’origine génétique, historiquement ont été successivement
découvertes les anomalies suivantes :
* le déficit en antithrombine III (1965) retrouvé dans 1 à 4% des cas ;
* les déficits en protéine C( 1981), protéine S (1985) mis en évidence dans 4 à 8 % des cas ;
* la résistance à la protéine C activée "RPCA" (facteur V Leiden), , identifiée en 1993, serait
présente dans près de 20% des cas de TVP inexpliquée; elle constitue la première cause de
TVP liée à une anomalie de l'hémostase ;
* la mutation du gène de la prothrombine (1996)
* l’augmentation du taux de facteur VIII sérique (1998)
La thrombophilie peut également être acquise et liée à une autoimmunité ; le syndrome des
antiphospholipides, particulièrement fréquent chez les lupiques, associe des avortements à répétition
chez la femme, des thromboses veineuses et parfois des thromboses artérielles. Il est dû à des
anticorps dirigés contre plusieurs types de protéines associées à des phospholipides qui portent le
nom d’anticoagulants circulants quoique à l’origine de thromboses. En effet chez les patients
porteurs de ce type d’anticorps, le TCA est spontanément allongé. Leur action prothrombotique
s’explique par leur fixation à la membrane des cellules endothéliales qui altère les mécanismes de
résistance contre la thrombose.
c –Veinites
• dans des maladies de système telle que la maladie de Behcet (associant souvent une aphtose
bipolaire, une uvéite, des rhumatismes inflammatoires, chez des sujets habituellement
originaires du Proche Orient).
• après lésion de la paroi veineuse par perfusion d’un soluté toxique ou par propagation d’un
sepsis.
• lors de l’accumulation dans le sang d’un acide aminé toxique pour l’endothélium,
l’homocystéine.
L’hyperhomocystéinémie est rattachée à des mutations de la cystathionine bétasynthéthase ou,
le plus souvent , de la méthylène tetra-hydrofolate réductase .

Polycopié National des Enseignants de Cardiologie / 2002-2003
5
III -THROMBOSE VEINEUSE PROFONDE DES MEMBRES INFERIEURS
1 - Diagnostic positif
a - Les signes cliniques
Ils résultent de deux facteurs la réaction inflammatoire pariétale et l’obstruction due au caillot. De
l’importance de chacun d’eux va dépendre la symptomatologie clinique ; elle est fruste ou même
absente quand un caillot est non occlusif et ne s’accompagne d’aucun phénomène inflammatoire ;
elle est , au contraire, bruyante quand s’associe à leur plus haut degré, obstruction et inflammation .
Il faut d’emblée insister sur le manque de sensibilité et de spécificité de ces signes qui sont surtout
utiles pour évoquer le diagnostic mais ne permettent jamais à eux seuls de l’affirmer ou de le
réfuter. Leur recherche représente cependant une étape préliminaire indispensable pour porter les
indications aux examens paracliniques : Examiner ne suffit pas mais examiner est nécessaire.
• La douleur est le signe d’appel le plus fréquent et le plus important, elle est présente dans 60 %
des cas. Elle relève de plusieurs mécanismes : la stase, le spasme et l’inflammation de la veine .
Elle peut être spontanée, minime ou absente , elle doit alors être exagérée ou provoquée par la
palpation le long des trajets veineux , par le ballottement ou la compression manuelle du mollet
ou par la dorsi-flexion du pied , c’est le classique signe de Homans qui n’est pas spécifique et
peut s’observer dans certaines atteintes musculo-tendineuses ou articulaires .
• l’oedème n’est présent que lorsque la thrombose entraîne une gêne au retour veineux comme
c’est le cas lorsqu’elle est occlusive et siège au niveau poplité , fémorale et /ou iliaque. Il est dur
résistant et ne prend pas le godet, la peau est de couleur blanche luisante avec une augmentation
de la températurelocale et une dilatation des veines superficielles . Selon la topographie de
l’obstruction il est limité à la jambe (thrombose poplitée) ou s’étend à tout le membre inférieur
(thrombose fémoro-iliaque), se trouve alors réalisé le tableau clinique typique de phlegmatia alba
dolens qui peut être complété par une hydarthrose du genou et des adénopathies inguinales.
En cas d’oedème massif et brutal par blocage aigu du carrefour saphéno-fémoro-iliaque , la mise
en tension sous aponévrotique entraîne une compression de la circulation artérielle ce qui se
manifeste par des signes d’ischémie avec une cyanose s’étendant à tout le membre accompagné
parfois d’un état de choc , c’est la phlegmatia coerulea dolens ou phlébite bleue qui constitue une
urgence thérapeutique .
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%